植物乳杆菌CGMCC.5297产细菌素条件的优化及应用
2014-04-24郑雯,孙琳,宋诙*
郑 雯,孙 琳,宋 诙*
(中国科学院 天津工业生物技术研究所,天津 300308)
细菌素(bacteriocins)是某些细菌产生的具有抗菌活性的多肽、蛋白质或蛋白质复合物[1]。与化学防腐剂相比具有安全无毒副作用、在人体内能被蛋白酶分解无残留、可以同时增加食品风味等优点,因此细菌素作为高效安全的生物防腐剂使用得到了广泛地关注[2-5]。已有研究表明乳酸菌是产细菌素的一类主要菌群,同时由于乳酸菌的生物安全性,其所产的细菌素已作为饲料、食品及医药领域中现在使用的防腐剂和抗生素的替代物进行了大量研究[6-9]。而乳酸菌代谢产生细菌素的能力和产量,除了受菌株自身特性的影响,还受发酵条件的影响,如发酵pH 值[8]、培养基成分、发酵温度[9]以及接种量[10]等。常规的多因子试验设计方法每次改变一个因子,这种方法不仅要求试验的次数多,而且可能导致不可靠的甚至是错误的结论,尤其是对具有交互作用的多因子试验[11]。响应面方法(response surface methodology,RSM)是统计技术的合称,其包括试验设计、建模、因子效应评估以及寻求因子最佳操作条件。随着计算方法和设备的完善和普及,近些年来响应面方法已成功地应用于生物技术的许多方面[12-14],但用于优化细菌素发酵培养基方面尚报道较少。本研究通过以乳酸菌常用,并且细菌素产量较高的乳酸细菌培养基(de Man Rogosa Sharpe medium,MRS medium)为基础,利用响应面方法对影响细菌素产量的培养基各组份进行评价,并对主要影响因子进行优化并得到较好的结果,同时对菌株在优化培养基中的动力学进行了分析,为上罐发酵提供了依据。
1 材料与方法
1.1 材料与试剂
供试菌:从自制奶酪中筛选得到的一株高产细菌素的植物乳杆菌,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏登记号CGMCC.5297;指示菌:单核细胞增多性李斯特菌CVCC1595,天津大学食品系赠送;各种化学及糖(醇)类药品均为分析纯:国产或美国Sigma公司、瑞士Fluka公司;0.2 μm无菌滤膜:北京天为时代科技有限公司;利福平:中国香港GENE公司,货号19-1059;改良MRS液体培养基(蛋白胨10.0 g/L,牛肉膏8.0 g/L,酵母粉4.0 g/L,葡萄糖20.0 g/L,吐温-80 1.0 g/L,K2HPO42.0 g/L,乙酸钠5.0 g/L,柠檬酸三铵2.0 g/L,MgSO4·7H2O 0.2 g/L,MnSO4·4H2O 0.05 g/L,pH 6.8,用于乳酸菌发酵):青岛海博生物有限公司;溶菌肉汤(lysogeny broth,LB)培养基(胰蛋白胨10.0 g/L,酵母粉5.0 g/L,NaCl 10.0 g/L,pH7.0,用于指示菌培养):北京鼎国昌盛生物技术有限责任公司;脑心浸液培养基(brian heart infusion,BHI)(牛脑200.0 g/L,牛心浸出汁250.0 g/L,蛋白胨10.0 g/L 葡萄糖2.0 g/L,NaCl 5.0 g/L,pH 6.8~7.2,用于指示菌活化):北京索来宝科技有限公司;李斯特菌显色平板(蛋白胨和酵母浸出物20.0 g/L,NaCl 5.0 g/L,色素17.5 g/L,琼脂15.0 g/L,pH7.0,用于指示菌计数):青岛海博生物有限公司。
1.2 仪器与设备
SW-CJ-IFD超净台:苏州安泰空气技术有限公司;BSDYF2400恒温摇床:上海博讯实业品有限公司;ELX800酶标仪:美国Bio-Tek公司;655001酶标板:德国GreinerBio-OneGmbH公司;UVmini-1240紫外分光光度计:岛津仪器(苏州)有限公司。
1.3 方法
1.3.1 样品处理方法
将活化过夜的单增李斯特菌按2%接种至BHI 培养液中,37 ℃培养24 h至稳定期,备用。将植物乳杆菌接种至改良MRS液体培养基,30 ℃培养48 h至稳定期,离心取上清,调节pH值为6,无菌滤膜过滤备用。
1.3.2 细菌素抑菌能力的测定
抑菌圈试验选用牛津杯双层平板打孔法[15],指示菌选用单核细胞增多性李斯特菌CVCC1595。
测定效价标准方程[16-18]:准确称取Nisin标准样品配制成25 IU/mL、50 IU/mL、75 IU/mL、100 IU/mL 4个浓度梯度的标准溶液。在打孔的指示平板上每孔中加入不同浓度的Nisin标准样各80 μL,每两个相对的孔中加入同样浓度的Nisin标准液,以消除平板厚度不均引起的误差。30 ℃培养24 h后测量抑菌圈直径,以抑菌圈直径为纵坐标,Nisin浓度对数值为横坐标作标准曲线,接着通过标准曲线计算得出菌株产生细菌素的效价。
细菌素抑菌效力的详细测定:由于牛津杯法测定细菌素效价的灵敏性和准确性有限,无法比较两个样品间的微小区别。因此为保证响应面准确性,在进行响应面试验时,对细菌素抑菌能力的测定选取了更为准确的与指示菌共培养的方法[19-20]。用接种环挑取单核细胞增多性李斯特菌CVCC1595单菌落于5 mL BHI培养基中,37 ℃过夜培养。按1%接种量接于新鲜LB培养基中,37 ℃培养至稳定期。用新鲜LB培养基稀释至菌数约为106CFU/mL。然后每试管分装2.75 mL。植物乳杆菌发酵上清过滤除菌后用无菌MRS稀释至24倍,调节pH至6.0。加250 μL稀释后的无菌上清到2.75 mL菌数为106CFU/mL的单核细胞增多性李斯特菌中。37 ℃培养4 h,测量单核细胞增多性李斯特菌OD600nm。
1.3.3 响应面法优化植物乳杆菌产细菌素的发酵条件优化
Plackett-Burman 试验设计:在单因素试验的基础上[21],选取牛肉蛋白胨、牛肉膏、酵母粉、葡萄糖、K2HPO4、CH3COONa、MgSO4·7H2O、MnSO4·H2O分别作为Plackett-Burman试验的8个因子X1、X2、…X8,选取N=24的Plackett-Burman 试验设计,每个因子选取2 个水平(+1,-1),并加上6 个中心点,以细菌素对李氏杆菌的抑制能力(李氏杆菌OD600nm值)为响应值Y。利用SAS 软件对试验结果进行分析,得出各因素的T值和可信度水平。一般选择可信度>90%的因素作为重要因素进行下一步试验。
最陡爬坡试验:应用SAS 统计分析软件,对Plackett-Burman 试验设计中的结果代入T检验程序,比较试验点处的平均响应值与中心点水平的平均响应值间的差异显著性,以确定响应面中心点。
响应面试验设计:根据响应面的中心组合设计(central composite design,CCD)原理,以细菌素对李氏杆菌的抑制能力(李氏杆菌OD600nm值)为响应值,对Plackett-Burman设计试验中筛选出的显著因素采用Design-Expert(Version 7.0.0)进行中心组合设计,各因素水平取值见表2,其他因素取值则根据正效应因素取较高值、负效应因素取较低值,设计3因素3水平共20个试验点的响应面分析试验。所有试验点重复3次,取平均值。
1.3.4 模型的验证
通过响应面法获得了植物乳杆菌代谢产细菌素的优化发酵条件,在优化条件下进行发酵试验,通过比较预测值和试验值来验证模型的有效性。
1.3.5 植物乳杆菌CGMCC.5297所产细菌素应用的初步评价
将最优培养条件下的植物乳杆菌(Lactobacillus plantarum)CGMCC.5297培养物离心取上清,过滤除菌,调节pH值为6.0。在自制酸奶中接种活化培养好的李氏杆菌至菌数约为106CFU/mL,每试管中分装2.75 mL。各加入250 μL无菌上清或250 μL 无菌MRS培养基为对照。每管重复3次,于4 ℃培养。每天取出3管进行计数,分别将酸奶稀释103、104、105倍,每稀释梯度涂5个李斯特菌显色培养基平板。李氏杆菌会在平板上显示透明圈。
2 结果与分析
2.1 Plackett-Burman 试验
通过Plackett-Burman 试验设计评价的8 个因子中,葡萄糖、牛肉膏、酵母粉的浓度对细菌素产量存在显著影响,并进行下一步最陡爬坡试验。而其他5个因素对细菌素产量没有显著影响,因此在后续的试验中取值确定为Plackettburman试验设计的高点取值。
2.2 最陡爬坡试验
对Plackett-Burman 试验设计中的结果代入T检验程序,比较中心点水平的平均响应值与试验点处的平均响应值间的差异显著性,所得结果如表1 所示。由表1 显示的检验结果可知,方差齐性检验的结果Pr<0.05,说明中心点与试验点方差非齐性;由此得出T 检验的结果Pr <0.05,说明曲面够曲,中心点与试验点间存在显著差异,即Plackett-Burman 试验设计中选取的中心点已经接近最大的响应区域内,不需要通过最陡爬坡试验进一步靠近最优点。
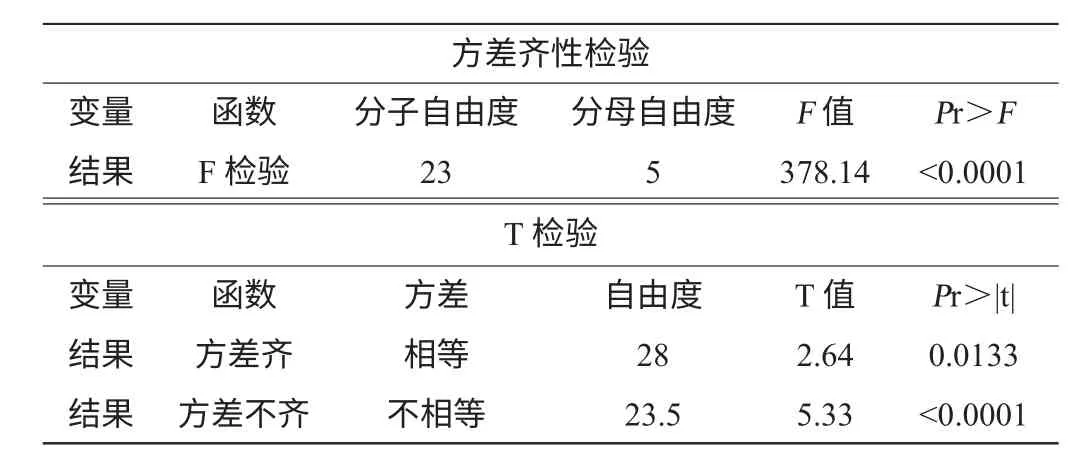
表1 T检验结果Table 1 Result of T test
2.3 响应面试验及模型的建立
响应面试验设计及结果见表2。对上述回归模型进行方差分析,结果见表3。利用Design Expert 7.0.0软件对表2数据进行多元回归拟合,获得的响应值细菌素对李氏杆菌的抑制能力(李氏杆菌OD600nm值)为对编码自变量A(酵母粉)、B(牛肉膏)和C(葡萄糖)的二次多项式回归模型方程为Y=1.550 86-0.112 76A-0.026 9B-0.041 9C+3 412AB+34 500AC-41 562BC+5 432A2+1 415B2+42 264C2。结果表明:模型的P=0.015<0.05,表明回归方程的F检验显著,所拟合的二次回归方程适合。失拟系数P=0.057 3>0.05,说明失拟相对误差不显著,回归模型的决定系数为0.973 4,说明该模型能够解释97.34%的变化,该模型拟合程度良好,试验误差小。因此,可用此模型对植物乳杆菌发酵产细菌素的条件进行预测和分析。回归方程中各变量对响应值影响的显著性由F检验来判定,概率P值越小,则相应变量的显著程度越高。由回归方程系数显著性检验可知:模型一次项均不显著;交互项AC、BC均处于显著水平,AB不显著;二次项A2、C2显著。
利用Design Expert 软件对表2 数据进行二次多元回归拟合,所得到的二次回归方程的响应面及等高线见图1。由图1可知,葡萄糖和酵母粉,葡萄糖和牛肉膏分别对细菌素产量的交互影响显著,酵母粉和牛肉膏对细菌素产量的交互影响不显著。通过方程可知,二次项的系数均为正值,其所表征的抛物面开口向上,具有极小值点。利用Design Expert 软件,进行分析计算,可得合成细菌素的最佳培养条件为:酵母粉5.09 g/L,牛肉膏10.85 g/L,葡萄糖55.34 g/L。在此条件下细菌素的效价预测值为37 ℃培养4 h后,单核细胞增多性李斯特菌OD600nm值为0.001 716。
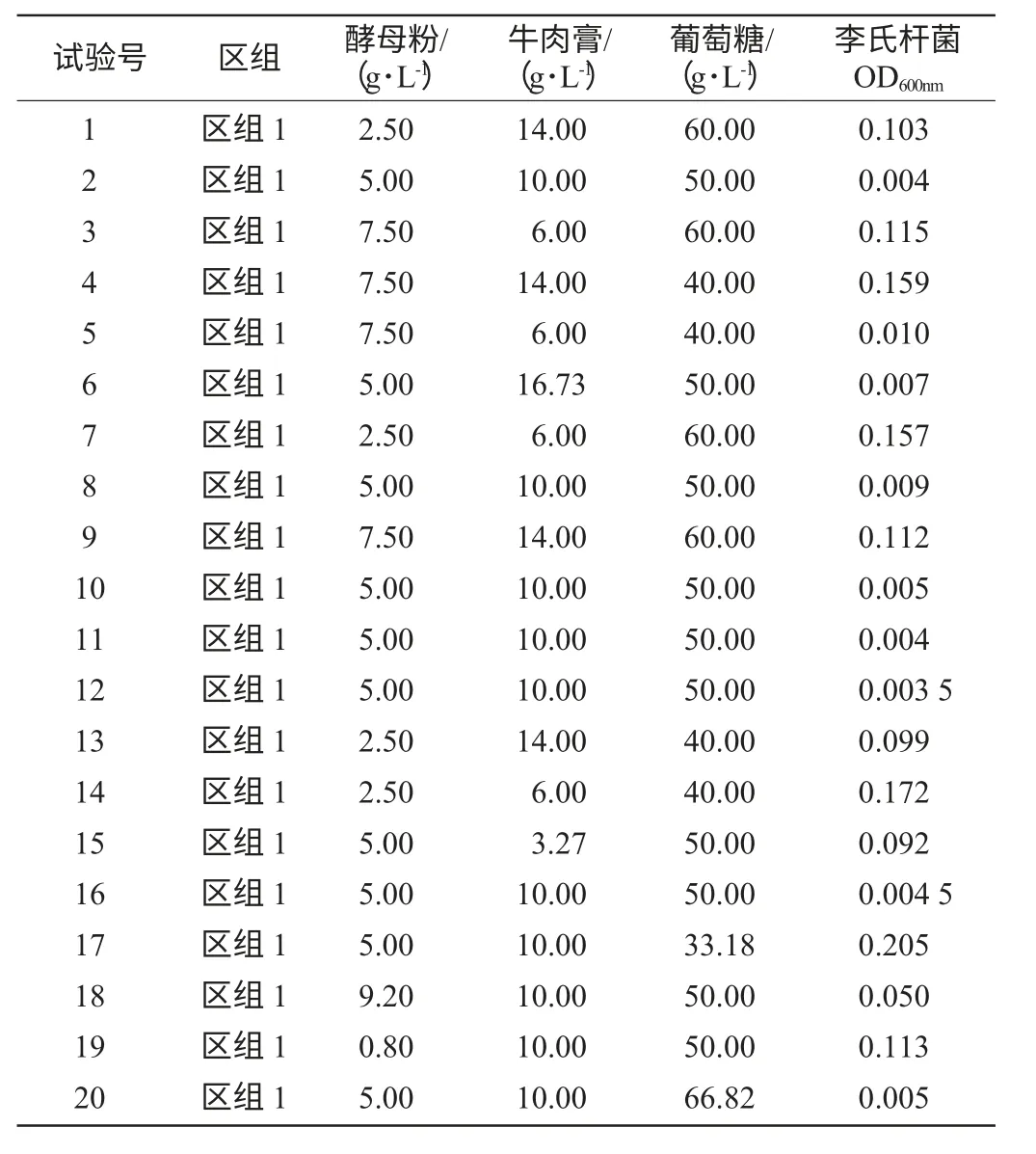
表2 中心组合响应面设计及试验结果Table 2 Response surface central composite design and corresponding response
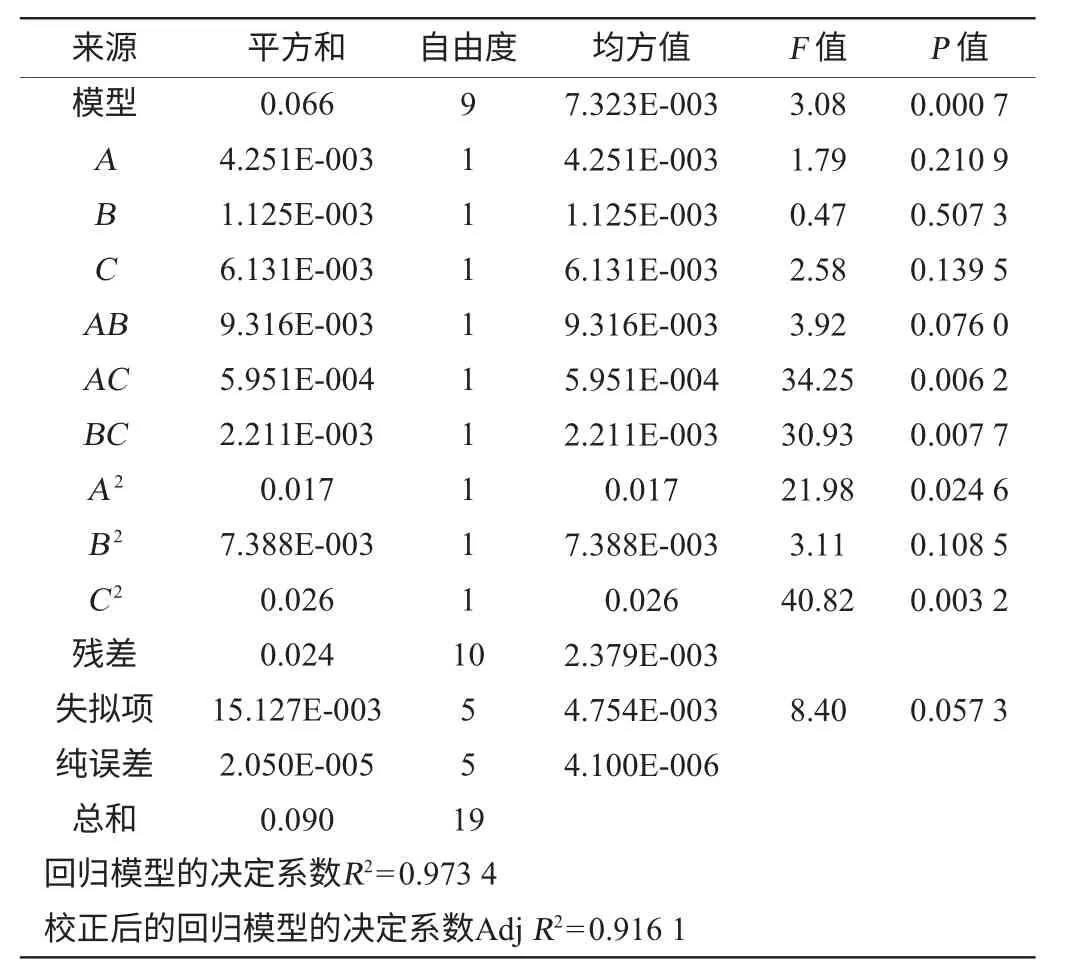
表3 回归模型方差分析Table 3 Variance analysis for regression equation
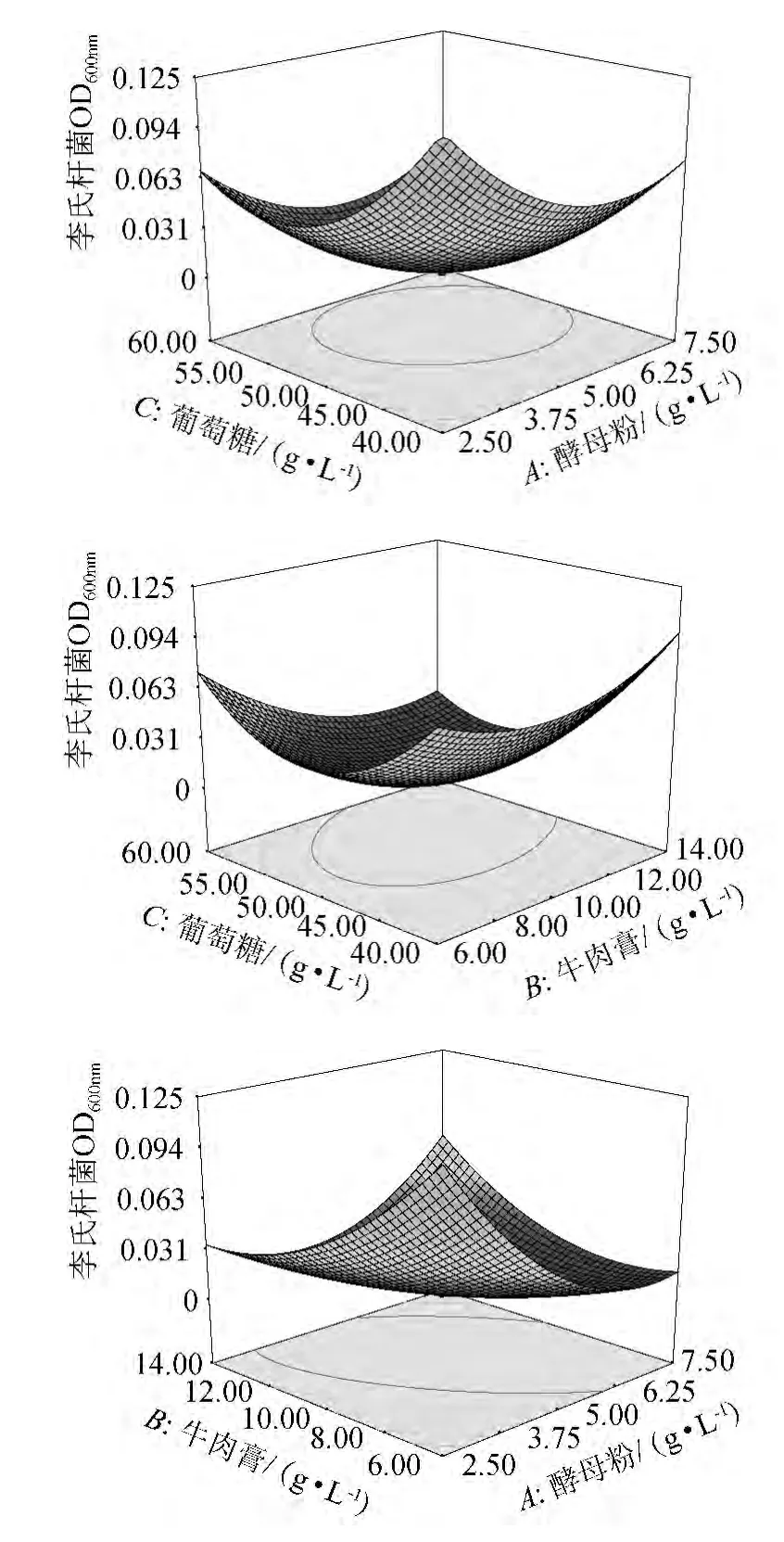
图1 各因素交互作用对植物乳杆菌CGMCC.5297所产细菌素抑菌活性影响的响应面Fig.1 Response surface and contour plot for the effect of interaction among each factors on antibacterial activity
2.4 回归模型的验证
为了进一步验证预测值,利用优化后确定的培养条件进行3 次重复摇瓶试验,发酵液上清经过滤除菌调节pH值后,进行抑菌能力的测定,4 h后,单核细胞增多性李斯特菌OD600nm值为0.001 73,与预测值拟合率达99.15%,表明预测值和实际值有良好的拟合性,优化模型可靠。同时,优化后的细菌素效价为4 499 IU/mL,比优化前(3 214.59 IU/mL)提高了1.4倍,说明本试验所确定的优化方案的设计合理有效,所获得的培养条件能够明显提高细菌素的产量。
2.5 植物乳杆菌CGMCC.5297所产细菌素应用的初步探索
对植物乳杆菌CGMCC.5297所产细菌素在应用方面进行了初步试验。在自制酸奶中接种单核细胞增多性李斯特菌后,加入优化后的细菌素发酵上清与仅加入无菌MRS培养基对照的每日李斯特菌计数差别见图2。
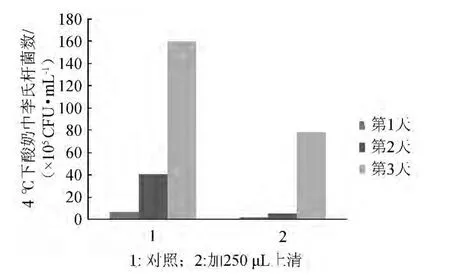
图2 植物乳杆菌CGMCC No 5297所产细菌素对酸奶保鲜效果的研究Fig.2 Bacteriocin production from L.plantarum CGMCC No 5297 used in yoghourt
由图2可知,植物乳杆菌CGMCC.5297所产的细菌素可以有效抑制单核细胞李斯特菌在酸奶中的繁殖,在1~2 d,酸奶中的单核细胞李斯特菌几乎没有生长,仅到了第3天才有所生长,但也比对照组生长少一半以上,说明植物乳杆菌CGMCC.5297所产的细菌素具有良好的食品保鲜能力,有很大的应用价值。
3 结论
用响应面法确定植物乳杆菌CGMCC.5297代谢产细菌素的最佳培养条件为酵母粉5.09 g/L,牛肉膏10.85 g/L,葡萄糖55.34 g/L。在此条件下,细菌素与单核细胞增多性李斯特菌共培养后,单核细胞增多性李斯特菌OD600nm值为0.001 73;细菌素效价为4 499 IU/mL,提高了1.4倍。
对植物乳杆菌CGMCC.5297所产细菌素在食品保鲜防腐方面的应用作了初步探索,证实植物乳杆菌CGMCC.5297所产的细菌素可以有效抑制单核细胞李斯特菌在酸奶中的繁殖,具有良好的应用前景。
[1]易华西,张兰威,杜 明,等.乳酸菌细菌素抗菌潜力挖掘研究进展[J].中国食品添加剂,2010(1):73-76.
[2]吴荣荣,张 良,王 倩.产细菌素乳酸菌的选育及其抑菌特性的研究[J].中国酿造,2009,28(6):20-22.
[3]张艾青.产广谱细菌素植物乳杆菌的初步研究及其在泡菜中的应用[D].成都:四川农业大学硕士论文,2007.
[4]高 宇,刘新梅,董明盛.响应曲面法优化鼠李糖乳杆菌Ls-8 菌株产抑真菌活性物质的条件[J].食品科技,2007,32(8):59-66.
[5]刘丽郝,彦 玲,张红星,等.1 株产细菌素植物乳杆菌的筛选及所产细菌素的理化性质分析[J].中国食品学报,2011,6(9):47-52.
[6]闵钟熳,岳喜庆,蔡玮磻,等.屎肠球菌BC-3 产类细菌素发酵培养基的优化[J].食品科学,2010,30(11):162-167.
[7]朱军莉,王 晔,励建荣.生物保鲜乳酸菌的筛选及其细菌素特性研究[J].中国酿造,2010,29(5):42-46.
[8]吕燕妮,李平兰,周 伟.戊糖乳杆菌31-1 菌株产细菌素发酵条件的优化[J].微生物学通报,2005,32(3):13-19.
[9]GRATTEPANCHE F,AUDET P,LACROIX C.Milk fermentation by functional mixed culture producing nisin Z and exopolysaccarides in a fresh cheese model[J].Int Dairy J,2007,17(2):123-132.
[10]KUMAR M,SRIVASTAVA S.Antilisterial activity of a broad-spectrum bacteriocin,enterocin LR/6 fromEnterococcus faeciumLR/6[J].Appl Biochem Biotech,2010,162(3):698-706.
[11]BOX G E P,HUNTER W G,HUNTER J S.Statistics for experimenters:an introduction to design,data,analysis,and model building[M].New York:Wiley,1978.
[12]李 亚,谈重芳,王雁萍.植物乳杆菌(Lactobacillus plantarum)8-6 产细菌素发酵条件的优化[J].中国酿造,2012,31(1):102-104.
[13]OOIJKAAS L P,WILKINSON E C,TRAMPER J,et al.Medium optimization for spore product ion ofConiothyrium minitansusing statistically-based experiment al designs[J].Biotechnol Bioeng,1999,64(1):92-100.
[14]ISMAIL A,SOULTANI S,GHOUL M.Optimizatin of the enzymatic synthesis of butyl glucoside using response surface methodology[J].Biotehnol Progr,1998,14(6):874-878.
[15]NIETO-LOZANO J C,REGUERA-USEROS J I,PELÁEZ-MARTÍNEZ M C,et al.Effect of a bacteriocin produced byPediococcus acidilacticiagainstListeria monocytogenesandClostridium perfringenson Spanish raw meat[J].Meat Sci,2006,72(1):57-61.
[16]伊守亮,肖 林,顾正华,等.管碟法测定Nisin 效价[J].无锡轻工大学学报,2004,23(4):41-45.
[17]王 辉,孟祥晨,胡子毅.植物乳杆菌KLDS1.0391 所产细菌素的纯化[J].食品科学,2013,34(3):59-63.
[18]TODOROV S D,HO P,VAZ-VELHO M,et al.Characterization of bacteriocins produced by two strains ofLactobacillus plantarumisolated from Beloura and Chouriço,traditional pork products from Portugal[J].Meat Sci,2010,84(3):334-343.
[19]吴兆亮,贾永生,谭相伟,等.分光光度法快速测定乳链菌肽效价[J].分析化学研究简报,2006(34):227-230.
[20]YI H,ZHANG L,TUO Y,et al.A novel method for rapid detection of class IIa bacteriocin-producing lactic acid bacteria[J].Food Control,2010,21:426-430.
