PTEN能负调控前列腺癌PC-3细胞Raf-1磷酸化
2014-04-24孙健玮王剑松刘子超杨峻峰马辉郑立民
孙健玮王剑松*刘子超杨峻峰马 辉郑立民
1.昆明医科大学第二附属医院泌尿外科(昆明 650101); 2.昆明学院生命科学与技术系; 3.昆明医科大学第五附属医院泌尿外科
PTEN能负调控前列腺癌PC-3细胞Raf-1磷酸化
孙健玮1王剑松1*刘子超2杨峻峰1马 辉1郑立民3
1.昆明医科大学第二附属医院泌尿外科(昆明 650101); 2.昆明学院生命科学与技术系; 3.昆明医科大学第五附属医院泌尿外科
目的探讨 PTEN基因表达变化对Raf-1磷酸化的影响。方法用Western blot方法分别检测PTEN基因过表达和干扰后前列腺癌PC-3细胞Raf-1的磷酸化水平。结果PTEN基因过表达后,PC-3细胞的磷酸化Raf-1 减少61.1%;PTEN基因干扰后,磷酸化Raf-1增加75.1%。结论PTEN可负调控前列腺癌PC-3细胞Raf-1的磷酸化。
PTEN磷酸水解酶; Raf激酶类; 前列腺肿瘤
前列腺癌常见于老年男性,其发病率近年来呈明显上升趋势。据统计,美国2012年男性新增前列腺癌患者达241 740例,占同期男性全部新增癌症患者总数的28.5%,位居癌症新发病率的首位[1]。由于前列腺癌与雄激素相关的特性,激素剥夺性治疗(androgen deprivation therapy, ADT)被认为是前列腺癌有效的治疗手段[2-4]。但大多数病例最终将发展成为激素非依赖性前列腺癌(androgen independent prostate cancer, AIPC)而对内分泌治疗产生抵抗,继而出现复发、转移和死亡。
第10号染色体缺失的磷酸酶及张力蛋白同源基因(phosphatease and tensin homolog deleted on chromosome ten, PTEN)属于抑癌基因,其表达水平降低或丢失与多种肿瘤的发生密切相关[5]。雄激素受体(androgen receptor, AR)是AIPC发生发展进程的关键环节之一,并接受多种调控因子的共同作用而产生生物效应[6]。在前列腺癌细胞中,PTEN可以通过负调控PI3K/AKT信号通路影响AR的表达[7,8]。丝裂原活化蛋白激酶(mitogen activated protein kinase, MAPK)信号通路是真核细胞信号转导网络的重要途径之一,在基因表达调控和细胞质功能活动中发挥十分关键的作用。MAPK信号通路由3类蛋白激酶(Raf-MEK-ERK)组成,通过一次磷酸化将上游信号传递到下游应答分子。最近有研究证明MAPK信号通路的激活与AIPC的病程进展也存在相关性[9]。然而,PTEN是否与该通路存在关系还不确定。本研究旨在探讨PTEN是否与MAPK信号通路中Raf1的磷酸化存在关系,为前列腺癌的临床诊治应用提供理论基础。
材料与方法
一、材料
前列腺癌PC-3细胞购自中国科学院典型培养物保藏委员会昆明细胞库;PTEN-pCMV6载体购自美国Origene公司;si-PTEN RNA购自Qiagen公司;脂质体Lipofectamine 2000、Lipofectamine RNAiMAX Reagent和Opti-MEM I Medium培养基购自美国Invitrogen公司;兔抗PTEN,山羊抗Raf-1和兔抗β-actin抗体购自Santa cruz公司,小鼠抗兔和小鼠抗山羊IgG购自美国KPL公司;胎牛血清购自Gibco公司。
二、细胞培养
细胞培养液为含10%胎牛血清、10 ng/ml EGF和青链霉素双抗的DMEM/F12培养基,PC-3细胞在37℃,5% CO2恒温箱培养基培养,2~3d更换培养液,胰酶消化传代。取对数期细胞用于实验。
三、细胞的瞬时转染
在24孔细胞培养板内加入500 ml对数期细胞悬液(1×105个/孔),过夜培养备用。8μg PTEN-pCMV6载体质粒和10μl的Lipofectamine 2000分别用250μl的Opti-MEM稀释,放置5min后混匀,在室温放置25min后加入到细胞培养板中,6h后换成完全培养液。转染48h后用Western Blot检测PTEN基因过表达程度。并检测Raf-1的磷酸化水平。用空质粒做对照。
四、细胞的干扰
在24孔细胞培养板内加入500 ml对数期细胞悬液(2×105个/孔),过夜培养备用。0.7μl的20 μM si-PTEN RNA及1μl Lipofectamine RNAiMAX分别用5μl的Opti-MEM稀释放置5min后混匀,在室温放置18min后加入到24孔板中并加200μl的opti-MEM,6h后换成含完全培养液。转染48h后用Western Blot检测PTEN基因干扰程度。并检测Raf-1的磷酸化水平。用control siRNA做对照。
五、Western blot检测
各转染组细胞用胰酶消化后,加入细胞裂解液裂解并离心提取蛋白质,Bio-rad蛋白定量试剂盒测定总蛋白浓度。等量的总蛋白经煮沸变性后进行SDS-PAGE凝胶电泳,湿法转膜,5%奶粉溶液封闭2h,一抗(兔抗PTEN、山羊抗Raf-1和兔抗β-actin抗体)孵育过夜,二抗(小鼠抗兔和小鼠抗山羊IgG)孵育4h,滴加适量ECL化学发光底物,显影。采用Quantity One软件测定条带灰度值。实验重复3次。
六、统计学处理
SPSS13.0统计软件分析,以均数±标准差表示,两组数据比较采用配对样本分析方法,P<0.05认为差异有统计学意义。
结 果
一、过表达PTEN对Raf-1磷酸化的影响
Lipofectamine 2000转染PTEN-pCMV6载体质粒进入PC-3细胞之后,用Western blot技术测定PTEN和磷酸化Raf-1的水平,以测定转染效果和PTEN过表达对Raf-1磷酸化的影响。结果表明,PTEN过表达后磷酸化Raf-1明显减少(图1)。灰度分析表明,过表达后磷酸化Raf-1减少61.1%(表1)。
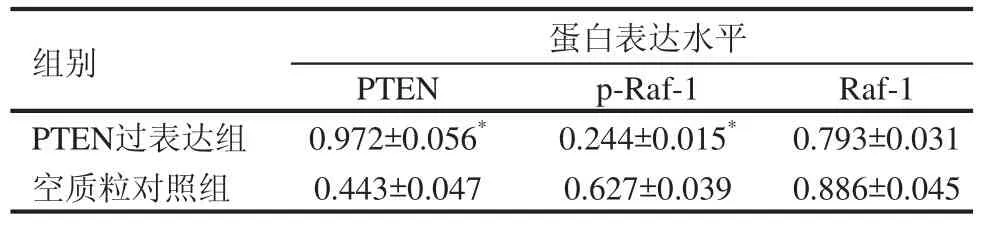
表1 过表达PTEN对Raf-1影响的Western 条带灰度值比较(n=3)
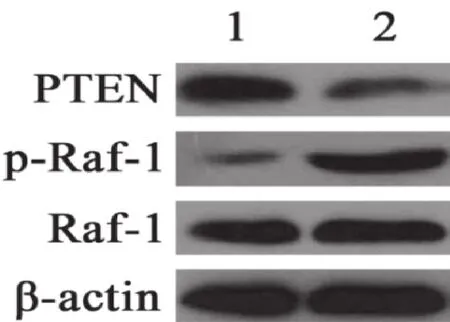
图1 过表达PTEN对Raf-1磷酸化的影响
二、干扰PTEN对Raf-1磷酸化的影响
Lipofectamine RNAiMAX转染si-PTEN干扰RNA进入PC-3细胞之后,用Western blot技术测定PTEN和磷酸化Raf-1的水平,以测定PTEN干扰效果和干扰后对Raf-1磷酸化的影响。结果表明,干扰PTEN后磷酸化Raf-1明显增加(图2)。灰度分析表明,干扰PTEN后磷酸化Raf-1增加75.1%(表2)。认与AR异常表达有关。PTEN是一个具有磷酸酶活性的抑癌基因,定位于染色体10q23,其编码蛋白具有磷酸酪氨酸酶和双重特异性磷酸酶结构域,能使某些磷脂或蛋白激酶的相应位点去磷酸化,对细胞周期、细胞凋亡以及细胞的粘附、迁移和分化产生影响[12]。PTEN表达水平降低或丢失与多种肿瘤的发生发展密切相关,PTEN基因的失活是前列腺癌最常见的异常之一[13]。PTEN基因功能的缺失可能是AIPC进展的关键原因[14-16]。PTEN功能缺失可阻止PI3K/AKT通路中PIP3脱磷酸转化为PIP2,从而使AKT持续激活,提高磷酸化AKT水平,继而调控AR的生物效应,并抑制通路下游凋亡的信号分子,促进细胞的增殖[17]。
MAPK/ERK也是前列腺癌发病机制中的重要信号传导通路之一。PI3K/AKT信号通路主要与细胞的存活相关,而MAPK/ERK则主要与细胞生长、增殖和分化有关[18,19]。MAPK/ERK信号通路的激活始于细胞膜上的丝裂原受体激活,以高度保守的三级激酶级联传递信号,MAPK以及多种应激原可以不同的启动机制激活该信号通路。MAPK/ERK信号通路中Raf分为A-raf、B-raf和C-raf-1,其中C-raf-1表达产物为Raf1蛋白激酶,其CR1保守区即为活化Ras的结合部位。Ras作为通路的启动信号,其激活后可将Raf1聚集到细胞膜并结合其他相关蛋白导致Raf1的磷酸化,磷酸化的Raf1通过其下游因子MAPK激酶(MEK1/2)和细胞外信号调节激酶(ERK1/2)完成胞浆蛋白磷酸化、细胞骨架成分磷酸化以及胞核转录因子、核蛋白磷酸化等而实现其生物效应。在前列腺癌,Ras和Raf的激活是自分泌和旁分泌生长因子刺激的结果,Ras持续激活可推进AIPC的病程进展[13],MAPK/ERK信号通路在前列腺癌的转移过程中发挥重要的作用[20]。
PTEN是否与MAPK/ERK信号通路存在联系是本研究想要探讨的问题。磷酸化Raf1是MAPK/ ERK信号通路中三级级联反应的第一级,起着分子开关的作用,是联系细胞外信号与细胞内激酶级联反应的关键之一。本实验结果提示PTEN基因表达与前列腺癌PC-3细胞Raf-1磷酸化呈负相关关系,有助于揭示前列腺癌的发生机制并可针对PTEN、Raf1以及MEK等信号通路中关键因子作为靶点进行治疗干预。PTEN蛋白对Raf1磷酸化的具体作用机制以及磷酸化Raf1对AIPC有何影响,有待进一步研究。

图2 干扰PTEN对Raf-1磷酸化的影响
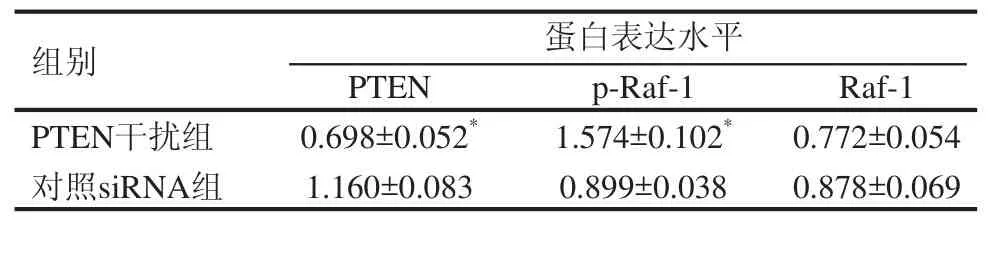
表2 干扰PTEN对Raf-1影响的Western条带灰度值比较(n=3)
讨 论
前列腺癌是近年老年男性发病率较高的癌症之一,对前列腺癌的发病机制及其治疗手段研究也是当前癌症研究领域的热点。绝大多数早期前列腺癌都与雄激素的异常表达有关,因此,早期前列腺癌治疗多用抗雄激素治疗的方法[10]。然而,大量前列腺癌后期都表现为激素非依赖性(即AIPC),导致抗雄激素治疗无效。
AIPC发病机制尚待研究,AR在其细胞增殖、分化以及发生发展中的重要作用备受关注。作为核转录因子,AR结合相关配体可激活一系列活性蛋白转录参与细胞的增殖、凋亡等。大多数AIPC表现有AR的扩增或过表达,继而导致对低水平雄激素的敏感性增加,或经由AR传递的信号通路激活,可能是AIPC产生的机制之一[11]。
酪氨酸激酶受体通路是众多与AR信号通路发生交互作用的信号通路之一,主要包括PI3K/AKT和MAPK/ERK等。其中PI3K/AKT信号通路已经被确
1 Siegel R, Naishadham D, Jemal A. Cancer Statistics, 2012. Ca-Cancer J Clin 2012; 62(1): 10-29
2 Chen CD, Welsbie DS, Tran C, et al. Molecular determinants of resistance to antiandrogen therapy. Nat Med 2004; 10(1): 33-39
3 Waltering KK, Urbanucci A, Visakorpi T. Androgen receptor (AR) aberrations in castration-resistant prostate cancer. Mol Cell Endocrinol 2012; 360 (1-2): 38-43
4 Lonergan PE, Tindall DJ. Androgen receptor signaling in prostate cancer development and progression. J Carcinog 2011; 10: 20
5 To MD, Perez-Losada J, Mao JH, et al. Crosstalk between Pten and Ras signaling pathways in tumor development. Cell Cycle 2005; 4(9): 1185-1188
6 Shafi AA, Yen AE, Weigel NL. Androgen receptors in hormone-dependent and castration-resistant prostate cancer. Pharmacol Ther 2013; 140(3): 223-238
7 Carver BS, Chapinski C, Wongvipat J, et al. Reciprocal feedback regulation of PI3K and androgen receptor signaling in PTEN-defi cient prostate cancer. Cancer Cell 2011; 19 (5): 575-586
8 Reddy GP, Barrack ER, Dou QP, et al. Regulatory processes affecting androgen receptor expression, stability, and function: potential targets to treat hormone-refractory prostate cancer. J Cell Biochem 2006; 98 (6): 1408-1423
9 Dong JT. Prevalent mutations in prostate cancer. J Cell Biochem 2006; 97(3): 433-447
10 Pan J, Chen J, Zhang B, et al. Association between RASSF1A promoter methylation and prostate cancer: A Systematic Review and Meta-Analysis. PLoS One 2013; 8(9): e75283
11 Bluemn EG, Nelson PS. The androgen/androgen receptor axis in prostate cancer. Curr Opin Oncol 2012; 24 (3): 251-257
12 Conde-Perez A, Larue L. PTEN and melanomagenesis. Future Oncol 2012; 8(9): 1109-1120
13 Taylor BS, Schultz N, Hieronymus H, et al. Integrative genomic profiling of human prostate cancer. Cancer Cell 2010; 18(1): 11-22
14 Mulholland DJ, Tran LM, Li Y, et al. Cell autonomous role of PTEN in regulating castration-resistant prostate cancer growth. Cancer Cell 2011; 19(6): 792-804
15 Carver BS, Chapinski C, Wongvipat J, et al. Reciprocal feedback regulation of PI3K and androgen receptor signaling in PTEN-deficient prostate cancer. Cancer Cell 2011; 19(5): 575-586
16 He L, Fan C, Kapoor A, et al. α-Mannosidase 2C1 attenuates PTEN function in prostate cancer cells. Nat Commun 2011; 2: 307
17 Carnero A, Blanco-Aparicio C, Renner O, et al. The PTEN/PI3K/AKT signalling pathway in cancer, therapeutic implications. Curr Cancer Drug Targets 2008; 8(3):187-198
18 Lee K, Song K. Actin dysfunction activates ERK1/2 and delays entry into mitosis in mammalian cells. Cell Cycle 2007; 6 (12): 1487-1495
19 Pimienta G, Pascual J. Canonical and alternative MAPK signaling. Cell Cycle 2007; 6 (21): 2628-2632
20 Mulholland DJ, Kobayashi N, Ruscetti M, et al. Pten loss and RAS/MAPK activation cooperate to promote EMT and metastasis initiated from prostate cancer stem/ progenitor cells. Cancer Res 2012; 72(7): 1878-1889
(2013-11-11收稿)
PTEN downregulates in the level of Raf-1 phosphorylation in prostate cancer cell PC-3
Sun Jianwei1, Wang Jiansong1*, Liu zichao2, Yang Junfeng1, Ma Hui1, Zheng Limin3
1.Department of Urology, the Second Affi liated Hospital of Kunming Medical University, Kunming 650101, China; 2. Department of Biologican Science and Technology, Kunming University; 3. Department of Urology, the Fifth Affi liated Hospital of Kunming Medical University Corresponding author: Wang Jiansong, E-mail: Jiansongwang@yahoo.com
ObjectiveTo investigate the effects of PTEN expression on level of Raf-1 phosphorylation in prostate cancer cells.MethodsThe level of Raf-1 phosphorylation was detected by western blot in prostate cancer cells with PTEN gene overexpression or PTEN gene knockdown.ResultsThe level of Raf-1 phosphorylation decreased by 61.1% in PC-3 cells with PTEN gene overexpression, and increased by 75.1% in PC-3 with PTEN gene silence.ConclusionPTEN can downregulate the level of Raf-1 phosphorylation.
PTEN Phosphohydrolase; Raf Kinases; prostatic neoplasms
10.3969/j.issn.1008-0848.2014.01.005
R 737.25
*通讯作者, E-mail: Jiansongwang@yahoo.com
