siRNA沉默HIF-lα基因对前列腺癌PC3细胞生长增殖及凋亡的影响*
2014-04-22付振宇张鸽黄玉华严春寅
付振宇张 鸽黄玉华严春寅
俞 江3孙利国1陈永昌1缪 瑜1**张 杰1
1.扬州大学第五临床学院暨常熟市第二人民医院泌尿外科(常熟 215500);
2. 苏州大学附属第一医院泌尿外科; 3.上海交通大学医学院附属苏州九龙医院泌尿外科
siRNA沉默HIF-lα基因对前列腺癌PC3细胞生长增殖及凋亡的影响*
付振宇1张 鸽1黄玉华2**严春寅2
俞 江3孙利国1陈永昌1缪 瑜1**张 杰1
1.扬州大学第五临床学院暨常熟市第二人民医院泌尿外科(常熟 215500);
2. 苏州大学附属第一医院泌尿外科; 3.上海交通大学医学院附属苏州九龙医院泌尿外科
目的探讨沉默缺氧诱导因子-lα(hypoxia inducible factor-lα,HIF-lα)基因对前列腺癌PC3细胞生长增殖及细胞凋亡的影响。方法实验分为PC3组(空白对照组)、PC3+NC siRNA组(阴性对照组)和PC3+HIF-lαsiRNA组(干扰组)。使用经过筛选证实有效的HIF-lα-siRNA序列和阴性对照NC-siRNA序列,经脂质体Lipofectamine 2000转染PC3细胞。采用CCK-8法检测转染后96h内各组细胞的生长增殖情况,流式细胞仪检测转染后48h各组细胞的凋亡率。结果PC3+HIF-lαsiRNA组肿瘤抑制率高于PC3+NC siRNA组,尤以转染后第48h表现得较为明显;在第48h,PC3+HIF-lαsiRNA组细胞存活率明显低于PC3组和PC3+NCsiRNA组(P<0.01)。转染后第48h,干扰组细胞凋亡率为(11.2±1.13)%,PC3组和PC3+NC siRNA组细胞凋亡率分别为(2.4±0.26)%和(2.5± 0.36)%,干扰组细胞凋亡率显著高于两对照组(P<0.01)。结论 沉默HIF-lα基因能抑制前列腺癌PC3细胞的生长,诱导癌细胞凋亡,发挥抗肿瘤作用。
微RNAs; 前列腺肿瘤; 细胞系, 肿瘤; 缺氧诱导因子1, α亚基; 细胞增殖; 细胞凋亡
实体肿瘤增大到约1~2mm3时,内部会出现乏氧的微环境,此时恶性肿瘤细胞将产生一系列生物学行为的变化来适应低氧状态。缺氧诱导因子-lα(hypoxia inducible factor-lα,HIF-lα)通过调节肿瘤细胞能量代谢、生长凋亡、血管生成、侵袭转移等使肿瘤细胞适应缺氧微环境,促使肿瘤进展。HIF-lα在这些过程中起着中心介导作用[1],降低HIF-lα的表达可能有抗肿瘤的作用。本研究通过小干扰RNA(siRNA)沉默前列腺癌PC3细胞HIF-lα基因,检测细胞增长、凋亡的变化,观察沉默HIF-lα基因对PC3细胞生物学行为的影响。
材料与方法
一、材料
前列腺癌PC3细胞购自中科院上海细胞生物研究所;脂质体Lipofectamine 2000购自美国Invitrogen公司;CCK-8试剂盒购自日本DOJINDO公司;凋亡试剂盒购自江苏碧云天生物技术研究所。根据HIF-1α(GenBank Accession Number:NM_001530)基因信息,使用siRNA序列设计软件,选择了针对目的基因的siRNA序列及阴性对照序列NC,并设计其互补的模板单链,额外设计了TT或dTdT悬挂末端,以增加siRNA的稳定性。人HIF-1α序列特异性的siRNA与人EST数据库做BLAST序列比对,确认与其他基因无结合位点;阴性对照序列与哺乳动物无同源性,siRNA委托上海吉玛生物科技有限公司合成。HIF-lαsiRNA、阴性对照NC-siRNA及荧光标记的FAM-NC-siRNA的设计、筛选、验证等均在苏州大学免疫研究所进行。筛选出的有效HIF-lα-siRNA靶向HIF-lα mRNA的位点为792-812,正义链为5’-GUGAUGAA AGAAUUACCGAAUTT-3’, 前列腺癌PC3细胞被HIF-lα-siRNA靶向干扰后48h在mRNA水平的抑制率为71%,在蛋白水平的抑制率为70.27%。NC- siRNA片段正义链序列为5’- UUCUCCGAACGUGUCACG UdTdT-3’。
二、方法
(一)实验分组及细胞培养
实验分PC3组(空白对照组)、PC3+NCsiRNA组(阴性对照组)及PC3+HIF-lαsiRNA组(干扰组)。PC3细胞常规培养于10%胎牛血清(FBS)的MEM培养液中,37℃、5%CO2的孵箱内培养。每2~3d 1:2传代1次,取对数生长期的细胞用于实验。转染时将PC3细胞置入无血清的MEM中培养,根据Lipofectamine 2000操作说明按分组要求转染或不转染siRNA(浓度为40nmol/L)。转染6h后将培养基换成含10%FBS的MEM继续温育。
(二)CCK-8法检测各组细胞的生长增殖
转染或不转染后将各组细胞调成终浓度为1×10个/mL的单细胞悬液接种于96孔板,每组设6个时间点,分别为:0、12 、24、48、72、96h,每小组设个复孔;细胞培养至每个时间点取出相应的96孔板,加入CCK-8液,继续培养4h后在酶联免疫检测仪上测定细胞450nm波长处的吸光度值(OD值)。
(三)Annexin V-FITC/PI法检测各组细胞的凋亡率
每组细胞设3复孔,转染或不转染后将各组细胞继续培养48h,收集细胞离心后用PBS洗涤两次,弃上清,加入Binding Buffer悬浮细胞,然后加入Annexin V-FITC混匀,再加入PI,室温避光反应15min,在1h内上FCM检测细胞凋亡率。
(四)统计学处理
采用SAS8.1软件包对实验结果进行统计分析;计量资料以±s 表示,采用单因素方差分析SNK法,P<0.05差异有统计学意义。
结 果
一、3组PC3细胞的生长增殖情况
根据检测的OD值计算出生存率,其计算公式为:某时间点生存率(存活率)=该时间点实验组平均OD值/该组0h的平均OD值,并根据生存率绘制各组PC3细胞存活曲线图(图1)。结果显示:在第12h,各组PC3细胞存活数无明显差异,细胞增殖均较慢;至第24 h,3组细胞存活数均缓慢升高,但干扰组PC3细胞存活数稍低于空白对照组和阴性对照组(F=6.47,P=0.03)。第48 h,两对照组PC3细胞增殖显著加速,而干扰组细胞增殖仍维持在较低水平;干扰组与两对照组比较,存活数差异显著(F=53.77,P<0.01),而两对照组细胞存活数无明显差异(P>0.05)。第72h和第96h,两对照组细胞增殖速度有所减慢,干扰组细胞增殖速度有所加速,但干扰组存活数仍明显低于两对照组(F72h=31.29,P72h<0.01;F96h=14.81,P96h<0.01)。总体来说,沉默HIF-lα基因后,PC3细胞的存活率明显降低,以第48h下降最明显。
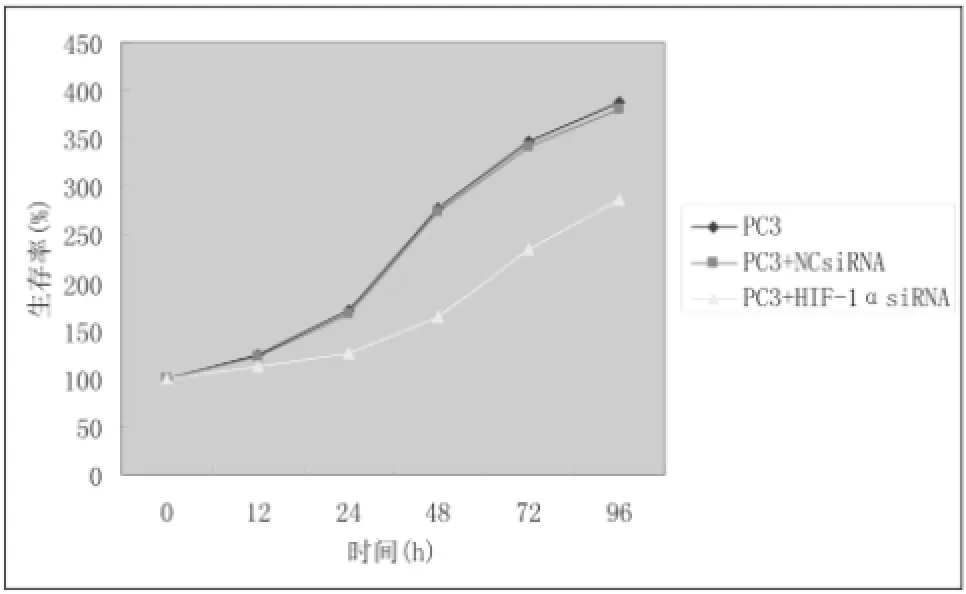
图1 3组PC3细胞的生存率曲线
二、3组PC3细胞的凋亡情况
干扰组细胞的平均凋亡率为(11.2±1.13)%,PC3组和PC3+NC siRNA组细胞平均凋亡率分别为(2.4±0.26)%和(2.5±0.36)%,干扰组较两对照组细胞凋亡率显著升高(F=150.14 ,P<0.01),而两对照组之间无明显差别(P>0.05)(见图2)。

图2 3组PC3细胞的凋亡率比较
讨 论
有报道[2],HIF-lα在包括肺癌、前列腺癌、胃肠道恶性肿瘤、肾癌、卵巢癌等多种恶性肿瘤组织中呈特异性的高表达。HIF-lα表达上调利于肿瘤细胞适应低氧微环境,并加速肿瘤恶性进程。我们前期用免疫组化方法亦证实[3-5]:HIF-lα蛋白在前列腺癌组织中高表达;HIF-lα的表达与前列腺癌的恶性程度呈正相关,与前列腺癌的形成及癌细胞的增殖密切相关;HIF-lα的表达与前列腺癌的临床分期相关,它们参与了前列腺癌的恶性进程。因此,降低HIF-lα的表达可能有抑制肿瘤的作用。RNA干扰可特异性的使特定基因的mRNA发生降解或蛋白质翻译抑制,从而诱发基因沉默现象[6],被认为是高效特异的降低基因表达的方法之一。本实验用经证实有效的人工化学合成的HIF-lα-siRNA转染PC3细胞以沉默HIF-lα基因的表达,观察其对PC3细胞生长增殖、凋亡表达的影响。
我们采用CCK-8法测定转染后96h内各组PC3细胞的存活情况,实验结果显示:干扰组细胞生长增殖明显慢于两对照组,且这种差异在转染后第48h显得尤其明显,而两对照组之间无差异。通常转染后24h内就能引起细胞内HIF-lα蛋白水平的下降,而干扰组PC3细胞在24h内这种生长抑制变化不明显,可能是转染后所引起的HIF-lα的mRNA和蛋白及生物学行为的改变存在起作用的时间延迟现象;转染后第48h这种蛋白水平的下降更明显,可能是引起抑制细胞生长及促进细胞凋亡等相关的重要蛋白表达发生改变,最终表现为细胞生长变慢。而转染72h后,由于siRNA从转染的细胞中开始逐渐脱落,引起HIF-lα介导的细胞生长抑制作用逐渐减弱,转染细胞重新生长加速。因此我们认为:siRNA沉默HIF-lα可以抑制前列腺癌PC3细胞的生长增殖,具有抗肿瘤作用,这种作用在转染后48h左右达到高峰。前列腺癌细胞的生长受多种生长因子[7,8]包括胰岛素样生长因子-(IGF-1)、转化生长因子-α(TGF-α)、成纤维细胞生长因子(FGF)等调控,而HIF-lα的高表达可刺激IGF-1、TGF-α、FGF等的分泌,促使前列腺癌细胞生长增殖。沉默HIF-lα基因有可能引起IGF-1、TGF-α、FGF等生长因子表达下调,导致肿瘤生长增殖减慢。这可能是我们在实验中观察到的沉默HIF-lα基因后前列腺癌细胞的存活与增殖受到抑制的机制之一,但具体是通过哪些因子的作用,目前还不太明确,尚需进一步的深入研究以证实。
凋亡是细胞对环境的生理性、病理性刺激信号、环境条件的变化或缓和性损伤产生的应答有序变化的死亡过程。HIF-lα对细胞凋亡中的调控作用存在着两个不同方面:一方面,HIF-lα能增加无氧代谢、糖酵解和一些凋亡前基因的表达,起抗凋亡作用,同时HIF-lα还能与人端粒末端逆转录酶(hTERT)基因相互作用,诱导活化hTERT,从而增加端粒酶的活性,延长端粒,起抗凋亡作用[9];另一方面,HIF-lα能通过阻断P53降解与稳定P53、上调Bcl-2家族促凋亡基因BNIP3等途径起到促凋亡作用[10]。因此,目前认为HIF-lα对凋亡的双向调控作用会因细胞类型和环境条件而异。在本研究中,我们观察到: 干扰组PC3细胞在转染HIF-lα-siRNA后48h,凋亡率高于其他两对照组,但是增加的幅度不大,提示沉默HIF-lα基因在一定程度上能诱导PC3细胞凋亡,发挥抗肿瘤效应。这与Zhang等[11]报道的结果类似:利用RNA干扰下调口腔鳞状细胞癌HIF-lα的表达水平,能显著抑制细胞生长,促进细胞凋亡。沉默HIF-lα的促凋亡作用机制可能是:HIF-lα可增加无氧代谢、糖酵解和一些凋亡前基因的表达,起抗凋亡作用,同时HIF-lα还能通过与hTERT基因的相互作用来诱导活化hTERT,从而增加端粒酶的活性,延长端粒,起抗凋亡作用[12],而沉默PC3细胞的HIF-lα基因后,有可能使这种抗凋亡作用减弱,从而导致肿瘤细胞凋亡。
1 Le QT, Giaccia AJ. HIF-alpha, a gender independent transcription factor.Clin Cancer Res2003; 9(7): 2391-2393
2 Hung JJ, Yang MH, Hsu HS,et al. Prognostic signif cance of hypoxia-inducible factor-1alpha, TWIST1 and Snail expression in resectable non-small cell lung cancer.Thorax2009; 64(12): 1082-1089
3 黄玉华, 严春寅, 温端改, 等. 缺氧诱导因子-1α和血管内皮细胞生长因子在前列腺癌组织中的表达. 临床泌尿外科杂志 2004; 19(1): 36-38
4 严春寅, 黄玉华, 温端改, 等. 缺氧诱导因子-1α与前列腺癌生物学行为的关系. 江苏医药 2005; 31(7): 489-49 5 Huang Y, Yu J, Yan C,et al. Effect of small interfering RNA targeting hypoxia-inducible factor-1α on radiosensitivity of PC3 cell line.Urology2012; 79(3) 744. e17-e24
6 Kim DH, Rossi JJ. Strategies for silencing human disease using RNA interference.Nat Rev Genet2007; 8(3): 173-184
7 Yewalkar N, Deore V, Padgaonkar A,et al.Development of novel inhibitors targeting HIF-lα towards anticancer drug discovery.Bioorg Med Chem Lett2010; 20(22): 6426-6429
8 张华锋, 孔垂泽. SATBl蛋白在人前列腺癌组织中的表达及临床意义. 中国男科学杂志 2012; 26(5): 11-13,18
9 Erler JT, Cawthorne CJ, Williams KJ,et al.Hypoxiamediated down-regulation of Bid and Bax in tumors occur via hypoxia-inducible factor 1-dependent and independen mechanisms and contributes to drug resistance.Mol Cell Biol2004; 24(7): 2875-2889
10 Suzuki H, Tomida A, Tsuruo T. Dephosphorylated hypoxia-inducible factor 1alpha as a mediator of p53-dependent apoptosis during hypoxia.Oncogene2001; 20(41): 5779-5788
11 Zhang Q, Zhang ZF, Rao JY,et al.Treatment with siRNA and antisense oligonucleotides targeted to HIF-lalpha induced apoptosis in human tongue squamous cell carcinomas.Int J Cancer2004; 111(6): 849-857
12 Zhang P, Chan SL, Fu W,et al. TERT suppresses apoptotis at a premitochondrial step by a mechanism requiring reverse transcriptase activity and 14-3-3 protein-binding ability.FASEB J2003; 17(6): 767-769
(2014-09-17收稿)
Effects of downregulation of HIF-lα on proliferation and apoptosis of human prostate cancer cells PC3*
Fu Zhenyu1, Zhang Ge1, Huang Yuhua2**, Yan Chunyin2,
Yu Jiang3, Sun Liguo1, Chen Yongchang1, Miao Yu1**, Zhang Jie11. Department of Urology, the No 2 People's Hospital of Changshu, Changshu 215500, China; 2. Department of Urology, the First Aff liated Hospital of Soochow University; 3. Department of Urology, Aff liated Suzhou Kowloon Hospital of Shanghai
Jiao Tong University Medical School
Huang Yuhua, E-mail: hyhjxnc@163.com; Miao Yu, E-mail: miaoyu1978@sina.cn
ObjectiveTo investigate the effects of hypoxia inducible factor-lα gene silencing with siRNA on the proliferation and apoptosis of human prostate cancer cells.MethodsPC3 cells were divided into three groups such as PC3 group, PC3+ NC siRNA group and PC3 + HIF-lα siRNA group. Cells in each group were transfected with HIF-lαsiRNA using Lipofectamine 2000. CCK-8 test was used to measure the proliferation of PC3 cells. Flow cytometer was used to measure cell apoptosis.ResultsSurvival rate of PC3+HIF-lα siRNA group was signif cantly lower than that of other two control groups at 24h, 48h, 72h and 96h after transfection (P<0.01). The interference effect reached its peak at 48h after transfection. The rates of cell apoptosis of PC3 + HIF-lα siRNA group, PC3 group, PC3+ NC siRNA group at 48h after transfection were (11.2±1.13)%,(2.4±0.26)% and (2.5±0.36)% respectively; The apoptosis rates of PC3 + HIF-lα siRNA group was higher than that of the others (P<0.01).ConclusionSilencing HIF-lα gene can effectively inhibit cell proliferation, and induce the apoptosis of PC3 cells.
microRNAs; prostatic neoplasms; cell line, tumor; hypoxia inducible factor 1, alpha subunit; cell proliferation; apoptosis
10.3969/j.issn.1008-0848.2014.12.002
R 737.25
资助: 常熟市科技发展计划(社会发展类)项目(CS201425)
**共同通讯作者: 黄玉华, E-mail: hyhjxnc@163.com; 缪瑜, E-mail: miaoyu1978@sina.cn
