甲基硒酸对前列腺癌Lncap细胞的促凋亡作用*
2014-04-22刘艳波孙媛媛徐杰焦桥费聪聪赵晓晖芦丽莉妍赵雪俭
刘艳波孙媛媛徐 杰焦 桥费聪聪赵晓晖芦丽莉**董 妍赵雪俭
1. 北华大学基础医学院(吉林 132013); 2. 吉林大学前列腺疾病防治研究中心; 3. 美国杜兰大学生命科学研究中心
甲基硒酸对前列腺癌Lncap细胞的促凋亡作用*
刘艳波1,2孙媛媛1徐 杰1焦 桥1费聪聪1赵晓晖1芦丽莉1**董 妍2,3**赵雪俭2
1. 北华大学基础医学院(吉林 132013); 2. 吉林大学前列腺疾病防治研究中心; 3. 美国杜兰大学生命科学研究中心
目的探讨甲基硒酸(methylseleninic acid,MSA)对前列腺癌Lncap细胞促凋亡效应,并初步探讨发生机制。方法 将体外培养的Lncap细胞分为4组,即空白对照组(mock),MSA低剂量组(1.25μM)、中剂量组(2.50μM)和高剂量组(5.00μM),MSA分别作用24h、48h和72h,倒置显微镜下观察细胞形态,SRB法检测细胞增殖情况;流式细胞术检测细胞周期及凋亡;免疫荧光及免疫细胞化学法检测细胞内stat3的表达。结果光镜及SRB实验结果显示:随MSA剂量增加及作用时间延长,Lncap细胞生长受到明显抑制;流式细胞术结果表明:MSA呈剂量及时间依赖关系促进细胞凋亡,并使细胞周期分布发生改变,多数细胞被阻滞于G0~G1期;免疫荧光及免疫组织化学结果发现:与对照组相比,MSA可明显抑制细胞内stat3表达。结论MSA抑制细胞增殖并促进细胞凋亡,其发生机制可能与降低stat3表达,进而抑制下游增殖基因表达有关。
前列腺癌; 甲基硒酸; 细胞凋亡; stat3转录因子
硒是人体必需的微量元素,具有广泛的生物学功能,如含硒蛋白质谷胱甘肽过氧化物酶和硫氧蛋白还原酶,是细胞内氧化还原平衡的重要调节剂,对维持细胞功能意义重大[1]。此外,硒具有降低前列腺癌发病的作用,如成年男性每天补充200μg的硒可使前列腺癌的发病危险性降低50%[2]。但硒抗癌活性取决于化学构成,一般来讲,无机硒化合物如硒酸盐或亚硒酸盐可损害DNA,造成遗传毒性,临床应用受到较大限制;有机硒化合物根据药代动力学不同其抗癌活性也差异较大[3,4];较稳定的硒前体化合物如甲基硒酸(methylselenic acid,MSA)在体内可迅速被代谢成具有抗癌活性的甲基硒(methylselenol),能抑制激素非依赖性前列腺癌PC-3细胞的生长。本研究在此基础上探讨MSA对激素依赖性前列腺癌细胞Lncap的作用及相关机制,为体内实验奠定基础。
材料与方法
一、实验材料
(一)实验试剂
Lncap细胞株由吉林大学前列腺疾病防治研究中心馈赠,MSA为美国Sigma公司产品,由美国杜兰大学张海涛博士惠赠;胰酶、RPMI-1640培养基、胎牛血清为美国Hyclone公司产品;小鼠抗人stat3抗体购自Santa Cruz公司,山羊抗小鼠IgG二抗(红荧光CY3标记)购自sigma公司,HRP标记的山羊抗小鼠二抗购自上海北诺生物科技有限公司,DAB购自北京中杉试剂公司、其它常规化学试剂均为进口或国产分析纯产品。
(二)实验仪器
倒置相差显微镜(Olympus,日本);荧光显微镜(Olympus,日本);超净工作台(YZ-875苏州净化设备厂);自动CO2恒温培养箱(SANYO,日本);自动高压蒸气消毒器(SONY,日本);低温冰箱(-80℃ SANYO,日本); 恒温水浴箱(江苏常州国华仪器厂);紫外分光光度计及分析工作站(岛津Shimadazi,日本);加样器(JECONS,芬兰)等。
二、实验方法
(一)细胞培养
前列腺癌细胞株Lncap 1×106分别接种在100ml培养瓶中,用RPMI-1640培养基(含10%胎牛血清),37℃,5% CO2培养。当贴壁细胞达到70%~80%融合,分组给药。
(二)细胞生长抑制实验-SRB(sulforhodamine B,SRB)法
将细胞浓度调整为2×105/ml后接种于96孔平底培养板,每孔100μl(2×104/孔)。分为mock组,MSA给药组(MSA1.25、2.50和5.00μM),每组设4复孔,待细胞达到70%左右融合时,分组给药,并设24h,48h,72h三个时间点。培养至48h时在相差显微镜下观察拍照后;每孔轻柔加入50μl经4℃预冷的500ml/L三氯醋酸,置4℃1 h,自来水洗5次,空气干燥后,加4 g/L SRB染色15~30 min,用醋酸洗涤5遍,干燥后,加入10mmol/L Tris液100μl溶解,微振器上振荡10min,在酶联检测仪上测波长570nm光的吸光度(A)值。按公式抑制率%=(对照组A均值-实验组A均值)/对照组A均值×100%计算各组抑制率,抑制率>30%即对该药敏感性高。实验重复3次。
(三)流式细胞术检测凋亡
将生长状态良好的Lncap细胞分为4组,加药48h后,收集细胞后离心, 70% 冷乙醇中4℃固定12h。PBS洗2次,调整细胞浓度为1×106/ml,用RNase消化后,加入1.5ml PI(5mg/100ml)对DNA进行染色,混匀后在流式细胞仪上进行单参数分析。
(四)免疫荧光染色
将大小合适的盖玻片置于12孔板内,各组细胞于加药48h后PBS洗一次;用新鲜配制的4%多聚甲醛固定细胞20min,PBS洗5次,0.2% TritonX-100打孔,1%BSA室温封闭10min;滴加磷酸化Stat3多克隆抗体(1:300,由1%PBS BSA配制)室温孵育2h;2.7%NaCl洗2×5min; PBS清洗2×5min;滴加CY3标记的荧光二抗(1:20由1%PBS BSA配制)避光室温孵育细胞1h,荧光显微镜下观察stat3在各组细胞中的分布,拍照。
(五)免疫细胞化学染色
将大小适合的盖玻片放入6孔培养板中,接种细胞为5×105/孔,37℃,5%CO2中培养,次日加药,继续培养48h,PBS清洗,4%多聚甲醛固定,0.2% TritonX-100打孔,免疫细胞化学染色观察细胞内stat3表达情况。
结 果
一、相差显微镜下观察细胞形态
对照组细胞贴壁生长,状况良好,多为长梭形,可见聚集现象,核仁清晰,可见核分裂相,细胞折光性好,增殖旺盛,漂浮细胞少见;MSA组随剂量增加及给药时间的延长细胞生长缓慢,形态不规则,细胞皱缩,颗粒增多,可见细胞碎片和漂浮细胞;部分细胞失去原有形态,细胞核固缩,细胞数目明显减少,见图1

图1 MSA作用于Lncap细胞48h后细胞形态(×200)A: mock B :1.25μM MSA C: 2.50 μM MSA D: 5.00μM MSA
二、MSA对Lncap细胞增殖抑制作用(SRB法)
利用SRB法检测不同浓度的MSA对Lncap细胞增殖抑制作用。分别于给药后24h、48h及72h后进行检测,以mock组增殖抑制率为0%,则1.25μM MSA组细胞增殖抑制率分别为1.24%,5.36%和9.21%;2.50μM MSA组细胞增殖抑制率分别为9.23%,21.62%和39.42%;5.00μM MSA组细胞增殖率分别为18.36%,30.67%和65.32%。抑制率表现明显的时间和剂量依赖关系(表1
表1 MSA对前列腺癌Lncap细胞增殖的影响(±s,n=4)
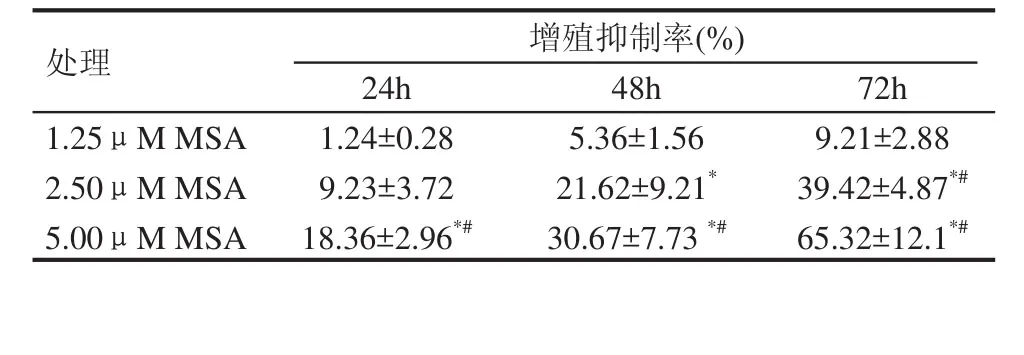
表1 MSA对前列腺癌Lncap细胞增殖的影响(±s,n=4)
*: 与对应的mock组比较,P<0.05;#: 与对应的1.25μM MSA值比较,P<0.05
?
三、MSA对Lncap细胞凋亡的影响
收集MSA作用后48h的细胞进行细胞周期及凋亡检测。结果表明:与mock组相比,Lncap细胞经1.25μM、2.50μM、5.00μM MSA处理后,均出现了明显的细胞凋亡现象,其凋亡率分别为14.7%, 33.1%,52.8%,表现为剂量依赖关系,其凋亡率和细胞周期分析见表2

表2 MSA对前列腺癌Lncap细胞细胞周期及凋亡的影响
四、MSA对stat3表达的影响
实验结果表明:mock组细胞stat3主要表达在胞浆,细胞核内也可见红色荧光;MSA给药组Lnca细胞胞浆中红色荧光表达明显减少,即5.00μM MSA可降低stat3表达(图2)。为了进一步证实MSA降低细胞内stat3的表达,又通过细胞免疫化学染色法进行检测,DAB染色发现:mock组stat3蛋白表达明显高于5.00μM MSA组;stat3蛋白表达的阳性颗粒主要位于Lncap细胞胞浆,也有少部分位于胞核内(图3)。stat3免疫荧光检测结果与免疫细胞化学染色结果相吻合。

图2 MSA对前列腺癌细胞内stat3表达的影响(×200)

图3 免疫细胞化学法检测MSA对细胞内stat3表达的影响(×200)
讨 论
前列腺癌发病率在美国中老年男性恶性肿瘤中居首位,死亡率位于第二位。因此前列腺癌的防治一直是泌尿生殖系统热点问题。有大量的研究表明,含硒化合物具有预防及治疗前列腺癌作用,但治疗效果取决于硒的化学组成。MSA作为有机硒的前体,可代谢为低毒甚至无毒的含硒物质,可干扰雄激素受体(androgen receptor,AR)启动子的活性,并呈现出时间及剂量关系[5-7]。本实验结果表明:MSA低、中、高剂量组均可抑制细胞增殖,随时间延长及剂量增加对细胞增殖抑制作用增强。Dong等[6]研究发现, MSA能以剂量及时间依赖性的方式抑制PC-3细胞的生长并介导细胞的凋亡,利用基因芯片鉴定出了MSA作用后变化较为明显的14个基因,发现MSA介导的细胞周期阻滞可能是通过上调p19INK4d和p2lwAF1基因,以及下调CDK1,CDK2和cyclinA来实现的。Zhao等[8]将MSA加入Lncap细胞培养液中,利用基因芯片发现MSA作用于细胞后,多种细胞周期调控基因的mRNA表达水平发生了剧烈变化,同时细胞增殖受抑,细胞大量积聚在G0/G1期,并且发现MSA还可以调节雄激素调控基因的表达,抑制雄激素受体的表达并降低PSA的分泌量。
为了证实MSA促进细胞凋亡及抑制细胞增殖效应是否与stat3的表达改变有关,本研究通过荧光免疫及细胞免疫染色法观察了细胞内stat3的表达情况。stat3是stat家族重要的信号蛋白之一,在相应配体刺激下,stat3第Y705位酪氨酸残基发生磷酸化,以二聚体形式转位进入细胞核,并与相应DNA反应元件结合,刺激下游相关基因的转录,进而促进细胞增殖及新生血管生成等。在许多肿瘤(包括前列腺癌)发生发展过程中,stat3持续激活,表现为细胞凋亡减少、增殖迅速、肿瘤内血管密度增加、产生耐药效应,肿瘤存活时间延长[9-11]。有研究证实:硒化合物可抑制肿瘤细胞stat3的转录,进而抑制下游基因VEGF表达,表现出促凋亡及抗增殖活性[12]。本研究利用免疫荧光染色及免疫细胞化学染色检测了stat3在Lncap细胞的表达情况,结果表明:mock组stat3表达明显增加,stat3主要位于细胞浆,少量位于细胞核,5.00μM MSA作用细胞48h后,荧光及组化染色较对照组比较明显降低,说明MSA可降低前列腺癌细胞内stat3的表达,进而抑制细胞的增殖并促进细胞凋亡,其信号转导的具体通路还有待于进一步探讨。
由此可见,MSA体外对激素依赖性前列腺癌细胞生长具有明显抑制效应,与抑制stat3的表达关系密切,为体内研究奠定了坚实的基础。
1 Arner ES, Holmgren A. The thioredoxin system in cancer. Semin. Cancer Biol 2006; 16(6): 420-426
2 Ashughyan VR, Marihart S, Djavan B. Chemopreventive Trials in Urologic Cancer. Rev Urol 2006; 8(1): 8-13
3 Christensen MJ, Quiner TE, Nakken HL, et al. Combination effects of dietary soy and methylselenocysteine in a mouse model of prostate cancer. Prostate 2013; 73(9): 986-995
4 Zhang J, Wang L, Li G, et al. Mouse prostate proteomes are differentially altered by supranutritional intake of four selenium compounds. Nutr Cancer 2011; 63(5): 778-789
5 Dong Y, Zhang H, Hawthorn L, et al. Delineation of the molecular basis for selenium-induced growth arrestin human prostate cancer cells by oligonucleotide array. Cancer Res 2003; 63(1): 52-59
6 Dong Y, Lee SO, Zhang H, et al. Prostate specifi c antigen expression is down-regulated by selenium through disruption of androgen receptor signaling. Cancer Res 2004; 64(1): 19-22
7 Cho SD, Jiang C, Malewicz B, et al. Methyl selenium metabolites decrease prostate specific expression by inducing protein degradation and suppressing androgen-stimulated transcription. Mol Cancer Ther 2004; 3(5): 605-611
8 Zhao H , Whitfield ML, Xu T, et al. Diverse effects of methylseleninic acid on the transcriptional program of human prostate cancer cells. Mol Biol Cell 2004; 15(2): 506- 519
9 Bromberg J, Darnell JE, Jr. The role of STATs in transcriptional control and their impact on cellular function. Oncogene 2000; 19(21): 2468-2473
10 Stark GR, Darnell JE, Jr. The JAK-STAT pathway at twenty. Immunity 2012; 36(4): 503-514
11 Bromberg JF, Wrzeszczynska MH, Devgan G, et al. Stat3 as an oncogene. Cell 1999; 98(3): 295-303
12 Zuazo A, Plano D, Ansó E, et al. Cytotoxic and proapototic activities of imidoselenocarbamate derivatives are dependent on the release of methylselenol. Chem Res Toxicol 2012; 25(11): 2479-2489
(2013-07-17收稿)
Methylseleninic acid promotes prostatic cancer LNCap cells apoptosis*
Liu Yanbo1,2, Sun Yuanyuan1, Xu Jie1, Jiao Qiao1, Fei Congcong1, Zhao Xiaohui1, Lu Lili1**, Dong Yan2,3**, Zhao Xuejian2
1. Beihua University Medical College, Jilin 132013, China; 2. Prostate Disease Prevention and Cure Research Center, Jilin University; 3. Tulane University Life Science Research Center, Louisiana USA Corresponding author:Lu Lili, E-mial: lulili313@163.com; Dong Yan, E-mail: drdong71@gmail.com
ObjectiveTo investigate the proapoptotic effects of methylseleninic acid (MSA) on prostatic cancer Lncap cells and explore its mechanism.MethodsThe treated Lncap cells were divided into four groups such as the control group (mock), MSA low-dose group (1.25μM), middle dose group (2.50μM) and high dose group (5.00μM) respectively. Cell morphology was observed with microscope at the time of 24h, 48h and 72h after treatment. Cell proliferation was detected by SRB assay. Cell cycle and apoptosis was measured by flow cytometry. Stat3 expression was detected by immunofl uorescence and immunocytochemical analysis.ResultsLight microscopy observation and SRB results indicated that the growth of Lncap cells were inhibited obviously with MSA dose and time dependent effect. Flow cytometry analysis showed that MSA promoted LNCap cells apoptosis with dose and time dependent effect and changed the cell cycle distribution. The majority of cells were arrested in G0-G1 phase. Immunofl uorescence and immunohistochemistry results showed MSA could inhibit the expression of intracellular stat3 compared with that of the control group.Conclusion MSA might inhibit cell proliferation and induce apoptosis, and its mechanism was associated with decreased stat3 expression.
prostatic neoplasms; methylseleninic acid; apoptosis; stat3 transcription factor
10.3969/j.issn.1008-0848.2014.01.003
R 737.25
资助: 国家级大学生创新项目(项目编号: 20121020103);吉林省教育厅“十二五”科学技术研究项目合同书(基教科合字2013191)
**共同通讯作者: 芦丽莉, E-mial: lulili313@163.com; 董妍,E-mail: drdong71@gmail.com
