乳鼠胰腺间质细胞培养上清对骨髓间充质干细胞分裂增殖的抑制作用
2014-04-21刘亚千郝好杰刘杰杰
张 琪,刘亚千,郝好杰,刘杰杰,陈 华
解放军总医院 基础医学研究所,北京 100853
乳鼠胰腺间质细胞培养上清对骨髓间充质干细胞分裂增殖的抑制作用
张 琪,刘亚千,郝好杰,刘杰杰,陈 华
解放军总医院 基础医学研究所,北京 100853
目的 探讨乳鼠胰腺间质上清液是否对骨髓间充质干细胞分裂增殖产生影响。方法取出生4 d乳鼠胰腺组织进行组织培养(对第一代细胞进行干/祖性质鉴定,进行早期干/祖特性的标记OCT4、SOX2免疫荧光染色,之后进行胰腺内分泌相关的mRNA水平检测Ngn3、PDX1、InsulinⅠ、InsulinⅡ,取上清用于诱导)。取6周龄大鼠骨髓进行间充质干细胞(bone mesenchymal stem cells,BMSCs)培养,并取第二代细胞进行诱导实验。将上清置于BMSCs中进行诱导培养,观察BMSCs的形态和生长分化情况。结果乳鼠胰腺中存在SOX2阳性干/祖细胞,并且具有向胰腺方向分化的Ngn3的mRNA表达,其上清影响BMSCs生长分化,但是BMSCs中未出现胰岛素因子的表达。结论乳鼠胰腺间质细胞可以分泌抑制BMSCs生长分化的成分。
乳鼠;胰腺;骨髓间充质干细胞
糖尿病是以慢性高血糖为特征的代谢性疾病[1]。胰腺是与糖尿病密切相关的器官,由实质细胞和间质细胞组成,前者包括内分泌腺和外分泌腺[2]。当胰腺Beta细胞损伤时,胰腺内、外分泌腺中的干/祖细胞会分化为产生胰岛素的细胞进行代偿[3-4]。
骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)是具有向多个胚层分化潜能的细胞,通过对糖尿病动物的静脉、腹腔、肾包膜下输注可以实现糖尿病的改善和治疗[5-7]。而输注的BMSCs在体内环境下发挥作用的机制尚不明确。在本实验中我们通过乳鼠胰腺间质细胞培养判定胰腺间质是否存在定向内分泌干/祖细胞特性的细胞;通过其培养上清营养BMSCs,探讨对BMSCs分裂增殖的影响,为BMSCs治疗糖尿病的作用机制研究提供基础。
材料和方法
1 实验动物 SPF级6周龄SD大鼠6只,购自北京维通利华公司,于解放军总医院动物中心饲养,适应性饲养5 d后用于BMSCs培养。SPF级孕17 d SD大鼠购买、饲养同前,于生产后4 d取乳鼠胰腺用于胰腺培养。
2 LDMEM培养基配置 1 g LDMEM粉末(Gibco)溶解于1 L去离子水中,配成溶液,过滤除菌,储存于高压灭菌处理的玻璃容器中;取该溶液89 ml,加入10 ml胎牛血清(Gibco),加入1 ml链青霉素(链霉素:100 μg/ml;青霉素:100 U/ml),配成10%血清的LDMEM培养基。
3 胰腺组织培养 出生4 d SD乳鼠置于超净台中,3%硫喷妥钠麻醉乳鼠,75%乙醇全身消毒3次,之后将乳鼠置于头高脚低位,左下腹横切口,取出胰腺置于LDMEM培养基中。将取出的胰腺组织用眼科剪剪至1 mm×1 mm大小,之后将组织分别移入15 ml离心管中,1 000 r/min离心5 min,弃上清液,将组织悬浮于LDMEM培养基中,进行接种,接种密度为20 ~ 30个组织块/皿(直径为3.5 cm皿),补足培养基至3 ml,之后置于37℃、5% CO2孵箱中培养,48 h后进行第一次传代,又48 h后进行第二次传代,期间每24 h进行一次观察。
4 免疫荧光染色 去除第一代培养皿中培养基,迅速沿培养皿壁加入3 ml 4%的多聚甲醛固定30 min。之后PBS洗3次,每次5 min。3% H2O2封闭内源性过氧化物酶10 min,PBS洗3次每次5 min。0.5% Triton打孔20 min,PBS洗3次,每次5 min。牛血清室温封闭30 min,去除封闭液加入胰岛素一抗:兔抗大鼠(Sigma,1∶200)。OCT4一抗:小鼠抗大鼠(Abcam,1∶200)。SOX2一抗:山羊抗大鼠(Abcam,1∶200)。一抗4℃过夜后置于室温30 min,PBS洗3次,每次10 min。加入二抗488-山羊抗兔(中山金桥,1∶200),488-兔抗小鼠(中山金桥,1∶200),594-兔抗山羊(中山金桥,1∶200),避光,室温放置1 h。hoechst33342(Sigma,2 μg/ml)避光染色5 min,PBS洗3次,每次10 min,50%甘油封片。荧光显微镜进行观察。
5 引物序列 GAPDH:forward primer-CACCCTGT TGCTGTAGCCATATTC,reverse primer-GACATCA AGAAGGTGGTGAAGCAG;InsulinⅠ:forward primer-CCGTCGTGAAGTGGAG,reverse primer-CAGTTGGTAGAGGGAGCAG;InsulinⅡ:forward primer-ATGGCCCTGTGGATC CGCTT,reverse primer-CTAGTTGCAGTAGTTCTCCA;PDX-1:forward primer,GGTGCCAG-AGTTCAGTGCTAA,reverse primer-CCAGTCTCGGTTCCATTCG;Ngn3:forward primer-CT-TCACAAGAAGTCTGAGAACACCAG,reverse primer-CTGCGCATAGCGGACCACAGCTT.
6 RNA提取、PCR和琼脂糖凝胶电泳 RNA提取:去除第一代培养皿中培养基,加入800 μl Trizol (Invitrogen),充分裂解5 min后,收集到1.5 ml离心管,加入200 μl氯仿,10 000离心率/min离心10 min,取上清于另一离心管加入等量异丙醇,转速同前,离心7 min,吸去上清,加入1 ml 75%乙醇同转速离心5 min,弃上清再次1 ml 75%乙醇离心5 min,待离心管液体干燥后加入EDTA水20 μl溶解之后备用。cDNA的合成和PCR采用天真公司逆转录试剂盒,方法参照使用说明,PCR产物于1%琼脂糖凝胶电泳。
7 骨髓间充质干细胞培养 将6周龄SD大鼠颈椎脱臼处死,取股骨和胫骨置于75%乙醇中消毒3 min。将消毒后的组织于超净台下去肌肉使其仅剩余骨组织,剪刀减去干骺端,用含LDMEM培养基的注射器将骨髓组织冲入培养皿中,反复轻柔冲洗。将含骨髓冲洗液1 000 r/min离心5 min,弃上清,用LDMEM培养基悬浮,接种于培养皿中。于克隆出现后进行传代,每3 d换液1次,待第一代长至培养皿面积80%时,传至第二代。取第二代培养24 h的BMSCs用于实验。
8 乳鼠胰腺间质细胞第一代上清诱导BMSCs 实验组取第一代培养1 d胰腺间质细胞上清10 ml,置于上述BMSCs中,每天观察BMSCs生长变化,对照组为LDMEM培养基组,待对照组细胞面积为培养皿80%时,取BMSCs细胞进行OCT4、SOX2、Insulin免疫荧光染色。
9 CCK-8检测BMSC生长曲线 培养BMSC至第一代,待细胞融合至80%后,消化传代。以每孔1×104细胞数接种于96孔板,培养24 h后去除培养基,分别加入200 μl LDMEM培养基(对照组)和第一代乳鼠胰腺间质细胞培养1 d的上清液(实验组),置于37℃、5% CO2培养箱中培养,在0 h、24 h、48 h、72 h分别取8孔,加入10 ml CCK8溶液,37℃孵育1 h,用酶标仪测定在450 nm处的吸光度,绘制细胞生长曲线。
10 统计学分析 统计分析采用SPSS17.0软件,两组间比较采用t-test检验,数据用表示,P<0.05为差异有统计学意义。
结 果
1 乳鼠胰腺组织细胞培养可见干/祖特性细胞培养24 h进行倒置显微镜观察发现:LDMEM培养基中胰腺组织周边可见少量细胞爬出,最多可达5层,48 h最大细胞层数超过20层,故进行传代。期间细胞形态主要为梭形,此外还有少量为扁圆形(图1)。细胞传至第一代后,24 h内生长迅速,48 h细胞融合达80%,细胞形态仍为梭形但有变长趋势,扁圆形细胞比例变少。第一代细胞进行Beta细胞特异性免疫荧光染色和干细胞相关转录因子免疫荧光染色,结果发现胰岛素、OCT4染色阴性,SOX2免疫荧光染色阳性。由此可见胰腺组织培养的细胞中具有干细胞特性的细胞(图2)。

图 1 原代和第一代乳鼠胰腺间质细胞形态(A、B: 50×,C、D: 100×,E、F: 200×)Fig. 1 Cell morphology of neonatal rats of P0 and P1 (A, B: 50×, C, D: 100×, E, F: 200×)
2 乳鼠胰腺间质干/祖细胞具有向胰腺内分泌细胞分化的潜能 取第一代乳鼠胰腺间质细胞提取RNA,对GAPDH、Insulin、PDX1、Ngn3的上下游引物进行反转录,PCR,琼脂糖凝胶电泳。结果发现InsulinⅠ为阴性, Ngn3、 InsulinⅡ、 PDX1为阳性。其中NGn3是胰腺内分泌干/祖细胞的标记,由此可见此细胞具有胰腺内分泌干/祖细胞的特性(图3)。
3 乳鼠胰腺间质上清能抑制BMSCs分裂增殖比较第二代BMSCs细胞和乳鼠胰腺间质细胞上清培养前后BMSCs生长情况发现:BMSCs上清组较LDMEM培养基组细胞增长速度明显降低,并且失去了BMSCs呈漩涡状生长的形态(图4,图5)。培养72 h内CCK8增殖实验显示,上清组BMSCs增殖明显减少(图6)。取共培养3 d的BMSCs进行Insulin、SOX2、OCT4免疫荧光染色,未发现阳性表达细胞。
讨 论
通过我们的实验证实了乳鼠胰腺间质中存在着向胰腺内分泌方向分化的干/祖细胞;乳鼠胰腺间质培养上清培养BMSCs会抑制其分裂增殖[8-10]。

图 2 胰腺间质细胞第一代免疫荧光染色—SOX2(红)和Hoechst33342(蓝); B: A图放大Fig. 2 Immunofuorescence staining of pancreatic cells with SOX2 (red) and Hoechst33342 (blue) of passage 1; B: Magnifcation of A
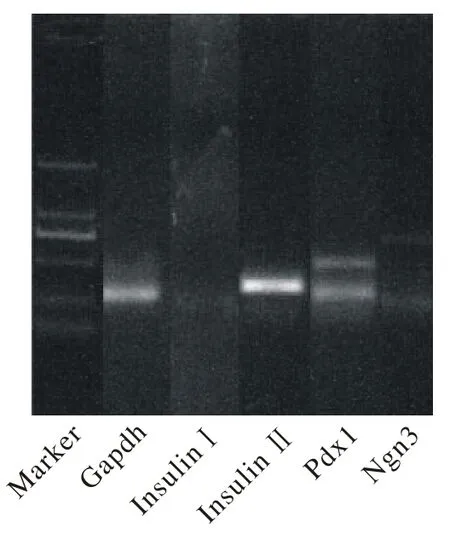
图 3 第一代乳鼠胰腺间质细胞可见Ngn3的表达Fig. 3 Ngn3 is positive in the mesenchymal cells of neonatal rats of passage 1
BMSCs移植对动物糖尿病具有改善和治疗效果,关于其治疗机制主要有3种推测:一是通过全身治疗,MSC最终归巢到病损局部,之后转分化成待修复细胞;二是通过MSC分泌细胞因子的作用,这些细胞因子作用于病损部位,实现功能的修复;三是通过Beta细胞调节免疫作用[11-14]。本实验中观察到乳鼠胰腺组织培养上清对BMSCs生长有抑制作用,表明乳鼠胰腺间质细胞可以分泌一些能够进入到BMSCs内的物质,影响其分裂增殖信号传导。因此我们推测应用BMSCs移植治疗糖尿病时,由于体内胰腺局部微环境的影响,定植到胰腺内BMSCs的增殖受到抑制。我们对乳鼠胰腺组织培养上清孵育3 d的BMSCs检测,未发现胰腺相关转录因子的表达,这与Lee等[12]和Ezquer等[13]的观点一致,即BMSCs发挥治疗作用的机制不是通过其转分化实现的。

图 4 诱导前实验组和上清组BMSCs第二代形态(A、 B:100×, C、D:200×)Fig. 4 Cell morphology of BMSCs of control and supernate group before induction (A, B: 100×,C, D: 200×)
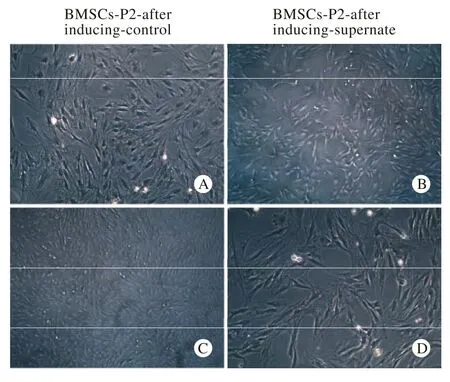
图 5 诱导3 d后实验组和上清组BMSCs第二代形态(A、 B: 100×,C、D:200×)Fig. 5 Cell morphology of BMSCs of control and supernate group after induction for 3 days (A, B:100×,C, D:200×)

图 6 BMSCs生长曲线(n=8)Fig. 6 Growth curve of BMSCs (aP<0.01, vs control)
实验中第一代乳鼠胰腺间质细胞是具有干/祖特性的快速增殖细胞,但是其上清却抑制了BMSCs增殖,这说明定向干细胞和未定向干细胞所存在的微环境存在差异,为我们进一步研究细胞之间信号作用提供了指导,为研究BMSCs的作用机制提供了方向[15-16]。同时,第一代乳鼠间质细胞中干/祖特性的细胞在体外通过培养而生长存活,为进一步对于胰腺自身干/祖细胞的研究提供了基础。
1 Yang WY, Lu JM, Weng JP, et al. Prevalence of diabetes among men and women in China[J]. N Engl J Med, 2010, 362(12): 1090-1101.
2 Heller RS. The comparative anatomy of islets[J]. Adv Exp Med Biol, 2010, 654: 21-37.
3 Liu H, Guz Y, Kedees MH, et al. Precursor cells in mouse islets generate new beta-cells in vivo during aging and after islet injury[J]. Endocrinology, 2010, 151(2): 520-528.
4 Banakh I, Gonez LJ, Sutherland RM, et al. Adult pancreas side population cells expand after β cell injury and are a source of insulin-secreting cells[J]. PLoS One, 2012, 7(11): e48977.
5 Domínguez-Bendala J, Lanzoni G, Inverardi L, et al. Concise review: mesenchymal stem cells for diabetes[J]. Stem Cells Transl Med, 2012, 1(1): 59-63.
6 Hao H, Liu J, Shen J, et al. Multiple intravenous infusions of bone marrow mesenchymal stem cells reverse hyperglycemia in experimental type 2 diabetes rats[J]. Biochem Biophys Res Commun, 2013, 436(3): 418-423.
7 Figliuzzi M, Cornolti R, Perico N, et al. Bone marrow-derived mesenchymal stem cells improve islet graft function in diabetic rats[J]. Transplant Proc, 2009, 41(5): 1797-1800.
8 Sneddon JB, Borowiak M, Melton DA. Self-renewal of embryonicstem-cell-derived progenitors by organ-matched mesenchyme[J]. Nature, 2012, 491(7426): 765-768.
9 Jerabek S, Merino F, Schöler HR, et al. OCT4: dynamic DNA binding pioneers stem cell pluripotency[J]. Biochim Biophys Acta,2014, 1839(3): 138-154.
10 Gouzi M, Kim YH, Katsumoto K, et al. Neurogenin3 initiates stepwise delamination of differentiating endocrine cells during pancreas development[J]. Dev Dyn, 2011, 240(3): 589-604.
11 Phinney DG, Prockop DJ. Concise review: mesenchymal stem/ multipotent stromal cells: the state of transdifferentiation and modes of tissue repair--current views[J]. Stem Cells, 2007, 25(11):2896-2902.
12 Lee RH, Pulin AA, Seo MJ, et al. Intravenous hMSCs improve myocardial infarction in mice because cells embolized in lung are activated to secrete the anti-inflammatory protein TSG-6[J]. Cell Stem Cell, 2009, 5(1): 54-63.
13 Ezquer F, Ezquer M, Contador D, et al. The antidiabetic effect of mesenchymal stem cells is unrelated to their transdifferentiation potential but to their capability to restore Th1/Th2 balance and to modify the pancreatic microenvironment[J]. Stem Cells, 2012, 30(8): 1664-1674.
14 Chen PM, Yen ML, Liu KJ, et al. Immunomodulatory properties of human adult and fetal multipotent mesenchymal stem cells[J]. J Biomed Sci, 2011, 18: 49.
15 Milanesi A, Lee JW, Li Z, et al. β-Cell regeneration mediated by human bone marrow mesenchymal stem cells[J]. PLoS One, 2012,7(8): e42177.
16 Bell GI, Meschino MT, Hughes-Large JM, et al. Combinatorial human progenitor cell transplantation optimizes islet regeneration through secretion of paracrine factors[J]. Stem Cells Dev, 2012,21(11): 1863-1876.
Inhibition of supernate derived from neonatal rats in the replication of bone mesenchymal stem cells
ZHANG Qi, LIU Ya-qian, HAO Hao-jie, LIU Jie-jie, CHEN Hua
Institute of Basic Medicine, Chinese PLA General Hospital, Beijing 100853, China
CHEN Hua. Email:chenhua_19641027@163.com
ObjectiveTo investigate whether the supernate of neonatal rats can infuence the growth of bone mesenchymal stem cells (BMSCs).MethodsThe infant pancreas mesenchymal cells were cultured to get the supernate, and the stem / progenitor property of passage 1 (P1) was identifed with the early marker of stem/progenitor-OCT4, SOX2 for immunofuorescence (IF) staining and pancreatic endocrine related mRNA -Ngn3, PDX1, Insulin was detected. The 2nd passage of BMSCs derived from the bone of 6-week rats were cultured with the supernate, and the morphology and property about insulin secretion of BMSCs were observed.ResultsThe SOX2 stem/progenitor with positive detection existed in the neonatal rats pancreas and showed the expression of mRNA -ngn3 differentiation to endocrine cells. And the supernate could suppress the growth of BMSCs, with no expression of insulin factor showed in BMSCs.ConclusionPancreatic cells of neonatal rats can secrete some components to infuence the mitosis of BMSCs.
neonatal rats; pancreas; bone mesenchymal stem cells
R 576
A
2095-5227(2014)07-0721-05
10.3969/j.issn.2095-5227.2014.07.021
时间:2014-04-11 17:03
http://www.cnki.net/kcms/detail/11.3275.R.20140411.1703.006.html
2014-03-13
国家自然科学基金项目(30970418)
Supported by the National Natural Science Foundation of China(30970418)
张琪,女,在读硕士。研究方向:干细胞与糖尿病治疗。Email:q15321839189@163.com
陈华,男,教授,硕士生导师。Email:chenhua_19641027@163.com
