海龙蛋白质提取物诱导宫颈癌Hela细胞凋亡的机制
2014-04-20刘宇欣李红玉
刘宇欣,李红玉,严 鹏
辽宁医学院药学院,辽宁锦州 121000
海龙蛋白质提取物诱导宫颈癌Hela细胞凋亡的机制
刘宇欣,李红玉,严 鹏
辽宁医学院药学院,辽宁锦州 121000
目的研究海龙蛋白质提取物对宫颈癌Hela细胞增殖及凋亡的诱导作用。方法采用MTT法检测蛋白质提取物对细胞生长的抑制情况,采用Annexin V/PI流式细胞分析法检测细胞凋亡,Western blot检测凋亡蛋白Bax、Bcl-2、P53的表达。结果不同浓度海龙蛋白质提取物对Hela细胞的增殖有抑制作用,具有时间和浓度依赖性。Annexin V/PI流式细胞分析显示,加药组早期凋亡率分别为29.18±0.65、39.32±0.78、51.21±1.13、61.56±1.09,与对照组(9.82±0.18)差异有统计学意义(P<0.05);晚期凋亡率加药组分别为3.20±0.03、7.48±0.06、11.11±0.07、14.60±0.03,与对照组(1.12±0.09)差异有统计学意义(P<0.05)。Western blot检测发现随着蛋白质提取物浓度的升高,Bax、P53蛋白的表达逐渐升高,Bcl-2蛋白的表达逐渐降低。结论海龙蛋白质提取物在一定浓度范围内可在体外抑制Hela细胞增殖并诱导其凋亡,且随蛋白质提取液浓度的升高,凋亡率显著增加,可能的机制是增强促凋亡蛋白Bax、P53的表达,降低抗凋亡蛋白Bcl-2的表达。
海龙;蛋白质提取物;Hela细胞;凋亡
海龙属脊索动物门硬骨鱼纲、海龙目、海龙科。海龙始载于《本草纲目拾遗》,谓“功倍海马,催生尤捷效”。海龙性温、味甘、暖水藏、壮阳道、消肿块,故有温肾壮阳,散结消肿之功效,主治阳痿,遗精,肾虚作喘,瘰疬痰核,跌扑损伤,外治臃肿疔疮[1]。海龙中含有多种氨基酸、脂肪酸和微量元素,还含有多糖和蛋白质类物质[2]。近年来,很多文献报道海龙提取物既有促进人体淋巴细胞转化的作用,又有抑制人体癌细胞株的效果,海龙提取物还可促使肿瘤细胞溶解,且药物剂量越大,细胞溶解率越高[2]。而抗癌的有效成分可能是蛋白质和多肽类,有研究表明,其蛋白类成分对肺癌和结肠癌有抑制作用,而对宫颈癌的作用未见明确报道[3]。近年来宫颈癌发病率较高,对其抗癌药物的研究越来越受到人们的重视。本文对海龙中的蛋白质组分进行提取分离,并考察其对宫颈癌细胞凋亡的影响。
材料和方法
1 材料 海龙(购自锦州市药材市场);低分子量标准蛋白(20 ~ 120 kU)(上海金穗生物科技有限公司);Hela细胞(中国医学科学院基础医学研究所);DMEM高糖培养基、新生牛血清、胰酶、MTT均购自北京赛默飞世尔生物化学制品有限公司;凯基Annexin V-FITC/PI细胞凋亡检测试剂盒(南京凯基生物科技发展有限公司);一抗兔抗人Bax、Bcl-2(北京博奥森生物技术有限公司);兔抗人P53(Proteintech Group公司)。
2 仪器 SW-CJ-2FD双人单面垂直净化工作台(苏州江东精密仪器有限公司);CO2培养箱(日本三洋公司);全自动酶标仪SUNRISE(瑞士TECAN公司);荧光显微镜TE2000-U(日本NIKON公司);FACS Calibur流式细胞仪(美国BD公司);043BR119 12BIO-RAD半干转印仪、041BR24044BIO-RAD电泳槽均购自美国伯乐公司;曝光显影系统。
3 海龙蛋白质的提取 将海龙粉碎,过筛,精密称取50 g,按1∶10加入三蒸水,4℃提取24 h,搅拌,使有效成分充分溶解。将粗提液加入2倍体积的硫酸铵(硫酸铵的饱和度为50%),静置4 h后8 000 r/min离心30 min,弃上清,用蒸馏水溶解搅拌促溶,待蛋白质完全溶解后离心,收集蛋白质上清液,将蛋白质提取液放入经NaHCO3和EDTA处理后的透析袋中,用0.02 mol/L pH7.2的磷酸盐缓冲液平衡,每隔3 h换1次缓冲液,用1%氯化钡检查硫酸盐的除去情况,直到溶液中无硫酸盐沉淀为止[4-5]。将透析得到的提取液用Sephadex G-75层析柱进一步分离,用0.02 mol/L磷酸盐缓冲液(pH 7.2)平衡Sephadex G-75柱(2.6 cm×20 cm),样品上样后用0.02 mol/L磷酸盐缓冲液(pH 7.2)洗脱,流速为0.5 ml/min,收集洗脱液,用考马斯亮蓝法测定蛋白质含量,得到含量为40%的1组蛋白质提取物[6-8]。
4 细胞培养 取1株Hela细胞用含10%新生牛血清的DMEM培养液在5% CO2的37℃恒温细胞培养箱中培养,待细胞80% ~ 90%贴壁时按1∶3进行传代,取对数生长期的细胞进行实验[9]。
5 MTT法检测蛋白质提取物对Hela细胞抑制率 取对数生长期Hela细胞,调整细胞密度为5×104/ml,接种于96孔板,每孔100 μl,将培养板放入37℃5% CO2、饱和湿度的培养箱中。培养24 h后,加入蛋白质提取液,使终浓度分别为0.5 mg/ml、1 mg/ml、2 mg/ml、4 mg/ml,并设空白对照组,每个浓度6个复孔,药物作用24 h、48 h、72 h后,每孔加入5 mg/ml MTT 20 μl,继续培养4 h。小心吸弃孔内全部上清液,同时每孔加入二甲基亚砜(DMSO)150 μl,轻微振荡10 min,混匀后用酶标仪(波长= 490 nm)检测各孔吸光值(A值)。按公式计算细胞生长抑制率并以细胞生长抑制率对药物浓度和作用时间绘制曲线。

6 Annexin V-FITC/PI流式细胞术检测细胞凋亡将Hela细胞以密度为1×106/ml接种于6孔板中,培养过夜后,加入浓度分别为0.5 mg/ml、1 mg/ml、2 mg/ml、4 mg/ml的蛋白质提取液,另外设3个对照孔,其中两个分别加入4 mg/ml的蛋白质提取液,剩下1个孔不加药,放入培养箱继续培养48 h,加入不含EDTA的胰酶消化收集细胞,用PBS洗细胞2次(2 000 r/min离心5 min),调节细胞密度为1×105~ 5×105/ml,加入500 μl的Binding Buffer悬浮细胞,药物处理组分别加入5 μl Annexin VFITC和5 μl PI,混匀,加药的两个孔1个单染5 μl Annexin V-FITC 1个单染5 μl PI,不加药的对照组不做任何处理,缺失的用量用PBS补足,加好后于室温、避光条件下反应5 ~ 15 min,在1 h内用流式细胞仪检测[12-13]。
7 Western blot检测Bax、Bcl-2和P53蛋白表达
取5瓶长满的Hela细胞分别加入0.5 mg/ml、1 mg/ml、2 mg/ml、4 mg/ml的蛋白质提取液,其中1瓶不加药的细胞作为空白对照,加药48 h收集细胞,放入EP管离心,将收集好后的细胞加入裂解液,将其振荡混匀,离心取上清,用BCA法测定细胞中的蛋白含量,进行制样。制好样品后配置12%分离胶,5%浓缩胶进行聚丙烯酰胺凝胶电泳,90 V电压待进入分离胶后调节电泳到120 V,待出现完整的Mark条带后终止电泳,20 V 20 min进行转膜。将转好的膜用封闭液封闭,分别根据所检测的蛋白分子量进行裁膜,分组分别用一抗兔抗人Bax(1∶400稀释)、兔抗人Bcl-2(1∶400稀释),兔抗人P53(1∶1 000稀释),鼠抗人β-actin (1∶1 000稀释)4℃孵育过夜,二抗孵育1 h,两次孵育后分别用TBST洗膜3次,ECL显影,上机检测[14]。
8 数据处理 用SPSS17.0进行统计学分析,各组数据用±s表示,多组之间比较采用两因素析因方差分析和单因素方差分析,P<0.05为差异有统计学意义。
结 果
1 MTT法检测海龙蛋白质提取液对Hela细胞抑制率的影响 根据不同时间、不同浓度测得的OD值,按照材料和方法5中的公式计算出抑制率。由图1可以看出随着蛋白质提取液浓度的升高和时间的延长,细胞的抑制率明显升高,各个浓度组分别与对照组进行比较,差异均有统计学意义(P<0.05)。
2 流式细胞仪检测Hela细胞凋亡 在流式细胞的左下区(LL)为正常细胞,Annexin V及PI均低染(Annexin V- PI-),右上区(RU)为死亡或晚期凋亡的细胞Annexin V及PI均高染(Annexin V+ PI+),右下区(LR)为早期凋亡的细胞Annexin V高染而PI低染(Annexin V+ PI-)(图2)[15-16]。将各浓度组细胞早期凋亡率和晚期凋亡率分别与对照组比较,差异有统计学意义(P<0.05)。见表1。
3 Western blot检测Bax、P53、Bcl-2的表达 Bax、P53在对照组的表达最低,随着蛋白质提取液浓度的升高,两种蛋白的表达均逐渐升高,Bcl-2在对照组表达最高,实验组随着蛋白质提取液浓度的升高,蛋白的表达逐渐降低,3种蛋白各组之间的差异均有统计学意义(P<0.05)。见图3。
表1 Annexin V-FITC/PI流式细胞术检测细胞凋亡率Tab. 1 Annexin V-FITC/PI flow cytometry showing apoptosis rate of Hela cells (±s, %)

表1 Annexin V-FITC/PI流式细胞术检测细胞凋亡率Tab. 1 Annexin V-FITC/PI flow cytometry showing apoptosis rate of Hela cells (±s, %)
aP<0.05, vs 0 mg/ml
ConcentrationEarly apoptosis rateLate apoptosis rate 0 mg/ml9.82±0.181.12±0.09 0.5 mg/ml29.18±0.65a3.20±0.03a 1 mg/ml39.32±0.78a7.48±0.06a 2 mg/ml51.21±1.13a11.11±0.07a 4 mg/ml61.56±1.09a14.60±0.03a
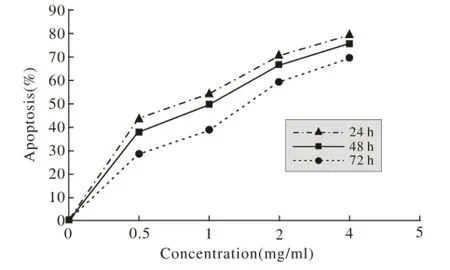
图 1 海龙蛋白质提取液对Hela细胞抑制率的影响Fig. 1 Effect of Syngrathus protein extract on proliferation and apoptosis of Hela cells

图 2 流式细胞术检测Hela细胞凋亡Fig. 2 Flow cytometry showing apoptosis of Hela cells A: control group; B: 0.5 mg/ml dosing group; C: 1 mg/ml dosing group; D: 2 mg/ml dosing group; E: 4 mg/ml dosing group
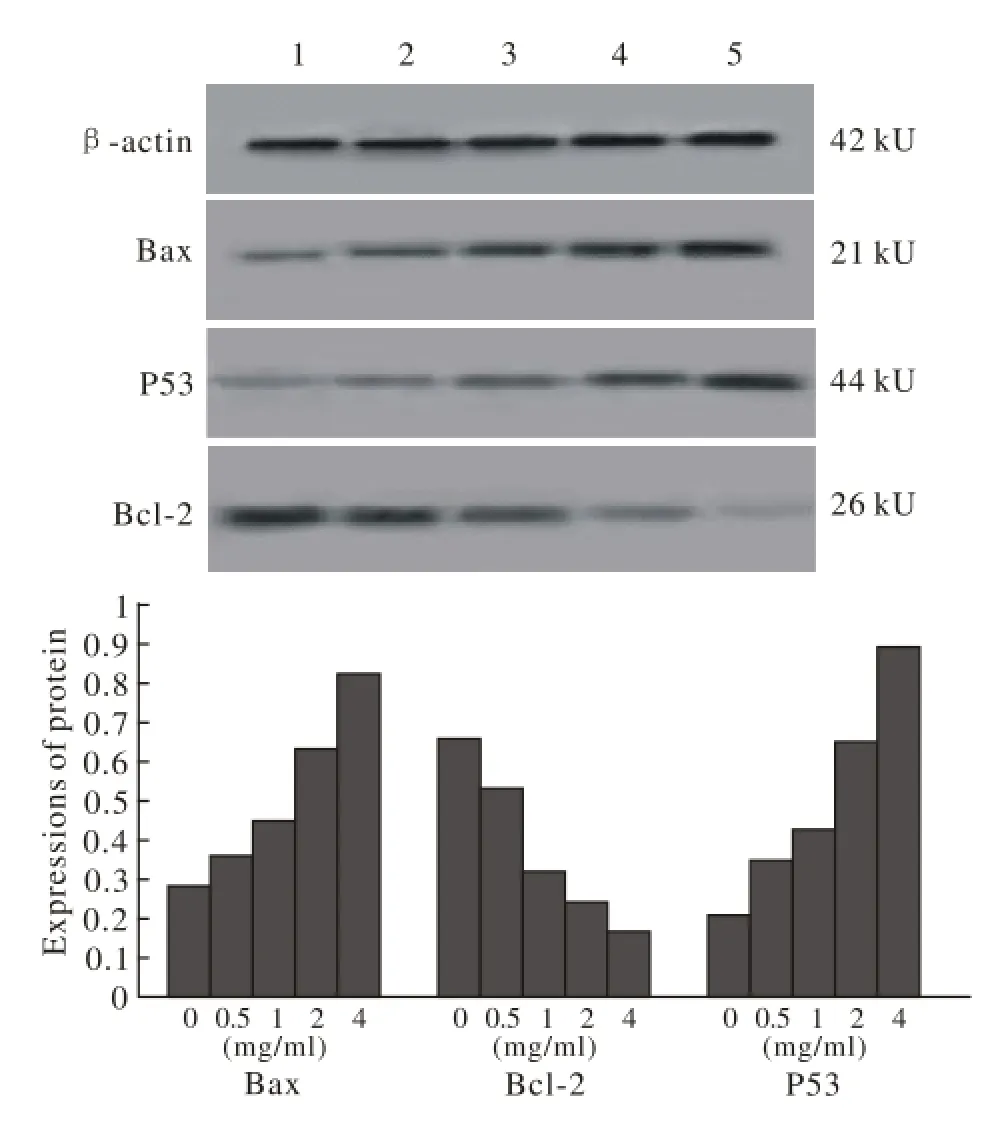
图 3 Western blot 检测Bax、P53、Bcl-2 蛋白的表达情况(P<0.05)Fig. 3 Western blot showing expression of Bax, P53 and Bcl-2 in Hela cells (P<0.05) 1: 0 mg/ml; 2: 0.5 mg/ml; 3: 1 mg/ml; 4: 2 mg/ml; 5: 4 mg/ml
讨 论
宫颈癌细胞凋亡与其他细胞凋亡一样,可能受到很多凋亡相关基因的调控,参与细胞凋亡的基因主要分为两类:促凋亡基因和抑凋亡基因,其中Bax和p53是促凋亡基因,Bcl-2是抑凋亡基因,它们都是细胞凋亡过程中的重要基因。当促凋亡基因表达过量时,抑凋亡基因表达降低,则促进细胞凋亡。实验发现随着海龙蛋白质提取物浓度的增加,Bax和P53的表达逐渐升高,而Bcl-2蛋白的表达则逐渐降低,达到诱导肿瘤细胞凋亡的作用[17-18]。
海龙中蛋白提取物同其他海洋药物的蛋白类提取物一样,不仅具有增强免疫调节的作用,还有抗肿瘤的功效,通过实验初步探讨了其对宫颈癌Hela细胞凋亡的机制,而其他导致凋亡的机制还需要进一步研究,为以后抗宫颈癌药物的研制提供了一定的依据。
1 国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2010: 495.
2 许东晖,谢江海,梅雪婷,等.我国海龙的研究进展[J].中国海洋药物,2005,24(2):51-56.
3 刘冬玲,卢振.药用海洋动物海龙的研究概述[J].时珍国医国药,2005,16(9):918-919.
4 王子佳,李红梅,弓爱君,等.蛋白质分离纯化方法研究进展[J].化学与生物工程,2009,26(8):8-11.
5 王廷华,邢如新,游潮.蛋白质理论与技术[M].北京:科学出版社,2005:108-110.
6 罗轻蕾,闫茂仓,陈少波,等.美国红鱼免疫球蛋白的分离纯化[J].科技通报,2010,26(4):623-627.
7 张及禄,文慧民,孙德军.蝮蛇毒小分子多肽的分离、纯化及其抗肿瘤作用研究[J].中国生化药物杂志,2009,30(4):217-220.
8 何芬,马旭东,王梦月,等.粗吻海龙蛋白质组分体外抗肿瘤活性的研究[J].中国药学杂志,2008,43(12):903-906.
9 Yang PY, Hu DN, Liu FS. Cytotoxic effect and induction of apoptosis in human cervical Cancer cells by Antrodia camphorata[J]. Am J Chin Med, 2013, 41(5): 1169-1180.
10 李月红,易建平,王晓燕.喷他脒对人宫颈癌细胞株 Hela 细胞增殖和诱导凋亡的作用[J].军医进修学院学报,2008,29(2):95-97.
11 林涛,李刚,刘青林,等.冬凌草甲素诱导人脑胶质瘤U251细胞的凋亡及其机制[J].山东大学学报:医学版,2010,48(8):8-12.
12 刘文达,衣服新,惠青山.枸杞多糖联合卡铂对人胶质瘤U251细胞生长抑制和凋亡作用[J].解放军医学院学报,2013,34(2):179-180.
13 张岩岩,康健.中药艾迪诱导人喉癌细胞Hep-2凋亡的研究[J].军医进修学院学报,2012,33(1):78-81.
14 李明,刘霞,郭书翰,等.木果楝内酯抑制人乳腺癌脑转移细胞增殖活性的研究[J].解放军医学院学报,2013,34(8):865-868.
15 刘晓霓,李玉洁,杨庆,等.瑞香狼毒提取物体外诱导肿瘤细胞凋亡作用比较研究[J].中国中药杂志,2012,37(10):1440-1444.
16 Zhang T, Du J, Liu L, et al. Inhibitory effects and underlying mechanism of 7-hydroxyflavone phosphate ester in HeLa cells[J]. PLoS One, 2012, 7(5): e36652.
17 Archana M, Bastian, Yogesh TL, et al. Various methods available for detection of apoptotic cells--a review[J]. Indian J Cancer, 2013,50(3): 274-283.
18 吕俊华,沈文娟,韦笑梅,等.荔枝核提取物对荷瘤小鼠肿瘤细胞Bax和Bcl-2蛋白表达的影响[J].中成药,2008,30(9):1381-1383.
Mechanism of Syngrathus protein extract underlying apoptosis of cervical cancer Hela cells
LIU Yu-xin, LI Hong-yu,YAN Peng
School of Pharmacy, Liaoning Medical College, Jinzhou 121000, Liaoning Province, China
Corresponding author: LI Hong-yu. Email: lihongyu@163.com
ObjectiveTo study the role of Syngrathus protein extract in inducing proliferation and apoptosis of cervical cancer Hela cells.MethodsThe inhibitory effect of Syngrathus protein extract on growth of Hela cells was tested by MTT assay. Apoptosis of Hela cells was assayed by Annexin V/PI flow cytometry. Expression of Bax, p53 and Bcl-2 in Hela cells was detected by Western blot.ResultsSyngrathus protein extract inhibited the growth of Hela cells in a time- and concentration-dependent manner. Annexin V/PI flow cytometry showed that the early and late apoptosis rate of Hela cells were significantly higher in Syngrathus protein extract treatment group than in control group (29.18±0.65, 39.32±0.78, 51.21±1.13, 61.56±1.09 vs 9.82±0.18, P<0.05; 3.20±0.03, 7.48±0.06, 11.11±0.07, 14.60±0.03 vs 1.12±0.09, P<0.05). Western blot displayed that the expression level of Bax and P53 protein increased while that of Bcl-2 protein decreased with the increasing concentration of Syngrathus protein extract.ConclusionSyngrathus protein extract inhibits the proliferation and induces the apoptosis of Hela cells in vitro by up-regulating the expression of Bax and P53 and down-regulating the expression of Bcl-2. The apoptosis rate of Hela cells increases with the increasing concentration of Syngrathus protein extract.
syngrathus; protein extract; Hela cells; apoptosis
R 329
A
2095-5227(2014)06-0623-04
10.3969/j.issn.2095-5227.2014.06.030
2013-11-05
刘宇欣,女,硕士。Email: yuxin19880610@163.com
李红玉,女,教授,硕士生导师。Email: lihongyu@163. com
