一株海洋微藻的分离鉴定及其产油条件优化*
2014-04-17王亚洁赵阳国师振华王俊彩
王亚洁,赵阳国,2**,白 洁,2,师振华,王俊彩
(中国海洋大学1.环境科学与工程学院;2.海洋环境与生态教育部重点实验室,山东 青岛266100)
生物能源的开发利用是缓解全球能源压力、保障能源安全的重要途径。其中生物柴油以其较高的可持续性和清洁无污染的特点成为全球关注的焦点。在制备生物柴油的原料中,微藻处于领先地位,特别是硅藻。硅藻是自养的真核微藻,有200多个属,估计有近10万个种[1-2]。从如此海量的微藻中筛选生长迅速、含油量高的优质微藻是发展微藻能源的首要条件,也是实现微藻生物柴油产业化的主要瓶颈[3]。目前,微藻分离等工作已经取得较快发展[4-6],但对藻株生长和油脂条件缺乏认识,从而限制了其进一步应用。有学者通过改变微藻生长所需的营养和环境条件,提高了硅藻的脂质含量[7-11],同时认为,要使微藻脂肪酸产量最大化,必须首先使微藻产量最大化[12]。可见,筛选优质微藻并对分离藻株的生长和油脂积累条件进行深入分析,可为微藻生物柴油研究提供基础材料,同时也可为微藻扩大化培养提供数据参考。
本研究从青岛近岸海域分离纯化出一株海洋微藻,鉴定为硅藻门的小头菱形藻(Nitzschiamicrocephala),进一步研究了不同浓度硝态氮、部分金属离子对其生长与油脂积累的影响,同时选取对其影响较大的环境因子进行正交试验,探讨最佳培养条件,为菱形藻的扩大培养提供理论基础和数据支撑。
1 材料与方法
1.1 微藻的分离与鉴定
1.1.1 海水样品 本实验分离微藻所用海水样品取自青岛市石老人海水浴场附近海域。
1.1.2 微藻的分离与培养 研究采用微吸管法分离微藻,分离获得的微藻培养于f/2培养基中[13]。配制培养基的海水取自青岛胶州湾,经0.45μm膜过滤并高温高压灭菌后使用。将分离出的藻种接种到盛有600mL培养液的锥形瓶中;然后置于培养箱中培养。培养温度(22±1)℃,光照强度3 500lx,光暗比12h∶12h,每天定时摇晃3次。
1.1.3 扫描电镜观察 应用扫描电镜对微藻观察照相前,采用过氧化氢与超声波联合清洗微藻细胞壁的前处理方法[14]。具体步骤为,用2mL塑料离心管离心收集实验室培养微藻,加20%~30%H2O2重新悬浮,然后放入超声波清洗仪(KQ-250DE,江苏昆山)中振荡1~2min,以去掉硅藻细胞的原生质体及其外部附着的杂质。继以1 000×g离心10min收集藻体,加1mL 1%戊二醛固定2~3h,1 000×g离心10min,用0.1 mol/L的磷酸缓冲液漂洗3次。然后依次用30%、50%、70%、90%、100%的乙醇进行逐级脱水,用吸管将含有样品的乙醇溶液滴在有明胶膜的盖玻片上,可防止细胞被冲走,用临界点干燥法干燥,用离子溅射镀膜法镀膜[15]。
1.1.4 微藻18SrDNA及18S~23S间隔区测序 取5mL新鲜藻液1 000×g离心1min收集藻细胞沉积。应用微生物DNA提取试剂盒(Mobio,USA),通过化学裂解-物理破碎过程提取微藻总DNA。自GenBank中下载硅藻18SrDNA序列,通过对齐后检索保守区域,设计18SrDNA 引物,正向引物 Guizao18S-F:5′-CGTCTCAAAGATTAAGCCATGC-3′,反向引物Guizao18S-R:5′-TCCGCAGGTTCACCTA CGGA-3′,预计扩增1 800bp。18S~23S间隔区序列引物应用真核微生物通用引物,正向引物ITS1:5′-TCCGTAGGTGAACCTGCGG-3′,反向引物ITS4:5′-TCCTCCGCTTATTGATAT GC-3′,预计扩增800~1 200bp。PCR扩增产物通过切胶回收后插入pMD19-T载体(宝生物,大连),并转化到E.coliDH5α。通过氨苄抗性、蓝白斑以及PCR扩增检测后挑取阳性克隆提交给南京金斯瑞生物公司测序。
1.1.5 序列分析 将该微藻的18SrDNA序列与GenBank中近缘藻的序列一起用ClustalW软件[16]进行多序列对齐,用 MEGA 4.0软件[17]中的相邻法建系统进化树,重复1 000次计算bootstrap值。该微藻18S rDNA及18S~23S间隔区序列已提交至GenBank中,登录号为KC759159。
1.2 微藻生物量和油脂的定量分析
1.2.1 生物量测定 采用可见光分光光度法来测量微藻的生物量。根据前期研究,在一定浓度范围内,藻类细胞生物量与吸光度呈正比[18]。每隔24h取一定量的藻液,用722N型可见光分光光度计(上海精科)测定其在750nm处的吸光度(OD值)。
1.2.2 油脂含量测定 微藻细胞内油脂经尼罗红(NileRed)染色后,在激发波长为480nm条件下,可于波长为575nm处检测到与油脂含量成正相关的荧光。每隔24h取一定量的藻液,调整其浓度至OD750nm=0.040,用浓度为1μg/mL的NileRed溶液对藻液染色15min[19],应用F4600型分子荧光光度计(日立公司,日本)在波长为480nm处激发后,检测其波长为575nm处的荧光值。
油脂的绝对含量采用氯仿-甲醇法[20]测定,油脂含量和油脂产率通过公式计算:
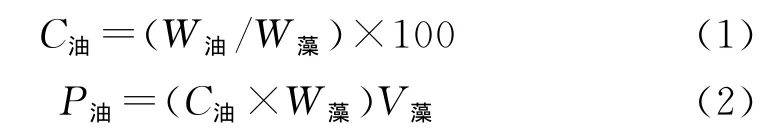
式中:C油为油脂含量(%);W油为油脂质量(mg);W藻为藻粉干重(mg);P油为油脂产率(mg/L);V藻为藻液体积(L)。
1.3 藻株生长和油脂积累条件优化
1.3.1 单因子对藻株生长和油脂积累的影响 以f/2培养基为基础,按照表一中的浓度梯度分别加入NaNO3、MgSO4·7H2O、FeCl3·6H2O、ZnSO4·7H2O、Na2SiO3·9H2O,探讨该藻株在单一因素改变的条件下(即pH、NO-3、Mg2+、Fe3+、Zn2+或改变,其他营养元素按f/2培养基添加),藻株生长及油脂含量变化情况。
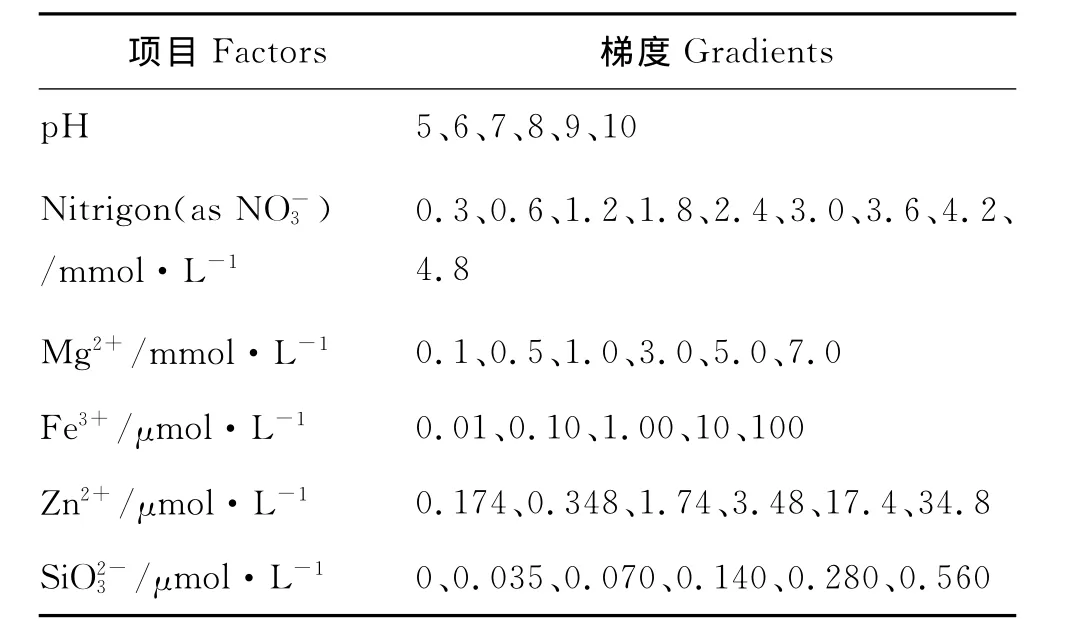
表1 本研究采用的单因素梯度Table 1 Gradient of single factor in this study
1.3.2 藻株的生长及产油条件优化 通过单因子方差分析的方法研究发现,pH、和Fe3+对该藻株的生长及油脂含量影响较大,故该试验阶段选取pH、和Fe3+3个影响因子,以f/2培养基为基础,组合对藻株的生长及产油条件进行优化。采用正交试验设计软件对其培养条件进行设计按L3(34)正交表进行设计,如表2(其他营养元素按f/2培养基添加)。

表2 菱形藻优化培养正交设计因素水平表Table 2 Orthogonal design for optimum growth conditions of Nitzschiasp.Som
1.3.3 统计分析 应用 Excel 2003(Microsoft Corporation,USA)进行标准偏差分析;单因子方差分析由Statistica软件(StatSoft,Inc.)计算获得。
2 结果与讨论
2.1 藻株的形态学特征
图1为电镜下观察到的较完整的细胞,细胞呈细长椭圆形,两端微尖,长度约16μm。壳面花纹呈点状和辐射状,无中央节和端节。壳缝细长,其内侧的龙骨点明显,细胞单独生活,据此推断该藻株为菱形藻(Nitzschiasp.)。根据形态特征及分离地点石老人(Stone Old Man)海水浴场,初步将这株藻命名为菱形藻Som(Nitzschiasp.Som)。

图1 藻株在扫描电子显微镜下的形态特征Fig.1 Morphology of the microalgae under electron microscope
2.2 18SrDNA序列分析与藻株鉴定
为获得该藻株的分类学地位,对其18SrDNA和18S-23S间隔区进行PCR扩增和测序,获得该藻18S rDNA序列1 744bp,18S~23S间隔区序列1 038bp。应用该藻18SrDNA序列与相似序列构建系统进化树(见图2)。根据该图,发现硅藻Som与菱形藻属中部分藻种聚为一类,其中与小头菱形藻(N.microcephalaBA100,登录号:HM805041)18SrDNA序列最相似(>99%),仅有2个碱基差异。
对比发表的典型小头菱形藻(N.microcephalaGrunow 1880),发现二者在形态上除了具有网孔、边齿等相同特征外,存在很大区别。典型的小头菱形藻两端明显变细,似纺锤状,而本研究中分离到的藻株两端收缩不明显,这可能是由于地域或环境条件差异导致的形态变异。该藻种最初于1878年由Cleve和M9ller记录[21],到目前为止,该藻种在欧洲各国、巴西、美国、新西兰等都有过发现和报到,我国也有该藻的记录[22]。该藻壳面细长,上有连续细微的边缘凹面,两端延长变窄呈圆形,有12~16根明显的腓骨,长约10μm。壳纹不明显,仅在一些样品中可以分辨。
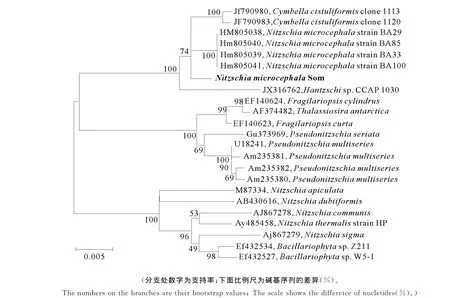
图2 本实验分离到的小头菱形藻Som 18SrDNA序列与相似序列构建的系统进化树Fig.2 Polygenetic tree based on 18SrDNA of Nitzschiamicrocephala Som and the similar sequences
综上所述,根据形态特征和18SrDNA序列比较,将分离到的该硅藻命名为小头菱形藻Som(Nitzschia microcephalaSom)。
2.3 环境因子对藻株生长和油脂积累的影响
一般海洋藻类生存的适宜pH值与海水的pH值相近,pH=8.3左右。不同的藻类生活的适宜pH值不同,偏离此pH值,微藻生长和体内有关代谢活动即受影响。本实验分离到的菱形藻较适pH为6~8(见图3a)。其中,pH=8条件下菱形藻生长速率最高,约为0.01d-1。结合该条件下的生长曲线可以看出,菱形藻油脂的积累主要在其对数末期。在pH=6的条件下,菱形藻的油脂积累量第12天达到最大。而在pH=10的条件下,菱形藻的油脂含量明显低于其他pH条件下的油脂含量,这表明在强碱性条件下,菱形藻的脂类合成受到了抑制。王秀良等[23]发现在pH=9.8的条件下,眼点拟微绿球藻的总脂含量明显低于其他pH条件下的总脂含量,这表明在强碱性条件下,眼点拟微绿球藻的脂类合成受到了抑制,与本研究一致。
文献[24]显示,当硝氮浓度达到8mmol/L时,三角褐指藻的生长受到抑制,如图3b不同浓度硝氮对菱形藻生长的影响不大。菱形藻Som的油脂积累曲线与生长曲线所呈现的趋势有明显的差异。当氮浓度为0.6mmol/L时,菱形藻的油脂积累一直维持在较低水平,而当氮浓度为4.8mmol/L时,菱形藻的油脂积累略显优势,在整个培养过程中,出现了3次峰值,其值约是氮浓度为0.6mmol/L时的2倍。可以看出,实验所设定的不同氮浓度下菱形藻的生长并没有显著的差异,但油脂积累有较大的差异。
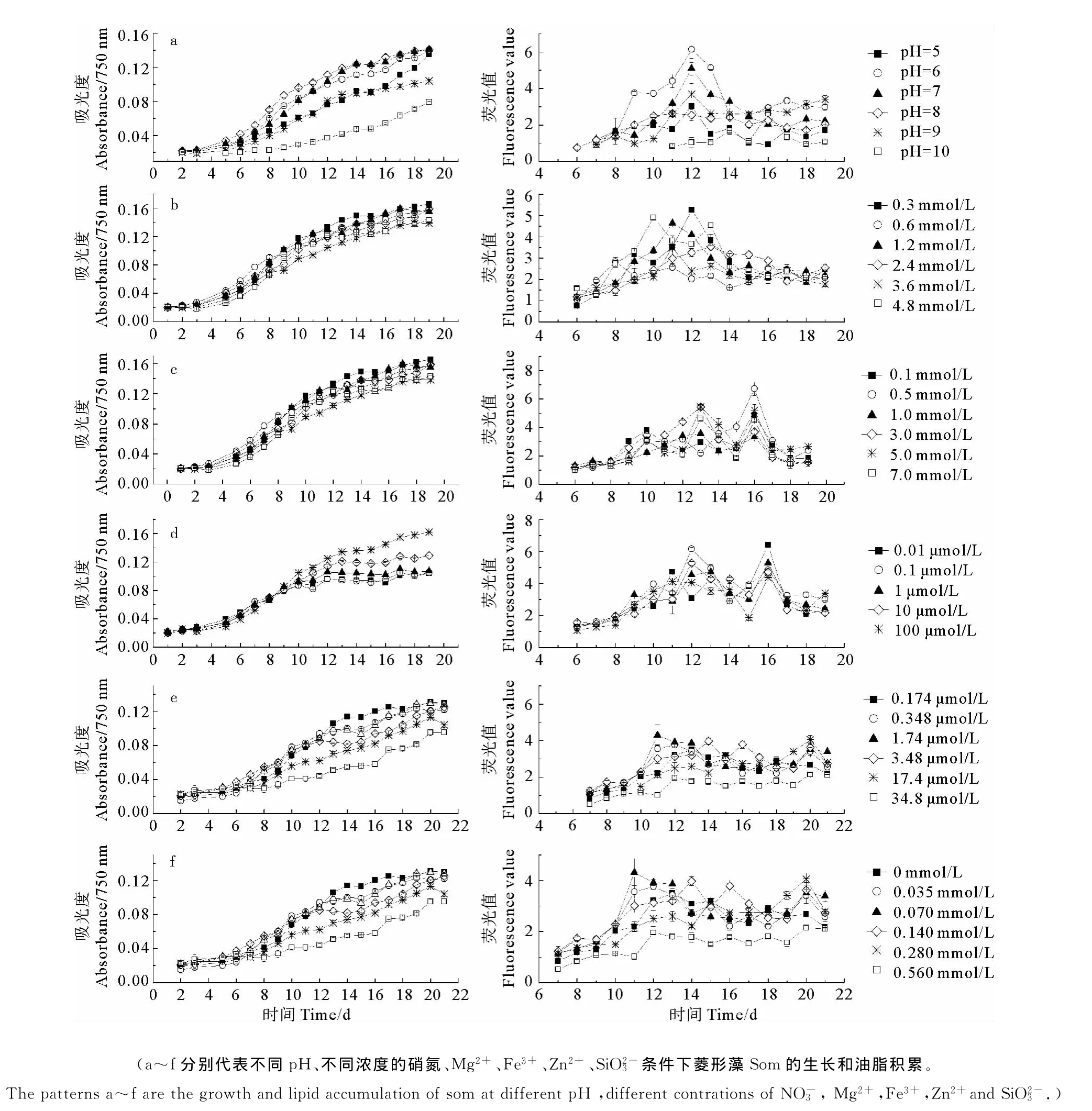
图3 单因子对小头菱形藻Som生长和油脂积累的影响Fig.3 Effects of single factor on N.microcephala Som growth and lipid accumulation
由图3c可以看出,不同 Mg2+浓度对菱形藻的生长影响不明显,而在培养基中加入Mg2+能够明显的提高菱形藻的油脂积累量,在Mg2+浓度为0.3mmol/L条件下,菱形藻的荧光值在第12天达到最高值。这是可能是由于Mg2+对植物脂肪酸合成关键酶ACCase的活性有一定的影响,Mg2+浓度的变化可以提高该酶的活性[25]。但不同 Mg2+浓度条件下,菱形藻Som油脂积累差别不大。
由图3d可以看出,Fe3+浓度对菱形藻的生长具有显著影响。Fe3+的浓度越高,菱形藻的生长速率越大,进入稳定期越晚,藻的生长周期也更长。Fe3+能够影响叶绿素a和某些含Fe辅酶的合成,进而使藻细胞的光合作用系统受到抑制[26],从而影响了藻细胞的代谢和生长。与菱形藻的生长曲线相比,油脂积累曲线所反映出的Fe3+浓度对菱形藻油脂积累的影响并不十分显著,并且,可以看出Fe3+的浓度越高,菱形藻的油脂积累量越小,在第16天,Fe3+浓度为0.01μmol/L的条件下,达到最大值。但很多研究证实Fe3+对微藻的生长及脂质积累均具有促进作用,且影响较显著,如Liu等[27]以小球藻为研究对象,发现Fe3+对小球藻的生长及油脂积累均具有促进作用。这可能是由于培养基中的Fe3+形成胶体态和颗粒态铁[28],一般认为这2种形态的铁不能被浮游植物直接利用[29]。胶体态铁可在光还原的作用下转化成Fe3+和Fe2+,从而被藻类利用。所以微藻能真正大量利用的是可溶性有机络合态铁[30-31]。而在 Fe3+限制条件下,铁还原酶活性增加,培养基中的铁被微藻充分利用,而当Fe3+增加,大多数Fe3+形成胶体态和颗粒态铁,无法被微藻直接吸收利用。
与Fe3+相反,在一定范围内,较低的Zn2+浓度较有利于菱形藻的生长(见图3e)。微量的金属元素是浮游植物生长所必需的营养成分,但是浓度过高则会产生毒性。由此可见,在Zn2+浓度为34.8μm/L条件下,Zn2+对菱形藻产生了毒性作用,限制了菱形藻的生长及油脂的积累。
硅元素是硅藻细胞壁结构的重要组分,并且参与光合色素合成、蛋白质合成、DNA合成和细胞分裂等多种生长代谢过程。培养基中硅(Na2SiO3·9H2O)浓度对菱形藻生长速率和油脂含量的影响如图3f。在浓度为0.560mmol/L的培养基中,菱形藻的生长缓慢,而且油脂含量在整个培养周期内几乎没有变化,水平一直较低。而浓度为0.070mmol/L时,对数末期荧光值可达到培养初期的4倍以上。一些研究结果表明,硅营养不足会促进脂肪酸在某些微藻体内积累,导致微藻体内脂肪酸增加[32-33]。由此可见,在一定范围内,较高的浓度明显的抑制了菱形藻的生长和油脂的积累。相反,低浓度的则促进菱形藻体内油脂的积累。
2.4 菱形藻生长和油脂积累条件的优化
不同硅藻对营养盐的需求有很大的差异,为了探索菱形藻最佳生长和产油的培养基配比,采用正交设计对pH、和Fe3+3个影响因子组合对藻株的生长及产油条件进行优化,得到数据应用Statistica软件对测量数据进行处理,直观分析结果见表3,4。

表3 小头菱形藻Som生长试验结果直观分析表Table 3 Results of visual analysis on growth experiment of N.microcephala Som

表4 小头菱形藻Som油脂积累藻试验结果直观分析表Table 4 Results of visual analysis on oil accumulation experiment of N.microcephala Som
从表3可以看出,对于生长状况,A2相对较好,并且A因素是该指标的较次要因素;但对于油脂含量方面(见表4)应取A3,而且A因素是该指标的主要因素,在确定最有水平时应该重点考虑。并且,从ki上可以看出,A2和A3对菱形藻生长状况影响较小,而对油脂含量的影响较大。故综合考虑,选择A3。
如表3所示,对于生长状况,应取B3;但对于油脂含量方面,B2相对较好。另外,对于生长状况,B因素处于末位的次要因素,而对于油脂含量方面(见表4),B因素是较次要因素。并且,从ki上可以看出,B2和B3对菱形藻生长状况影响较小,而对油脂含量的影响较大。因此,根据B因素对2个指标的不同重要程度,选B2。
对于2个指标来说,都是以C3为最佳水平,所以选C3。
综合上述的分析,最优方案为A3B2C3,可见,菱形藻培养和油脂含量的最优方案是:培养基初始pH=9,浓度为0.070mmol/L,Fe3+浓度为100μmol/L。
3 结语
本研究分离到一株硅藻,经形态学和分子生物学鉴定为小头菱形藻(Nitzschiamicrocephala)。该藻株的油脂积累主要集中在生长的对数末期,pH、和Fe3+对菱形藻的生长及油脂含量影响显著。实验室内小头菱形藻培养及油脂积累的最佳方案为培养基初始pH=9,浓度为0.07mmol/L,Fe3+浓度为100μmol/L,该条件下,菱形藻的生物量和最大细胞密度值分别为94.7 mg/L和3.5×104cell/mL,油脂含量和油脂产率分别达到19.6%和18.56mg/L。
[1]Canter-Lund H,Lund J W G.Freshwater Algae:Their Microscopic World Explored[M].England:Biopress Ltd,1995.
[2]Round F E,Crawford R M.The Diatoms Biology and Morphology of the Genera[M].UK:Cam bridge University Press,1990.
[3]夏金兰,万民熙,王润民,等.微藻生物柴油的现状与进展 [J].中国生物工程杂志,2009,29(7):118-126.
[4]Ahn J W,Hwangbo K,Lee S Y,et al.A new Arctic Chlorella species for biodiesel production [J].Bioresour Technol,2012,125:340-343.
[5]Abou-Shanaba R A I,Mattera I A,Kimc S N,et al.Characterization and identification of lipid-producing microalgae species isolated from a freshwater lake[J].Biomass Bioenerg,2011,35(7):3079-3085.
[6]La H J,Lee J Y,Kim S G,et al.Effective screening of Scenedesmus sp.from environmental microalgae communities using optimal sonication conditions predicted by statistical parameters of fluorescence-activated cell sorting[J].Bioresour Technol,2012,114:478-483.
[7]Dempster T A,Sommerfeldm R.Effects of environmental conditions on growth and lipid accumulation inNitzschiacommuis(Bacillariophyceae)[J].J Phycol,1998,34(4):712-721.
[8]Liang Y,Beardall J,Heraud P.Effects of nitrogen source and UV radiation on the growth ,chlorophyll fluorescence and fatty acid composition ofPhaeodactylumtricornutumandChaetocerosmuelleri(Bacillariophyceae)[J].J Photochem Photobiol B,2006,82(3):161-72.
[9]Parrish C C,Wangersky P J.Growth and lipid class composition of the marine diatom,Chaetocerosgracilisin laboratory and mass culture turbiodostats[J].J Plankton Res,1990,12(5):1011-1021.
[10]Roessler P G.Changes in the activities of various lipid and carbohydrate biosynthetic enzymes in the diatomCyclotellacrypticin response to silicon deficiency[J].Arch Biochem Biophys,1988,267(2):521-528.
[11]Taguchi S,Hirata J A,Laws E A.Silicate deficiency and lipid synthesis of marine diatoms[J].J Phycol,1987,23:260-267.
[12]Syvertsen K E. Optimizing fatty acid production in diatomChaetocerosspp.by modifying growth environment[D].Manoa:University of Hawaii,2001
[13]Guillard R R,Ryther J H.Studies of marine planktonic diatoms.I.CyclotellananaHustedt andDetonulaconfervacea(Cleve)Gran[J].Can J Microbiol,1962,8(2):229-239.
[14]胡强,孙小白,袁秀萍.一种简便、快速清洗硅藻细胞壁的方法[J].水生生物学报,1991,15(2):196.
[15]张菊平,张兴志.植物游离细胞的扫描电镜样品的制备法[J].生物学通报,2008,43(8):56.
[16]Thompson J D,Higgins D G,Gibson T J.CLUSTAL W:Improving the sensitivity of progressive multiple sequence alignment through sequence weighting,position-specific gap penalties and weight matrix choice [J].Nucleic Acids Res,1994,22(22):4673-4680.
[17]Tamura K,Dudley J,Nei M,et al.MEGA4:Molecular evolutionary genetics analysis(MEGA)software version 4.0[J].Mol Biol Evol,2007,24(8):1596-1599.
[18]Rodolfi L,Chini Zittelli G,Bassi N,et al.Microalgae for oil:strain selection,induction of lipid synthesis and outdoor mass cultivation in a low-cost photobioreactor [J].Biotechnol Bioeng,2009,102(1):100-111.
[19]Chen W,Zhang C,Song L,et al.A high throughput Nile red method for quantitative measurement of neutral lipids in microalgae[J].J Microbiol Methods,2009,77(1):41-47.
[20]Bligh E G,Dyer W J.Arapidmethodof total lipidex traction and purification[J].Physiol,1959,37(8):911-917.
[21]Cleve P T,M ller J D.Diatoms.Part III[M].Upsala:Esatas Edquists Boktryckeri,1878.
[22]魏印心,胡鸿钧.中国淡水藻类—系统、分类及生态 [M].北京:科学出版社,2006.
[23]王秀良,刘晨临,张学成.pH对眼点拟微绿球藻的生长、总脂含量及脂肪酸组成的影响 [J].海洋科学,2002,26(5):63-67.
[24]刘梅芳,王海英.氮源及其浓度对三角褐指藻生长及其脂肪酸组成的影响[J].中南民族大学学报,2008,27(2):32-35.
[25]蒋瑶,谭晓风.植物乙酰辅酶A羧化酶基因的分子生物学研究进展[J].经济林研究,2009,27(2):111-117.
[26]陈莉,梁文艳,王金丽,等.铁对铜绿微囊藻生长活性及产毒的影响[J].安全与环境学报,2009,9(4):21-24.
[27]Kosakowska A,Nedzi M,Pempkowiak J.Responses of the toxic cyanobacteriumMicrocystisaeruginosato iron and humic substances[J].Plant Physiol Biochem,2007,45(5):365-370.
[28]Liu Z Y,Wang G C,Zhou B C.Effect of iron on growth and lipid accumulation inChlorellavulgaris[J].Bioresour Technol,2008,99(11):4717-4722.
[29]Suzuki Y,Kuma K,Matsunage K.Effect of iron on oogonium formation growth rate and pigment synthesis ofLaminariajaponica(Phaeophyta)[J].Fish Sci,1994,60:373-378.
[30]Kuma K,Matsunage K.Availability of colloidal ferric oxides to coastal marine phytoplankton[J].Mar Biol,1995,122(1):1-11.
[31]曹勇,李道季,张经.海洋浮游植物铁限制的研究进展[J].海洋通报,2002,21(6):83-90.
[32]Coombs J,Darley W M,Holm-Hansen O,et al.Studies on the biochemistry and fine structure of silica shell formation in diatoms.Chemical composition ofNaviculapelliculosaduring silicon-starvation synchrony [J].Plant Physiol,1967,42(11):1601-1606.
[33]Werner D.Die kieselsaure in stoffwechsel vonCyclotellacrypitcaReimann,Lewin und Guillard [J].Arch Microbiol,1966,55(3):278-308.
