动物组织内残留β2-受体激动剂的检测方法研究进展
2014-04-15高照张援张亦农谢敏豪
高照 张援 张亦农 谢敏豪
1 广东省体育科学研究所(广州510663)
2 国家体育总局反兴奋剂中心
3 北京体育大学
β2-肾上腺素受体激动剂,又称为β2-兴奋剂,是一类人工合成苯乙胺类药物, 通常以盐酸盐等成盐形式保存,常见的包括盐酸克仑特罗、富马酸福莫特罗、盐酸马布特罗、沙丁醇胺、莱克多巴胺等,其药理作用主要为松弛支气管平滑肌、提高骨骼肌收缩力、增加肺通气量、增强支气管纤毛运动[1],临床上常用于防治哮喘等呼吸系统疾病, 同时也被世界反兴奋剂机构(WADA)列为禁止运动员使用的一种蛋白同化制剂[2]。 由于β2-受体激动剂具有促进动物肌肉组织增长、减少脂肪沉积、改善肉质、提高饲料转化率等作用[1-3],从上世纪80 年代开始,其被作为饲料添加剂逐渐广泛应用于畜禽生产中。 其提高瘦肉率机理在于通过肾上腺受体刺激腺苷酸环化酶的合成,从而升高环磷酸腺苷(cAMP)的浓度以增加激素敏感脂酶活性,加快脂肪分解;另外它还可降低血液中Mg2+浓度,间接促进肌肉兴奋,抑制蛋白质分解和脂肪合成,进而增加肌肉蛋白合成[3]。
盐酸克仑特罗(Clenbuterol Hydrochloride),又名氨哮素、氨必妥,俗名“瘦肉精”,化学名为2-[(叔丁氨基)甲基]-4 氨基-3,5-二氯苯甲醇盐酸盐,是使用最广泛的人工合成的β2-受体激动剂之一。口服克仑特罗后2~3 h,人体血液浓度达到峰值,半衰期为25~39 h,药物清除时间约5~8 天(消除97%)。 将克仑特罗作为饲料添加剂, 其使用剂量往往高出治疗量5~10 倍,且使用周期较长(3 周以上),在动物肌肉、肝、肾、毛发等组织中易发生蓄积,人食用摄入过量该药的动物后易发生中毒,可能引发肌肉震颤、心悸、发烧及肌肉痛、目眩、呕吐等较明显的中毒症状。有研究表明, 长期摄入克仑特罗还可能导致染色体畸变进而诱发恶性肿瘤[4]。而且克仑特罗化学性质极稳定,日常烹饪过程如煮沸、烧烤和微波加热均不能使其分解。鉴于其对食品安全的严重威胁,目前多数国家已经禁止在畜牧养殖中使用β2-受体激动剂作为兽药饲料添加剂, 我国农业部也多次发布公告禁止将克仑特罗、 沙丁胺醇等β2-受体激动剂及盐、酯等结合物用于所有食用动物中[5,6]。 然而克仑特罗等的非法使用现象仍然严重,如2007 年9 月,上海市336 人因食用了残留有克仑特罗的猪肉发生集体中毒事件[7];2009 年2 月,广东省40 多人也因食用残留克仑特罗的猪内脏引起中毒[8]。
因此,建立动物组织中β2-受体激动剂快捷有效的定量确证方法, 对于保障我国动物源性食品的安全性,避免运动员食源性违禁药物误用有重要意义。
1 样品的选择及提取
除克仑特罗、溴布特罗等,常见的结构中含有苯酚及间苯二酚的β2-受体激动剂如沙丁胺醇等在动物组织中主要以硫酸轭合物及葡萄糖苷酸轭合物等稳定形式存在(化学结构式见图1),而受轭合物提取回收率的影响,通常要先进行水解,使待测目标物呈游离态后进行提取和净化。 测定动物体内克仑特罗残留的试样基质主要有肝脏、肌肉、尿液、血液、粪便、毛发、视网膜等。 Meyer 等[9]通过对牛喂养含量相当于每公斤体重5μg 克仑特罗的饲料后发现, 首次剂量后2~9 h 血药浓度才达到峰值(0.5 ng/ml),而连续食用21 天后血药浓度达到1.1 ng/ml,血药浓度的双峰值现象表明克仑特罗在动物体内随时间积累。有研究表明在动物肝脏中克仑特罗平均浓度可达45 mg/kg,人食用100 g 被克仑特罗污染的动物肝脏即相当于摄入一次克仑特罗治疗剂量 (0.18 μg/kg)的10 倍以上[10]。 张建丽等[11]对肉食猪六个部位组织中克仑特罗残留量进行定量分析, 结果发现其肝脏和肾脏克仑特罗含量明显高于前腿、后腿、腹肉及里脊, 且猪肉组织中克仑特罗残留量与其受试剂量及受试时间长短呈正相关。
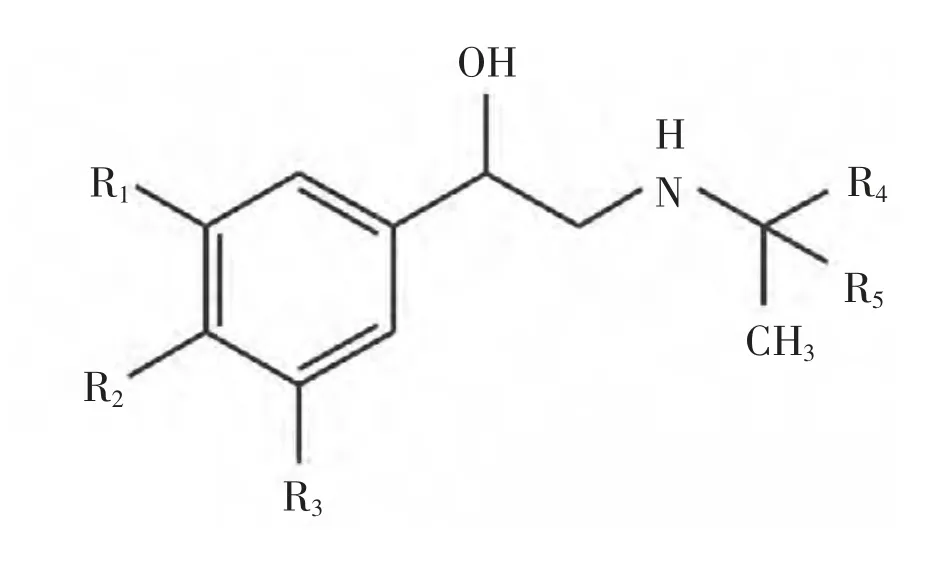
图1 β2-受体激动剂化学结构式
由于分子结构中均含有苯乙醇胺结构 (具体见表1),克仑特罗、沙丁胺醇等常见β2-受体激动剂均易溶于酸性溶液中, 而甲醇对于极性相差较大的不同药物具有较好的溶解性, 所以通常采用甲醇及酸化甲醇水等溶液进行提取[12,13]。 尿液、血液等液体试样通常先进行沉淀蛋白后离心,取上清液进行提取。对于肝脏、肌肉等固体试样,具有代表性的方法为:首先将样品组织用稀酸溶液及弱酸甲醇混合溶液匀浆提取,之后经水浴超声,调上清液pH 至碱性,进一步沉淀蛋白,经高速离心,进行后续提取和净化。Zhang[12]等对动物饲料中的β2-肾上腺素受体激动剂进行了固相萃取净化和液质联用仪分析, 分别比较了5%盐酸甲醇溶液、0.5%偏磷酸-甲醇溶液(1:4,v/v)、0.2 mol/L 磷酸-甲醇溶液(1:4,v/v),结果表明0.2 mol/L 磷酸-甲醇溶液(1:4,v/v)的提取效果最好,对沙丁胺醇、 莱克多巴胺和克仑特罗的平均回收率在83%~110%之间。
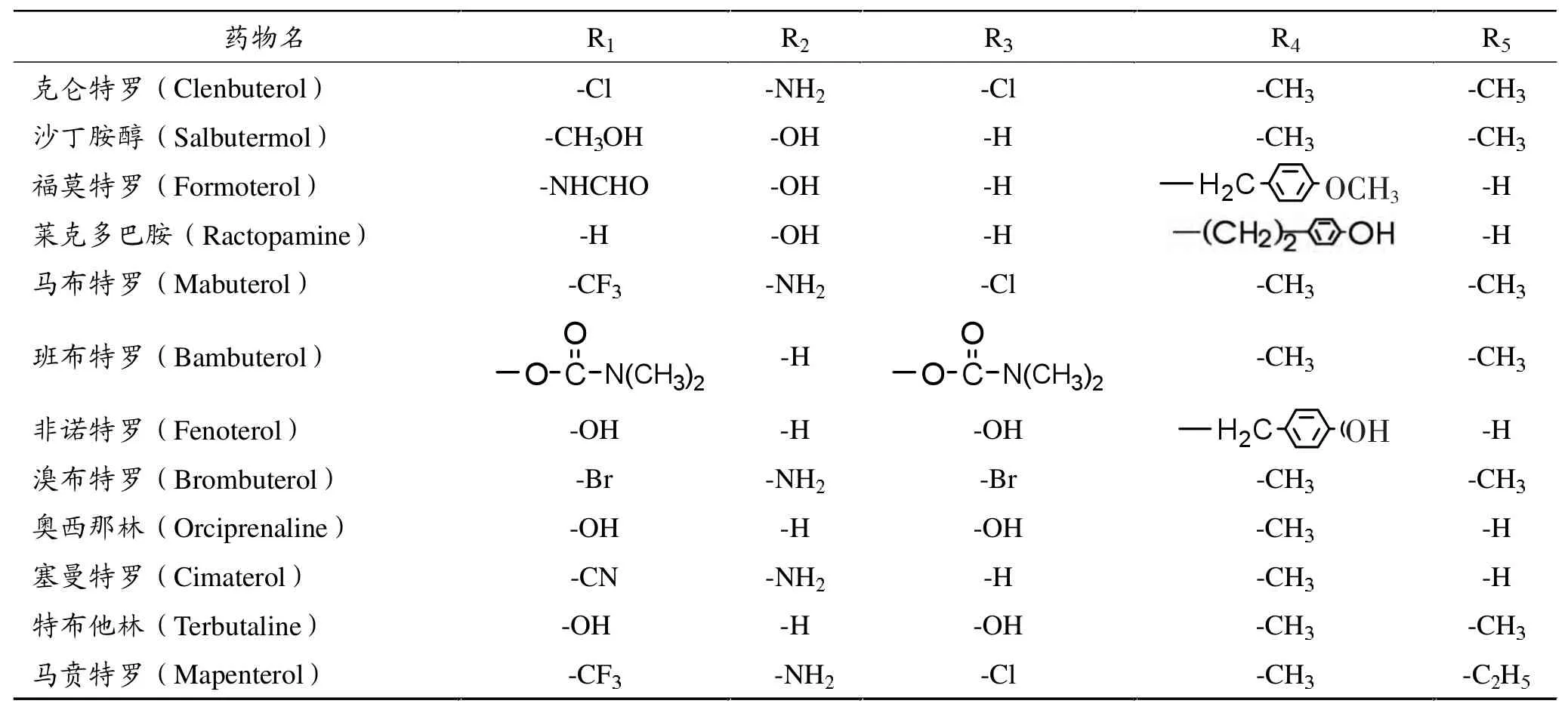
表1 β2-受体激动剂常见种类及结构中的特征基团
2 样品净化方法
样品的净化和待测组分的有效富集直接影响到检测方法的稳定性和灵敏度, 目前食品中药物测定除了传统的液-液萃取方法外,还有近来发展的固相萃取(SPE)、分子印迹固相萃取(MIPs)、免疫亲和色谱技术(IAC)和凝胶渗透色谱(GPC)等一系列提取净化方法[13]。
2.1 液-液萃取(liquid-liquid extraction)
液-液萃取是从生物样品中溶解提取药物的最基本方法, 盐酸克仑特罗在酸性溶液中易溶于水和甲醇,而在碱性溶液中可溶于乙醚、乙酸乙酯等有机溶剂。 常用的萃取溶剂有:乙酸乙酯-异丙醇(9:1,v/v)、乙醚、二氯甲烷等[14],但碱性条件下溶剂直接萃取,不仅使克仑特罗提取率较低,且专属性差,基质干扰较强。
2.2 固相萃取(solid phase extraction,SPE)
固相萃取是当前复杂基质中痕量残留检测最为常用的一种样品预处理净化技术。 它是利用固体吸附剂,将样品中目标化合物吸附,使其与样品基质及干扰化合物分离,再用洗脱液洗脱下来,从而达到分离和富集的目的。 固相萃取技术由于具有操作简单快速、消耗有机溶剂少、样品回收率高、易于自动化等优点, 目前已在食品等复杂基体前处理中广泛应用[15,16]。 Spisso[17]等比较了猪尿中克仑特罗的两种不同提取方法,样品分别在弱酸性(pH≈6)条件下通过Bond Elut 混合型阳离子交换萃取柱(填料为辛基和丙苯磺酸基键合到硅胶基体),甲醇淋洗后用乙酸乙酯-氨水(97∶3,v/v)洗脱;样品通过XAD-2 大孔树脂柱净化(填料为苯乙烯-二乙烯基苯共聚物),用甲醇洗脱并浓缩后复溶,再在碱性条件下(pH=10)经乙醚提取测定, 结果表明用混合型阳离子交换萃取柱提取克仑特罗的平均回收率为85.9%, 检出限为0.5 ng/ml,而XAD-2 大孔树脂柱的提取平均回收率为78.4%,检出限为20 ng/ml,且重现性较差,证实了混合型阳离子交换萃取柱对复杂基质中β2-受体激动剂的检测有良好的提取效率和专属性。
2.3 基质固相分散萃取 (matrix solid phase dispersion,MSPD) 和 分 子 印 迹 聚 合 物 萃 取 柱(molecularly imprinted solid phase extraction,MISPE)
分子印迹聚合物的制备主要是通过模板分子(印迹分子)与聚合物单体键合,进而使聚合作用记录聚合物中形成的与模板分子空间构型相匹配的空穴,在用洗脱等方法除去聚合物中的模板分子后,聚合物中就留下了空间大小和构型都与模板分子匹配的具有高度选择识别性的空间, 从而能够选择性地识别模板分子或其类似物[18]。 Baker 等[19-21]首次将固相分散技术与反相键合填料吸附原理相结合, 建立基质固相分散萃取技术。 首先通过不规则形状的硅藻土或者聚合物等固相吸附剂颗粒与样品基质进行研磨,分散制备样品,再将制备的样品填入层析柱后根据分离目标物的要求, 以特定比例的混合溶剂或者不同极性的溶剂分别对填充的样品进行洗脱。 基质固相分散提取过程将组织破解、 目标物提取和净化在同一操作中完成,并避免了离心、沉淀、浓缩等环节造成的目标物损失,操作简单快速,适用于固体样品的处理, 目前在食品分析中得到越来越广泛的应用[22]。
2.4 免疫亲和色谱法(immunoaffinity column,IAC)
免疫亲和色谱(IAC)是基于色谱分离和抗原—抗体反应特异性相结合原理[23],对待测物进行净化和浓缩的方法,目前已在食品药品分析、免疫耗竭实验及免疫色谱法分析等领域广泛应用。 Wang[24]等通过耦合溴化氰活化琼脂糖凝胶 (CNBr-activated Sepharose-4B)和辛酸-硫酸铵净化后的沙丁胺醇多克隆抗体, 制备了一种可以从猪肉样品中选择性提取沙丁胺醇的免疫亲和色谱柱, 其偶联率和动态柱容量分别为98.6%和400 ng/ml IAC 凝胶。 通过空白猪肉样品添加沙丁胺醇, 分别制备2 ng/g、10 ng/g、20 ng/g 和50 ng/g 浓度水平的基质加标样品。 经液相色谱仪检测,各浓度样品回收率均在83.3%~92.2%之间,相对标准偏差范围为2.8%~7.0%(n = 5);方法的检出限和定量限分别为0.25 ng/g 和0.5 ng/g。 Wang等[25]通过免疫亲和色谱与气相色谱-质谱建立了猪肝脏组织及尿液中莱克多巴胺残留的检测方法。 首先通过莱克多巴胺与戊二酸酸酐耦合制成半抗体,再采用混合酸酐法将半抗体与牛血清蛋白(BSA)及鸡卵清蛋白(OVA)共价偶联,分别合成免疫抗原和包被抗原[26];将抗原以弗氏完全佐剂注射入8 周龄的Balb/c 鼠背部(100 μg/kg 体重),两周后再以弗氏不完全佐剂进行4 次皮下注射(每次间隔2 周),期间分别收集小鼠血浆进行血清抗体滴度监测。 免疫注射结束后切除脾脏并将脾细胞和SP2/O 骨髓瘤细胞融合,形成杂交瘤细胞制备单克隆抗体,再经过溴化氰活化琼脂糖凝胶耦合制备免疫亲和柱。 结果通过气质联用测定方法的检出限为0.5 ng/g,定量限为2.0 ng/g;空白尿液/肝脏样品添加浓度在2.5~20 ng/ml(ng/g)的范围内,回收率分别在76.2%~83.1% 和68.2%~78.6%之间。
2.5 凝胶渗透色谱萃取 (gel permeation chromatography,GPC)
凝胶渗透色谱是基于体积排阻的原理进行分离,利用样品中物质分子大小的不同,以及在凝胶中滞留时间的不同实现分离,能有效去除油脂、天然色素等高分子质量的干扰。由于其具有步骤简单、操作方便、回收率较高等优点,被广泛应用于兽药残留分析[27]。 卢剑等[28]通过凝胶净化串联固相萃取,对猪肉样品中的9 种β2-受体激动剂进行富集和净化,样品经β-盐酸葡萄糖醛苷酶/芳基硫酸酯酶酶解和叔丁基甲醚超声提取后,浓缩提取液,残渣用10 ml 乙酸乙酯-环己烷(1∶1,v/v)溶解,经凝胶净化串联固相萃取柱净化,收集馏分通过超快速液相色谱-串联质谱分析,结果对克仑特罗的检出限为0.1 μg/kg,在0.3 μg/kg、2.0 μg/kg、5.0 μg/kg 3 种添加水平的平均回收率为79.35%~109.80%,相对标准偏差为2.12%~9.11%。 该方法灵敏度高、重现性好,较为适合猪肉组织的检测。
2.6 其他样品提取及净化方法
超临界流体萃取法 (supercritical fluid extraction,SFE)是利用压力和温度对超临界流体溶解力变化的影响,有选择性地把极性、沸点及分子量不同的成分提取和分离。 目前研究较多的超临界流体是二氧化碳,其具有无毒、无污染、惰性环保、可避免产物氧化和萃取温度低等优点,尤其适合食品中药物及活性物质的分离提取。 而对于极性化合物,适当加入少量极性溶剂能够大大提高萃取效率。 O’keeffe 等[29,30]采用此技术对牛肝中克仑特罗及沙丁胺醇进行提取, 在流体中加入甲醇作为修饰剂以降低克仑特罗的极性、提高萃取效率。提取物不经净化直接旋转蒸干后复溶, 用酶联免疫法检测, 结果回收率均达到80%以上,定量限为0.1 ng/g,日内日间精密度良好(<15% )。 双 相 渗 析 膜 分 离 技 术 (bipolar electrodialysis membrane separation)是一种半透膜分离技术, 适用于分子量较小化合物的分离及提取。Gonzalez 和Fente 等[31,32]利用装有提取溶剂叔丁基甲醚、 二氯甲烷的渗析管对动物肝脏及毛发中的克仑特罗进行分离提取,37°C 以下以150 r/min 转速连续渗析提取4 小时, 然后将渗析管中的有机相经无水硫酸钠脱水后以氮气浓缩至干, 肝脏样品克仑特罗加标水平在2 ng/g 时, 以气质联机法测定的回收率达99.13%。 此方法节省了液-液提取及净化步骤,具有操作简便、节省时间和提取效率高等优点。但由于操作条件的限制, 目前以上几种方法尚未应用于批量样品处理中。
3 仪器分析方法
3.1 免疫分析法(immunoassays,IAs)
免疫分析法是以抗原与抗体的特异性、 可逆性结合反应为基础检测各种物质的分析方法。 由于免疫法选择性较好,且具有前处理简单、灵敏度高等优点, 故在快速筛选大批量样品中兽药残留方面有广泛应用。根据标记物及检测体系的不同,免疫法主要分为酶免疫测定法、 胶体金免疫测定法、 免疫传感器、化学发光酶免疫法等[33],其中应用最广泛的即为酶免疫测定法。
3.1.1 酶免疫测定法(enzyme immunoassay,EIA)
酶免疫测定法是使用酶进行标记的免疫分析方法, 由于避免了同位素标记的放射性污染和标记物易衰变等问题,且操作方便、仪器简易,目前EIA 在药物残留分析中得到很快的发展, 其中应用最广的是酶联免疫吸附法 (enzyme linked immuno-sorbent assay,ELISA)。 国内使用最多的进口酶免检测试剂盒产品包括德国r-Biopharm 公司和英国Randox Laboratories Ltd 公司生产的试剂盒[34]。 陈穗等[35]使用克仑特罗试剂盒(德国r-Biopharm 公司),从方法的检出限、校正曲线的线性范围、精密度、加标回收率测定等方面对酶联免疫法检测猪尿中克仑特罗残留量的质量控制方法进行了探讨,结果表明,该试剂盒的样品检测下限为0.03 ng/ml, 定量下限为0.1 ng/ml。当克仑特罗标准添加水平为0.5 ng/ml、1.0 ng/ml时,平均回收率分别约为84%和90%,均符合残留分析质量控制要求[36]。
3.1.2 胶体金免疫层析技术测定法 (colloidal gold immunoassay,CGIA)
胶体金免疫层析测定法是一种利用胶体金颗粒作为标记物、简单快速的免疫分析方法[37]。 其最关键的是制备出特异性强和纯度高的单克隆抗体, 使用原理是将人工合成的抗原先固定于条状纤维层析材料的试纸条上, 胶体金标记试剂 (抗体或单克隆抗体)吸附在结合垫上,样品溶液借助毛细作用在试纸条上移动, 待测物与人工合成的抗原竞争结合胶体金标记的抗体,并直接以颜色显示检测结果。 Zhang等[38]使用多克隆抗体——胶体金标记免疫层析法对猪尿液中的克仑特罗和莱克多巴胺同时进行测定,结果显示该方法对猪尿液中克仑特罗和莱克多巴胺的检出限均为0.1 ± 0.01 ng/ml, 光密度扫描仪测定半抑制浓度(IC50)分别为0.56 ±0.08 ng/ml 和0.71 ±0.06 ng/ml,肉眼观测水平的临界值均为1.0 ng/ml,且与气相色谱法-质谱法检测平行实验结果具有一致性。 该法检测程序可在5 min 内完成,具有操作快速方便、结果易于判断的特点,适用于猪尿中盐酸克仑特罗和莱克多巴胺残留的现场快速筛查测定。
3.1.3 化学发光免疫法 (chemiluminescence enzyme immunoassay,CLEIA)
化学发光免疫法是将化学发光系统与免疫反应相结合,先用化学发光物质标记抗体或抗原,待与待测的抗原或抗体反应后再将游离态的化学发光标记物分离并加入其它相关物进行化学发光, 进而通过反应产生的辐射光强度来进行抗原抗体定性定量的分析方法[39]。 Chen 等[40]采用过氧化脲作为luminol-CH4N2O·H2O2-HRP (鲁米诺-过氧化脲-辣根过氧化物酶化学发光体系) 的氧化剂, 联苯硼酸作为增强剂, 并通过对鲁米诺及联苯硼酸的浓度进行优化来增强化学发光信号和提高发光增敏作用, 再以重现性较好的流动注射化学发光法检测免疫反应后的酶标复合物。结果在最优条件下,克仑特罗检测的线性范围达到0.05~9 μg/L(r2= 0.9959),方法检出限为0.02 μg/L。 此方法结合了化学发光分析的高灵敏性和免疫反应的高特异性, 因此在食品分析领域具有广泛的应用前景。
3.2 电化学检测法
3.2.1 毛细管区带电泳法 (capillary electrophoresis,CE)
毛细管电泳是根据不同组分的带电粒子在高压直流电场的作用下迁移速率的不同而实现各组分分离的分析方法。 根据分离模式可分为毛细管区带电泳、毛细管凝胶电泳、毛细管等电聚焦等,可以满足基质复杂的食品分析要求,且具有分离效果好、分析速度快、样品用量少的特点[41]。 毛细管电泳与质谱联用[42]及与核磁共振仪联用[43]技术的不断完善,大大提高了检测的灵敏度,并且缩短了分析时间,使毛细管电泳在药物残留分析中得到更广泛应用。 颜流水等
[44]建立了毛细管电泳-质谱联用分析方法,测定猪肝脏中克仑特罗和沙丁胺醇。 处理后的样品电泳分离时间小于6 min,在优化的毛细管电泳分离和质谱检测条件下, 基质加标克仑特罗和沙丁胺醇的检出限分别为0.4 μg/kg 和0.3 μg/kg。 方法灵敏度高、特异性强,测定结果准确可靠,可用于食品中克仑特罗和沙丁胺醇残留的确证性检测。
3.2.2 电化学生物传感器(electrochemical biosensor)
生物传感器主要包括敏感元件和信号转换元件(换能器)两部分,该技术是将生物活性物质作为敏感元件(生物识别系统),在与分析物特异性结合后引起物化性质改变,经换能器转换为次级可用信号,从而实现对待测分析物结构及浓度进行分析[45]。 He等[46]制作了基于碳纳米管的无标记电化学免疫传感器, 使用1-[3-(二甲胺基)-丙基]-3-乙基碳二亚胺和N-羟基琥珀酰亚胺磺酸作为交联剂,将克仑特罗共价键合到多壁碳纳米管(MWCNTs)表面。 通过吸附作用将轭合物聚合到玻璃碳电极表面, 在循环伏安法和微分脉冲伏安测量下,使用K3Fe(CN)6的氧化还原探针监控免疫反应步骤。在克仑特罗单克隆抗体存在时,[Fe(CN)63-/4-]氧化还原反应的峰电流值下降,可能是由于抗体在溶液中可以结合电极表面的轭合物。该实验中单克隆抗体对溶液中盐酸克仑特罗具有很高的敏感性及特异性, 检出限达到0.32 ng/mL,并通过与酶联免疫法及液质联用法平行测定空白加标饲料结果的比较证实了方法的准确性。 Wang 等[47]采用以银钯合金纳米颗粒为载体的电化学生物传感器对猪肉样品进行检测, 以经还原的氧化石墨烯(RGO)来固定人工抗原和增强电化学信号,银钯合金纳米粒子用于标签抗体及在无其他底物的磷酸缓冲液(PBS)中产生强电化学信号,并引入丝网印刷碳电极(SPCE),避免电极之间的干扰,实现了在0.01~100 ng/ml 的浓度范围内同时检测莱克多巴胺、克仑特罗以及沙丁胺醇, 检出限分别为1.52 pg/ml、1.38 pg/ml 和1.44 pg/ml,方法有较好的灵敏度,满足复杂基质中β2-受体激动剂的检测。
3.3 色谱质谱分析
3.3.1 高效液相色谱法 (high performance liquid chromatography,HPLC)
高效液相色谱在经典液相色谱理论的基础上引入了高压泵、 高效固定相及灵敏度较高的紫外阵列检测器及荧光检测器等,具备分析效率高、灵敏度高及操作易自动化等优点[48]。Zhang 等[49]结合固相萃取和高效液相色谱紫外检测器对鱼肉中的克仑特罗残留进行分析,样品匀浆后经过超声提取和固相萃取柱净化,以磷酸二氢钠水溶液(pH=6) 和甲醇为流动相,在210 nm 紫外波长下检测, 方法检出限为0.01 μg/ml,在0.1~1.0 μg/ml 空白添加范围内回收率均在75%以上。 王琦等[50]采用液-液萃取和固相萃取提取纯化动物组织样品,以含0.1%甲酸的乙腈溶液和0.1%甲酸的乙酸铵水溶液(25:75,v/v) 为流动相,在244 nm波长下以外标法定量。 此方法检出限为0.05 mg/kg,方法日间精密度RSD = 4.46%, 回收率为88. 0%~93.4%,具有较好的精密度和准确度。 但由于紫外检测器的基质影响较大, 限制了方法的灵敏度和专属性,目前已较少作为确证分析方法。
3.3.2 气相色谱质谱/高分辨质谱法 (GC-MS,GCHRMS)
气相色谱质谱法是β2-受体激动剂在复杂样品中残留测定中最常用的定量和确证方法。 GC-MS 具有较高的特异性,由于β2-受体激动剂的化学结构中有不易气化的羟基和氨基, 因此需要对处理后的样品衍生化,常用的衍生化试剂有N-甲基-N-三甲基硅基-三氟乙酰胺(MSTFA)和N,O-双(三甲基硅基)-三氟乙酰胺(BSTFA)。 苗虹等[51]对动物性食品中克仑特罗用高氯酸提取后, 用乙酸乙酯-异丙醇(6∶4,v/v)萃取,然后进一步用弱阳离子交换萃取柱进行富集净化,再以乙醇-浓氨水(98∶2,v/v)洗脱并浓缩,经N-O-双三甲基硅烷三氟乙酰胺(BSTFA)衍生后进行气质联用检测, 方法定量限为0.5 ng/g。Schnzer 等[52]通过气相色谱—高分辨质谱仪对马匹毛发中的克仑特罗进行分析,选取6~12 厘米长的毛发(代表3~6 个月的生长周期)用甲醇-水(1∶1,v/v)清洗,再用0.5 mol/L 的KOH 溶液60°C 超声水浴碱解,提取液经HLB 固相萃取柱净化后浓缩,再使用MSTFA 衍生化为N,O-bis-TMS 衍生物通过高分辨质谱检测,方法的检出限达到0.9 ng/g。
3.3.3 液相色谱串联质谱法(LC-MS/MS)
液相色谱质谱由于其具有灵敏性高、 准确性高、选择性高、分析检测范围宽以及定性、定量准确等特点,且减少了衍生化步骤的影响,目前被广泛应用于复杂样品,尤其是食品中痕量药物的筛查和确证[53,54]。Fan 等[55]通过液相色谱串联线性离子阱质谱,对猪肉、 猪肝及鸡肉中的25 种β2-受体激动剂和23 种β-受体阻滞剂同时进行定性定量测定, 样品先经5%浓度的三氯乙酸提取, 再通过MCX 阳离子交换萃取柱净化浓缩后进样, 三级离子碎片连续反应监测模式下检测。 结果所有药物的回收率均在46.6~118.9%之间,相对偏差在1.9~28.2%之间;方法的检出限在0.05~0.49 μg/kg 之间,可以满足同时检测复杂基质中多种药物残留的要求。 Lehner 等[56]对马血浆中克仑特罗的测定进行了固相萃取-液相色谱串联质谱方法的开发, 结果该方法对克仑特罗的确证及定量能力达到10 pg/ml。
4 相关检测标准
目前执行的克仑特罗残留检测国家标准方法主要包括: 农业部1025 号公告-18-2008 动物源性食品中β2-受体激动剂残留的液相色谱-串联质谱检测法[57],该方法对于克仑特罗、沙丁胺醇、莱克多巴胺、马布特罗等9 种β2-受体激动剂在猪肉、猪肝、鸡蛋和牛奶中的检出限均达到0.25 μg/kg;国家质量监督检验检疫总局国家标准GB/T5009.192-2003 动物性食品中克仑特罗残留量的气相色谱质谱、 高效液相色谱、酶联免疫检测法[58],这三种方法对于动物组织、尿液、血液的检出限均为0.5 μg/kg;国家质量监督检验检疫总局SN/T 1924-2011 进出口动物源食品中克仑特罗、莱克多巴胺、沙丁胺醇、特布他林残留量的液相色谱-串联质谱法检测方法[59],该方法对于动物组织、 内脏及牛奶和奶粉中的克仑特罗检出限为0.05 μg/kg,对于莱克多巴胺、沙丁胺醇及特布他林的检出限均为0.5 μg/kg。
由于目前欧盟对于动物肌肉中克仑特罗最大残留限量为0.1 μg/kg[60],日本和国际食品法典委员会(Codex Alimentarius Commission,CAC)允许的最大残留量为0.2 μg/kg[61]。 所以只有新出台的SN/T 1924-2011—进出口动物源食品中克仑特罗等的液相色谱-串联质谱法检测方法达到了上述检测要求。
5 小结
综上所述, 目前对于动物组织等复杂样品基质中痕量药物的提取和富集方法,固相萃取等专属性、重现性良好的提取方法已经得到广泛应用, 并在提高分析的灵敏度及准确性方面发挥着较传统提取方法更明显的优势;而近期发展的分子印迹固相萃取、超临界流体萃取、 免疫亲和色谱萃取和凝胶渗透色谱萃取等一系列新的样品提取净化方法, 可以满足更高精度要求以及多种药物的同时提取富集, 从而为高灵敏度仪器的有效分析提供可靠保证。 而随着仪器分析技术的不断更新, 痕量药物分析仪器也更加多样化和系统化。 免疫分析方法不仅有较好的灵敏度,且具有高通量、操作简单、检测成本低,能够较好满足基层实验室、现场监控检测、临时快速抽样检测的要求。但是由于提供的分子结构信息较少,尚不能作为确证方法, 而且金标免疫技术等由于需采用单克隆抗体研制,费用较高不适合大批量样品检测;电化学分析及毛细管分析技术有较好的特异性和灵敏度,但由于检测条件和方法重现性等因素,对大样本量克仑特罗残留筛查的应用并不十分广泛。 色谱质谱技术作为主要的确证分析和精确定量方法,在动物组织中β2-受体激动剂检测中的应用日趋完善,并被采纳为国家标准的仪器方法。
鉴于目前食品安全形势严峻和WADA 兴奋剂检查力度的不断加强及其认证实验室检测能力的显著提高, 各国对于动物体内违禁药物残留监控管理不断加强,对数据精准性的要求越来越高,监测范围及样本数量也越来越大, 这都要求兽药残留检测技术进一步发展以满足其需要。 药物残留检测技术的发展方向主要可概括为:(1)更高的灵敏度、更低的检出限和定量限;(2)高通量,即单位时间内分析更多样品;(3) 更高的选择性、 特异性和抗干扰能力;(4)分析仪器更高的稳定性,更多联用技术的发展;(5)减少污染和消耗,降低分析成本。由此可见,动物体内违禁药物克仑特罗等的分析技术仍有待进一步改进和完善,需建立更有效和实用的检测体系,从而更好地维护和保证我国运动员食品安全。
[1] Duarte T,Menezes-Rodrigues FS,Godinho RO. Contribution of the extracellular cAMP-adenosine pathway to dual coupling of β2-adrenoceptors to Gs and Gi proteins in mouse skeletal muscle. J Pharmacol Exp Ther,2012,341(3):820-828.
[2] 徐友宣. β2-受体激动剂克仑特罗的药理及滥用. 中国运动医学杂志,2002,21(4):222-224.
[3] 汪令四. 含“瘦肉精”畜产品对人体健康的危害. 畜牧兽医杂志,2002,21(4):29-30.
[4] 王选年. β2-肾上腺素受体激动剂克仑特罗的免疫特性及中毒病理学研究.吉林大学博士学位论文,2002:148-149.
[5] 农业部第235 号公告 《动物性食品中兽药最高残留限量》.中华人民共和国农业部. 2002-12-24.
[6] 农业部农牧发[2002]1 号关于发布《食品动物禁用的兽药及其它化合物清单》的通知.中华人民共和国农业部.2002-03-05.
[7] 顾振华,郑雷军.上海盐酸克仑特罗食物中毒事件的分析与思考. 中国食品卫生杂志,2007,19(1):10-12.
[8] 刘婧婷. 广州46 人因食用猪内脏住院 疑为瘦肉精中毒[2009 -02 -20].http://health.people.com.cn/GB/14740/22121/8841124.html
[9] Meyer HH,Rinke LM.The pharmacokinetics and residues of Clenbuterol in veal calves. J Anim Sci,1991,69:4538-4546.
[10] 刘士杰. 盐酸克仑特罗在动物组织中的残留分布及代谢规律. 中国农业科学院硕士学位论文,2006:19-26.
[11] 张建丽,王占良,高照,等.人体食源性盐酸克仑特罗尿样兴奋剂阳性可能性研究. 中国运动医学杂志,2010,29(5):580-583.
[12] Zhang LY,Chang BY,Dong T,et al. Simultaneous determination of salbutamol,ractopamine and clenbuterol in animal feeds by SPE and LC-MS. J Chromatogr Sci,2009:47(4):324-328.
[13] Nunez O,Gallart AH,Martins C,et al. New trend in fast liquid chromatography for food and environment analysis. J Chromatogr A,2012,1228(9):298-323.
[14] 吴银良,刘素英,刘勇军,等. 固相萃取-气相色谱-质谱法测定猪组织中沙丁胺醇残留量. 分析化学,2006,34(S):23-26.
[15] Li G,Ma G. Recent applications of solid-phase extraction techniques for analysis of trace residues and contaminants in food. Se Pu,2011,29(7):606-612.
[16] Zwir FA,Biziuk M. Solid Phase Extraction Technique –Trends,Opportunities and Applications. Polish J of Environ. Stud,2006,15(5):677-690.
[17] Spisso BF,Lopes CC,Marques MA,et al. Determination of β2-agonists in bovine urine: comparison of two extraction/clean -up procedures for high -resolution gas chromatography -mass spectrometry analysis. J Anal Toxicol,2000,24:146-152.
[18] 周小霞,吴永强. 分子印迹聚合物研究进展.四川轻化工学院学报,2002,15(3):44-48.
[19] Barker SA,Long AR,Short CR. Isolation of drug residues from tissues by solid -phase dispersion.J Chromatogr,1989,475:353-361.
[20] Barker SA,Long AR,Hines ME. Disruption and fractionation of biological materials by matrix solid-phase dispersion. J Chromatogr,1993,629:23-34.
[21] Barker SA,Long AR. Preparation of milk samples for immunoassay and liquid chromatographic screening using Matrix solid-phase dispersion. J AOAC Int,1994,77(4):848-854.
[22] Capriotti AL,Cavaliere C,Giansanti P,et al. Recent developments in matrix solid-phase dispersion extraction.J Chromatogr A,2010,1217:2521-2532.
[23] Annette CM,David SH. Immunoaffinity chromatography:an introduction to applications and recent developments.Bioanalysis,2010,2(4):769-790.
[24] Wang GM,Li YM,Li XL,et al. Preparation and Characterization of an Immunoaffinity Column for the Selective Extraction of Salbutamol from Pork Sample. J Chromatogr Sci,2011,49:276-280.
[25] Wang JP,Li XW,Zhang W,et al. Development of immunoaffinity sample-purification for GC–MS analysis of ractopamine in swine tissue. Chromatographia,2006,64(9-10):613-617.
[26] Wang JP,Zhang SX,Shen JZ. A monoclonal antibodybased immunoassay for determination of ractopamine in swine feeds. J ANIM SCI,2006,84:1248-1251.
[27] Kaklamanos G,Theodoridis G,Dabalis T. Gel permeation chromatography clean -up for the determination of gestagens in kidney fat by liquid chromatography–tandem mass spectrometry and validation according to 2002/657/EC . J Chromatogr A,2009,1216:8067-8071.
[28] 卢剑,车文军,张岩,等. 凝胶净化色谱-固相萃取-超快速液相色谱-串联质谱法检测猪肉中9 种β2-受体激动剂激素残留.食品科学,2012,33(24):311-314.
[29] O’Keeffe MJ,O’Keeffe M,Glennon JD,et al. Supercritical fluid extraction of clenbuterol from bovine liver tissue.Analyst,1998,123:2711-2714.
[30] O’Keeffe MJ,O’Keeffe M,Glennon JD,et al. Supercritical fluid extraction (SFE) as a multi -residue extraction procedure for β2-agonists in bovine liver tissue. Analyst,1999,124:1355-1360.
[31] Fente CA,Vázquez BI,Franco C,et al. Determination of clenbuterol residues in bovine hair by using diphasic dialysis and gas chromatography mass spectrometry.J Chromatogr B,1999,726:133-139.
[32] Gonzalez P,Fente CA,Franco C. Determination of residues of the β2-agonist clenbuterol in liver of medicated farm animals by gas chromatography2mass spectrometry using diphasic dialysis as an extraction procedure. J Chromatogr B,1997,693:321-326.
[33] 胥传来. 食品免疫化学与分析. 北京:科学出版社,2009:16-23.
[34] 张苏华,黄士新. 国产“ELISA”试剂盒与同类进口试剂盒的对比试验.上海畜牧兽医通讯,2003,4:20-21.
[35] 陈穗, 何松. 酶联免疫法检测克仑特罗残留量的质量控制.四川食品与发酵,2007,44(1):73-76.
[36] 邓国东,林海丹,陈旭.盐酸克仑特罗ELISA 检测假阳性的原因分析.广东畜牧兽医科技,2006,31(6):47-48.
[37] Babacar N,Yan CG,Xi LW,et al. Development and application of lateral flow test strip technology for detection of infectious agents and chemical contaminants:a review. Anal Bioanal Chem,2010,397(3):1113-1135.
[38] Zhang MZ,Wang MZ,Chen ZL,et al. Development of a colloidal gold-based lateral-flow immunoassay for the rapid simultaneous detection of clenbuterol and ractopamine in swine urine. Anal Bioanal Chem,2009,395(8):2591-2599.
[39] Wang C,Wu J,Zong C,et al.Chemiluminescent Immunoassay and its Applications. Chin J Anal Chem,2012,40 (1):3-10.
[40] Chen LL,Zhang ZJ,Fu AH. Determination of clenbuterol residual in pork by flow injection chemiluminescence immunoassay. Chin J Anal Lab,2011,30 (2):6-8.
[41] 许元红,唐亚军,吴明嘉.毛细管电泳在食品分析中的应用. 分析化学,2005,33(12):1794-1798.
[42] Christian WH,Verena HP,Rania B,et al. Capillary electrophoresis coupled to mass spectrometry for forensic analysis. The Open Chem Eng J ,2007(1):30-43.
[43] Zhou J,Li YH,Liu Q,et al. Capillary electrophoresis of clenbuterol enantiomers and NMR Investigation of the clenbuterol/carboxymethyl -β -cyclo -dextrin complex. J Chromatogr Sci,2013,51(3):237-241.
[44] 颜流水,温振东,井晶,等. 猪肝中克仑特罗和沙丁胺醇的毛细管电泳-质谱联用分析. 分析测试学报,2006,25(6):43-45.
[45] Sara RM,Maria PM,Maria JL,et al. Biosensor for environmental application:Future development trends. Pure Appl. Chem,2004(76):723-752.
[46] Ping LH,Zong YW,Li YZ,et al.Development of a labelfree electrochemical immunosensor based on carbon nanotube for rapid determination of clenbuterol. Food Chemistry,2009,112(3): 707-714.
[47] Wang H,Zhang Y,Li H,et al. A silver-palladium alloy nanoparticle -based electrochemical biosensor for simultaneous detection of ractopamine,clenbuterol and salbutamol . Biosens Bioelectron,2013,49:14-19.
[48] Nikolin B,ImamoviB,Medanhodzi-Vuk S,et al. High perfomance liquid chromatography in pharmaceutical analyses. Bosn J Basic Med Sci,2004,4(2):5-9.
[49] Zhang Q,Liu Y. Optimization of detection of clenbuterol residue in fresh meat by solid phase extraction-HPLC method. Modern Food Sci Technol,2009,25(3):337-340.
[50] 王琦,张笑,邢文,等. 动物性食品中克仑特罗残留量的测定高效液相色谱法方法改进. 中国卫生检验杂志,2011,21(6):1363-1364.
[51] 苗虹,吴永宁,赵京玲,等. 气相色谱-质谱法测定动物性食品及生物材料中的克仑特罗残留. 中国食品卫生杂志,2003,15(1):18-22.
[52] Schanzer W,Geyer H,Gotzmann A,et al. Recent advances in doping analysis(13). Sport und Buch Strau,Kln,2005:469-473.
[53] Wood M,Laloup M,Samyn N,et al. Recent application of liquid chromatography -mass spectrometry in forensic science. J Chromatogr A,2006,1130 (1):3-15.
[54] Vita DS,Giuseppe A,David B,et al. Applications of liquid chromatography -mass spectrometry for food analysis. J Chromatogr A,2012,1259:74-85.
[55] Fan S,Miao H,Zhao YF,et al. Simultaneous Detection of Residues of 25 β2-Agonists and 23 β-Blockers in Animal Foods by High -Performance Liquid Chromatography Coupled with Linear Ion Trap Mass Spectrometry. J Agric Food Chem,2012,60(8):1898-1905.
[56] Lehner AF,Harkins JD,Karpiesiuk W,et al.Clenbuterol in the Horse:Confirmation and Quantitation of Serum Clenbuterol by LC-MS-MS after Oral and Intratracheal Administration. J Anal Toxicol,2001,25:280-287.
[57] 农业部1025 号公告-18-2008 动物源性食品中β2-受体激动剂残留检测-液相色谱-串联质谱法.
[58] 中华人民共和国卫生部, 中国国家标准化管理委员会.GB/T 5009.192–2003 动物性食品中克仑特罗残留量的测定.北京:中国标准出版社,2003:523.
[59] 中华人民共和国国家质量监督检验检疫总局. SN/T 1924-2011. 进出口动物源食品中克仑特罗、 莱克多巴胺、沙丁胺醇、特布他林残留量的检测方法 液相色谱-质谱/质谱法.北京:中国标准出版社,2011:5.
[60] European Food Safety Authority. Safety evaluation of ractopamine scientific opinion of the panel on additives and products or substances used in animal feed. EFSA J,2009,1041:1-52.
[61] 国家质监总局进出口食品安全局. 中华人民共和国WTO/TBT-SPS 通报咨询网 [EB/OL]. (2010-03-19)[2010 -06 -15]. http://www.tbt -sps.gov.cn/jpmrl/MRLS/Pages/MRLSsearch.aspx.
