运动预处理对局灶性缺血再灌注大鼠脑梗死和HIF-1α 基因表达的影响
2014-04-15邓文骞王璐李雪袁琼嘉
邓文骞 王璐 李雪 袁琼嘉
成都体育学院(成都610041)
脑血管病(cerebrovascular disease,CVD)占我国乃至全世界最常见致死和成人残疾原因的第二位[1,2]。其中脑梗死最常见,它由脑血管阻塞性缺血所致,发病率为110/10 万人口, 约占全部脑血管病的60%~80%[3]。如何有效预防脑梗死以及减少血管阻塞后脑梗死的面积,成为预防医学和临床医学的研究热点。
脑缺血预处理 (neuronal ischemic preconditioning,NIPC) 是特异性地对大脑进行一种或多种低于永久性损害的刺激, 从而引发机体内在的神经保护措施, 对于随后更为严重的脑缺血损伤具有保护作用[4]。 运动预处理作为一种特殊形式的缺血缺氧预处理, 对中枢神经系统的保护作用及机制研究尚属起步阶段。我们前期研究发现,运动预处理减少大鼠大脑皮质及海马细胞凋亡, 对力竭运动导致的脑细胞凋亡有一定的保护作用[5,6]。 然而,运动预处理对更严重的脑缺血梗死是否也有保护作用及其相关机 制 尚 不 明 了。 低 氧 诱 导 因 子-1α (hypoxiainducible factor-1α,HIF-1α) 是一种重要的转录因子,因其可诱导血管内皮细胞生长因子(VEGF)、促红细胞生成素(EPO)及一氧化氮合酶(iNOS)等靶基因的转录而成为机体缺血缺氧应答时稳定细胞内环境的调节中心。 本实验采用大鼠脑中动脉阻塞性缺血(MCAO)模型,观察运动预处理对局灶性脑缺血再灌注诱导的大鼠脑梗死体积的影响, 并探讨其相关分子机制。
1 材料与方法
1.1 动物及其分组
4 月龄成年雄性SPF 级SD 大鼠60 只, 体重(325±30)克,购自四川大学华西医学中心实验动物中心,生产许可证编号:SCXK(川)2009-09;使用许可 证 编 号:SYXK (川)2009-045, 动 物 批 号:20111001。 大鼠随机分为缺血再灌注组 (IR 组,n =24)、假手术组(sham 组,n = 12)和运动预处理组(EP组,n = 24)。
1.2 实验方法
IR 组参照改良的Longa[7]大脑中动脉二次线栓法制作脑中动脉缺血再灌注模型。 以10%水合氯醛0.3 ml/kg 腹腔麻醉,颈正中切口,行右侧脑中动脉缺血(MCAO)手术:暴露颈总动脉(CCA)、颈外动脉(ECA)及颈内动脉(ICA),将0.26 mm 单丝尼龙鱼线头端0.5 cm 用石蜡包被, 并于20 mm 长处标记,结扎ECA 远端,用提拉线暂时阻断CCA 及ICA 血流,在结扎线近端距分叉5 mm 处剪一约0.3 mm 小口,全部大鼠均通过右侧CCA 切口处插入,经分叉部进入ICA,栓线长度自CCA 分叉处约18~20 mm,根据动物体重而定,栓塞右侧大脑中动脉(MCA),然后缝合皮肤,栓线尾端部分固定于皮肤上。 缺血达2 h 后小心抽出栓线,即形成再灌注。在缺血期间及再灌注后2 h 保持体温在(37±0.5)℃。动物苏醒后观察其体态及行为, 以大鼠手术麻醉清醒后出现左侧肢体瘫痪、站立不稳、提尾时向一侧转圈为MCAO 模型成功的判断标准。
sham 组行假手术代替缺血再灌注。 不插入尼龙鱼线,其余操作步骤同缺血再灌注组。
EP 组前3 天进行无负重适应性游泳,10 min/d,从第4 天开始进行不负重中等负荷游泳训练,60 min/d,6 d/w,持续4 周;游泳玻璃缸体积为150 cm×60 cm×100 cm,水深> 70 cm,水温(34±2)℃,室温25℃。 大鼠运动后迅速用毛巾擦干皮毛并保暖。 末次运动后24 小时制作缺血再灌注模型,方法同IR 组。
运动造模实验在成都体育学院国家体育总局四川省运动医学重点实验室完成,MCAO 造模、组织病理学实验、 荧光定量PCR 及Western blot 实验均在四川大学生物治疗国家重点实验室医学遗传实验室完成。
1.3 取材
所有大鼠于MCAO 手术后24 h 采用股动脉放血处死, 剪开皮肤暴露头及颈段, 从颈椎处剪断颈髓,分离去除后颈部肌肉,用弯钳仔细剔除颅骨,避免硬脑膜划伤脑组织, 随后从延髓开始慢慢分离颅底组织取下脑。 各组大鼠脑组织随机分为3 小组(sham 组各小组n = 4,IR 组各小组n = 8、EP 组各小组n = 8),有一小组进行TTC 染色计算梗死体积,另一小组进行病理学检测, 最后一小组进行荧光定量RT-PCR 及Western blot 实验, 分别行-20℃冷冻保存、4%中性多聚甲醛固定和液氮保存。
1.4 TTC 染色
将放入-20℃冰箱中的脑组织速冻20 分钟,随后取出切片,每个脑组织切成5 片,每间隔2 mm 切一片,第一刀在脑前极与视交叉连线中点处;第二刀在视交叉部位;第三刀在漏斗柄部位;第四刀在漏斗柄与后叶尾极之间。切片后将组织置于2%TTC 溶液中,用锡箔纸盖住,放入37℃温箱25 min,每隔5 分钟翻动脑片,使其均匀接触到染色液。然后用10%甲醛溶液固定,过夜,采用病理图像分析仪测量脑梗死面积,根据梯形法则计算脑梗死体积[8]。
1.5 免疫组化染色
取出多聚甲醛固定标本, 常规石蜡包埋并制成5 mm 切片,每个脑标本取3 张切片,脱蜡至水,梯度酒精脱水,3%H2O2及正常血清处理后, 加入抗鼠HIF-1α 单克隆抗体 (美国Santa Cruz 公司),4℃过夜后,依次滴加山羊抗鼠二抗IgG(美国Cell Signal公司)及SP(工作浓度1∶200),37℃各孵育60 min,DAB 显色,苏木素复染,梯度酒精脱水,二甲苯透明,封片。 以PBS 代替一抗作为空白对照。 采用计算机图像采集分析系统 (美国Nikon & SPO, 软件为Version3.0)采集图像,采用Image Pro-Plus 图像分析软件定量分析蛋白表达。 分析每张切片随机选取10个高倍视野的图像,各组所选部位相同。
1.6 荧光定量RT-PCR 检测
取部分液氮保存脑组织,按50~100 mg/mlTrizol剂量加入Trizol 提取总RNA。 采用紫外分光光度计测定RNA 含量、 纯度; 采用TaKaRa Prime ScriptTMReagent Kit(大连宝生物)逆转录试剂盒进行逆转录得 到cDNA; 采 用TaKaRa SYBR Premix Dimer EraserTM(大连宝生物)进行Real-time PCR。 引物序列:HIF -1α ( 扩 增 长 度 234 bp) 上 游:5′ -CGGCGGCGAGAACGAGAAGAAAAAG-3′, 下游:5′-TTCTCACACGTAAATAACTGATGGT -3′ ;β -actin(扩增长度99 bp)上游:5′-CGT AAA GAC CTC TAT GCC AAC A-3′,下游:5′-TAG GAG CCA GGG CAG TAA TC-3′。 反应结束后,分析PCR 产物融解曲线,确定反应的特异性,并根据各样本Ct 值进行数据处理。 根据RT-PCR 仪给出各反应孔的Ct 值, 以βactin 基因为内参, 按照公式ΔΔCt =(待测样品目的基因平均Ct 值-待测样品管家基因平均Ct 值)-(基准样品目的基因平均Ct 值-基准样品管家基因平均Ct 值)计算出ΔΔCt 值,各组样本HIF-1α 基因的相对表达水平=2-ΔΔCt。
1.7 Western blot 检测
从液氮中取出脑组织, 标本放入预冷研钵充分短时研磨,按500 μl/100mg 标准加入蛋白裂解液至研钵冲洗研磨好的组织,充分混匀后将悬液放入EP管中,蛋白裂解液购自北京百泰克生物试剂公司,使用前加蛋白酶抑制剂:PMSF[174 mg/10ml(异丙醇)]1%;Leupeptin(1 mg/ml)1/500;Pepstatin A(5 mg/ml)1/1000。 将悬液放在冰上冰浴20 min, 确保裂解充分,随后14000 r/min、4℃离心20 min,收集上清,即大鼠脑组织总蛋白。 采用BCA 蛋白定量试剂盒(购自武汉博士德生物工程有限公司) 定量检测各标本总蛋白。 各标本取20 μg 总蛋白加入上样缓冲液后于热板上煮10 分钟,随后进行SDS-PAGE 电泳,电泳后转至PVDF 膜,X 线胶片曝光进行免疫印记信号检测。 Western-blot 所用抗体同免疫组化实验抗体。 电泳结果采用Quantity One 图像分析软件进行定量分析。
1.8 统计学分析
采用SPSS17.0 进行统计学分析。 实验结果均以“均数±标准差” 表示, 组间差异采用t 检验两两比较,P < 0.05 表示差异具有统计学意义。
2 结果
2.1 TTC 染色结果
TTC 染色后,正常脑组织呈砖红色,而缺血梗死区为苍白色,与正常组织边界清晰,显示出明显的梗死区域。IR 组大鼠脑组织梗死体积较大;EP 组大鼠脑梗死体积较IR 组明显缩小,有显著性差异(P <0.05);sham 组未见梗死灶形成(见表1,图1)。

表1 各组大鼠MCAO 脑梗死体积比较
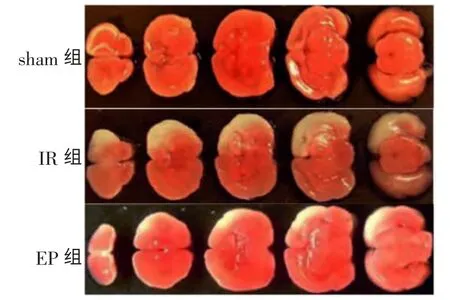
图1 各组大鼠MCAO 大脑TTC 染色结果
2.2 HIF-1α 免疫组化结果
sham 组偶见HIF-1α 表达,但因表达量少,无法进行图像数据分析。 IR 组和EP 组均可见较多的HIF-1α 阳性表达细胞,光镜下胞核呈黄褐色,也有部分为胞浆阳性,在脑组织大部分区域有表达,图像分析显示EP 组HIF-1α 表达强于IR 组, 差异有统计学意义(P < 0.01,见表2,图2)。

图2 各组大鼠脑组织HIF-1α 免疫组化结果(×200,×400)

表2 各组大鼠脑组织免疫组化检测HIF-1α 表达结果
2.3 HIF-1α 荧光定量RT-PCR 检测结果
各组标本HIF-1α 及β-actin 扩增融解曲线均只有一个峰,表明引物特异性好,无引物二聚体和非特异性扩增发生。表3 结果显示,IR 组和EP 组HIF-1α 基因表达水平较sham 组均明显升高(P < 0.05),而EP 组HIF-1α 基因表达水平高于IR 组, 差异具有显著性(P < 0.05)。

表3 各组大鼠脑组织荧光定量RT-PCR 检测HIF-1α 表达结果
2.4 HIF-1α 蛋白Western blot 检测结果
从图3 可以看出,IR 组和EP 组大鼠脑组织HIF-1α 蛋白表达水平均较sham 组明显上调,EP 组升高幅度大于IR 组。图像分析软件测得各条带灰度值比较见表4。
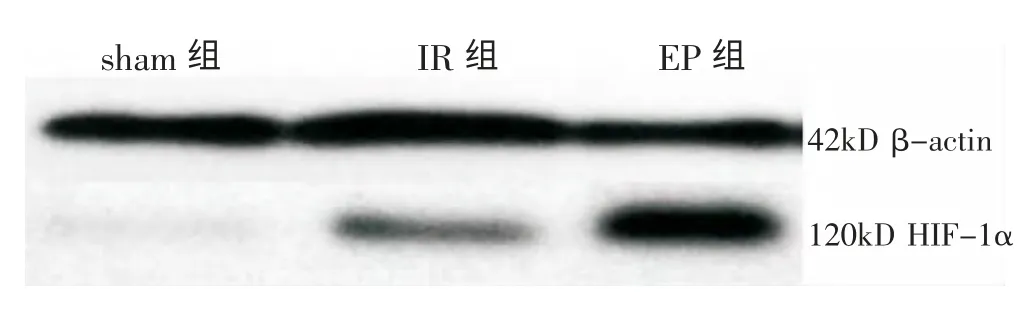
图3 各组大鼠脑组织HIF-1α 蛋白Western blot 检测结果

表4 各组大鼠脑组织HIF-1α 蛋白Western blot 条带灰度值比较
3 讨论
脑梗死是脑血管阻塞造成脑细胞缺血缺氧所致的一类严重的脑血管病。 虽然哺乳动物对大脑缺血缺氧高度敏感,但大量研究表明,哺乳动物大脑具有独特的适应能力,即脑缺血预适应。 非致死性血管阻塞诱导脑产生缺血耐受,在脑严重缺血缺氧状态下产生强大的神经保护作用及其相关机制已有大量报道[9-11],结果均证实脑缺血预处理对大脑产生了明显的保护作用。
运动预处理作为一种特殊的脑缺血缺氧预处理形式,对重要器官如心脏、脑产生的影响受到广泛关注。Ding 等[12]发现,前期持续3 周的运动预处理能改善卒中后大鼠脑微血管完整性,这与Kang 等[13]的研究相符。 Curry 等[14]也报道,持续3 周的跑台运动抑制了大鼠脑梗后的炎症反应。 本实验结果也显示,4周运动训练后,大鼠再发生局灶性脑缺血再灌注,其脑梗死体积较未进行运动预处理的IR 组明显减小,表明4 周中等负荷游泳运动在一定程度上抵抗严重缺血缺氧,对阻塞性脑梗死产生保护作用。
低氧诱导因子(hypoxia-inducible factor,HIF)是在1992 年由Semenza 等[15]首 先在Hep3B 细胞中发现的。 HIF-1α 是HIF 的亚单位,其在机体抵抗缺血缺氧方面发挥重要作用[16]。 研究发现运动刺激同样能够影响HIF-1α 表达,范锦勤等[17]研究发现单纯训练刺激会引起大鼠脑组织HIF-1α 升高。 徐建方等[18]发现训练和低氧均能显著提高肝组织HIF-1α表达。 本研究中,大脑局灶性缺血2 小时再灌注后,EP 组和IR 组大鼠大脑HIF-1α mRNA 水平和蛋白水平均较sham 组升高,表明急性缺血缺氧激活脑神经细胞HIF-1α 基因表达, 使细胞处于一种特殊的代谢状态,对抗剧烈的能量缺失刺激。 而EP 组在进行了为期4 周的中等负荷运动后,免疫组化、荧光定量RT-PCR 和Western blot 结果显示,无论在基因转录水平还是在蛋白表达水平, 其HIF-1α 均明显高于未进行预处理的IR 组, 表明运动作为一种特殊的、轻微的脑缺氧缺血刺激,促进了HIF-1α 表达,调动机体的自我保护机制, 使脑细胞产生了一定的缺氧耐受,从而抵抗更严重的缺血缺氧刺激。
关于预处理与缺血事件之间的间隔, 有研究发现, 脑缺血预处理产生快速耐受和延迟耐受两种作用[19,20]。 本研究采用4 周运动预处理结束后24 小时进行大脑局灶性缺血再灌注, 主要考虑到虽然中等负荷运动造成的大鼠脑缺血缺氧刺激不大, 但持续时间较长, 很可能造成体内尤其是缺血缺氧较明显的器官细胞内某些蛋白质表达发生变化, 而这些蛋白可能参与到产生延迟耐受保护的过程中。 实验结果也显示,运动预处理确实对24 h 后的局灶性脑缺血梗死产生了保护作用。在接下来的研究中,我们将重点考虑运动预处理是否产生快速耐受以及对比两种耐受保护效果。 此外,由于HIF-1α 基因调节的下游因子种类繁多,功能复杂,具体是通过哪些信号通路产生保护作用,仍有待于研究。
4 总结
本研究结果表明,4 周中等负荷运动预处理减少局灶性缺血引起的大鼠大脑梗死体积, 可能通过上调HIF-1α 表达产生作用。
[1] Bonita R,Mendis S,Truelsen T,et al. The global stroke initiative. Lancet Neurol,2004,3(7):391-393.
[2] 卫生部. 中国卫生统计年鉴,2006:45.
[3] 饶明俐,王志文,黄如训,等. 中国脑血管病防治指南(试行版). 卫生部疾病控制司、 中华医学会神经病学分会,2005:30.
[4] Nandagopal K,Dawson TM,Dawson VL. Critical role for nitric oxide signaling in cardiac and neuronal ischemic preconditioning and tolerance. J Pharmacol Exp Ther,2001,297(2):474-478.
[5] 王璐, 袁琼嘉. 运动预处理对力竭运动诱导的大鼠海马细胞凋亡的影响. 体育科学,2009,29(3):52-57.
[6] 王璐,邓文骞,袁琼嘉.运动预处理对力竭运动诱导的大鼠大脑皮质细胞凋亡的影响. 中国运动医学杂志,2012,31(7):602-606,622.
[7] Longa EZ,Weinstein PR,Carlson S,et al.Rebersible middle cerebral artery occlusion without craniectomy in rats.Stroke,1989,20(2):84-91.
[8] Yin D,Zhou C,Kusaka I,et al. Inhibition of apoptosis by hyperbaric oxygen in a rat focal cerebral ischemic model. J Cereb Blood Flow Metab,2003,23(2):855-864.
[9] Ebrahimi SM,Aboutaleb N,Nobakht M. Consequences of ischemic preconditioning of kidney:Comparing between male and female rats. Iran J Basic Med Sci,2012,15 (6):1148-1153.
[10] Fang B,Li XM,Sun XJ,et al. Ischemic preconditioning protects against spinal cord ischemia-reperfusion injury in rabbits by attenuating blood spinal cord barrier disruption.Int J Mol Sci,2013,14(5):10343-10354
[11] Narayanan SV,Dave KR,Perez -Pinzon MA. Ischemic preconditioning and clinical scenarios. Curr Opin Neurol,2013,26(1):1-7.
[12] Ding YH,Ding Y,Li J,et al. Exercise pre-conditioning strengthens brain microvascular integrity in a rat stroke model. Neurol Res,2006,28(2):184-9.
[13] Kang KA,Seong H,Jin HB,et al. The effect of treadmill exercise on ischemic neuronal injury in the stroke animal model: potentiation of cerebral vascular integrity. J Korean Acad Nurs,2011,41(2):197-203.
[14] Curry A,Guo M,Patel R,et al. Exercise pre-conditioning reduces brain inflammation in stroke via tumor necrosis factor-alpha,extracellular signal-regulated kinase 1/2 and matrix metalloproteinase-9 activity. Neurol Res,2010,32(7):756-762.
[15] Semenza GL,Wang GL. A nuclear factor induced by hypoxia via de novo protein synthesis binds to the human erythropoietin gene enhancer at a site required for transcriptional activation. Mol Cell Biol,1992,12 (12):5447-5454.
[16] Gidday JM. Cerebral preconditioning and ischemic tolerance. Nat Rev Neuro Sci,2006,7(6):437-448.
[17] 范锦勤,林文弢,翁锡全. 低氧训练对大鼠脑组织Ngb、HIF-1α、Bax 和Bcl-2 的影响. 体育学刊,2012,19(1):129-133.
[18] 徐建方,冯连世,路瑛丽,等. 不同模式低氧耐力训练对大鼠肝组织HIF-1α、HO-1 mRNA 表达的影响. 中国体育科技,2011,47(1):126-129,136.
[19] Lin WY,Chang YC,Lee HT,et al. CREB activation in the rapid, intermediate, and delayed ischemic preconditioning against hypoxic-ischemia in neonatal rat. J Neurochem,2009,108(4):847-859.
[20] Zhang J,Yang ZJ,Klaus JA,et al. Delayed tolerance with repetitive transient focal ischemic preconditioning in the mouse. Stroke,2008,39(3):967-974.
