欧洲花楸的离体培养与快繁体系建立
2014-04-14马盈兰士波李红艳
马盈,兰士波,李红艳
(黑龙江省林业科学研究所,哈尔滨 150081)
欧洲花楸的离体培养与快繁体系建立
马盈,兰士波,李红艳
(黑龙江省林业科学研究所,哈尔滨 150081)
选用欧洲花楸叶片、腋芽作为外植体进行诱导试验,确定腋芽为诱导培养的外植体。通过正交试验筛选出诱导培养、增殖培养和生根培养的最佳培养基,从而建立了一套“初代培养——继代培养——生根培养”的无性繁殖体系。
欧洲花楸;离体培养;正交试验;快繁体系
欧洲花楸(Sorbus aucuparia),系蔷薇科花楸属落叶灌木或小乔木,原产欧洲和亚洲西部。欧洲花楸为喜光和半耐阴先锋树种,耐旱、耐寒,喜湿润的酸性或微酸性土壤。欧洲花楸在欧洲已被广泛应用于园林绿化中,如在芬兰它是重要的行道树之一[1]。欧洲花楸具有四季皆宜的观赏效果,是集观赏花、叶、果等价值于一身的珍贵花木,可作庭院、公园、广场、小区绿化;它的叶子具有通便、祛痰功效,果实具有收敛利尿和抗坏血症的药用功效外,还可用于加工食品、饮料、酒及药品,开发前景十分广阔。总之,欧洲花楸是集园林树种、经济林树种和生态树种于一身的优良品种。
良种繁育方式包括有性繁殖和无性繁殖。欧洲花楸属于高位芽植物,完全靠种子繁殖。由于该种种子呈深度和绝对休眠状态,所以需要一定的低温层积催芽处理,以克服来自种和胚的休眠[2]。而扦插繁殖存在插穗不足,且生根率较低。这两种方法都不能进行大批量的生产,不能满足苗木市场的需求。植物的组织培养是利用细胞全能性,除具备常规营养繁殖的优点外,还具有繁殖速度快、不受季节影响等优点,而且采用腋芽增殖进行快繁体系的建立可以保持品种的优良性状。本项目拟通过试验研究建立欧洲花楸组织培养快繁体系,为其进一步引种栽培和开发利用提供技术参考。
1 材料与方法
1.1 试验材料及消毒处理
2007年1月4日在黑龙江省森林植物园引种栽培的欧洲花楸植株上剪取当年生带休眠芽枝条,放置于常温室内进行水培,萌动后剪取展开的叶片和带侧芽的茎段做为试验材料。
将试验材料放入洗洁精溶液(洗洁精:水=500∶1)中,搅拌洗涤之后用清水冲洗干净。在无菌环境下首先用75%的酒精溶液消毒20 s,再用0.1%的HgCl溶液灭菌3~5 min,无菌水漂洗4~5次,最后在无菌水中浸泡40 min左右,取出后,用无菌滤纸吸干灭菌材料表面水分待用。
1.2 初代与诱导培养
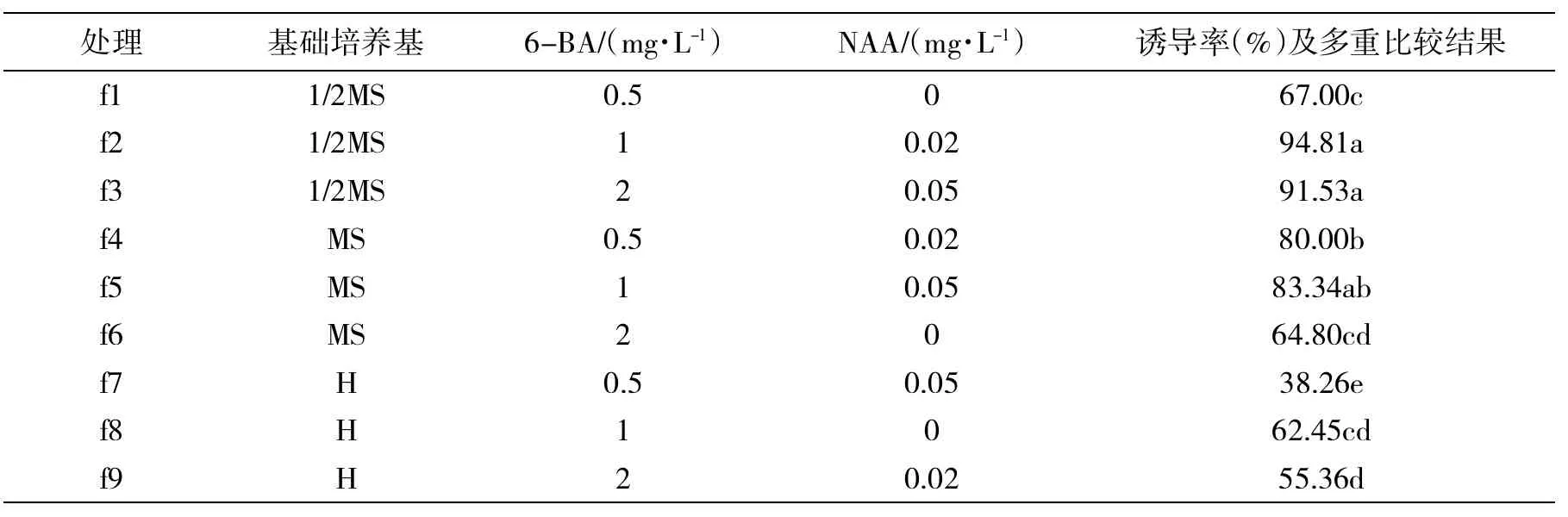
表1 正交实验设计表、诱导率及多重比较结果
通过3因子3水平正交试验法L9(34)设计9个培养基组合(见表1)。将外植体接于9种培养基上,每瓶3个,每种培养基组合接5瓶,重复3次。培养温度20~26℃,光照时间12 h/d,光强2 000 lx。观察芽诱导情况,20 d后统计分化率和苗高。通过正交设计分析数据,筛选出最佳培养基。
1.3 继代与增殖培养
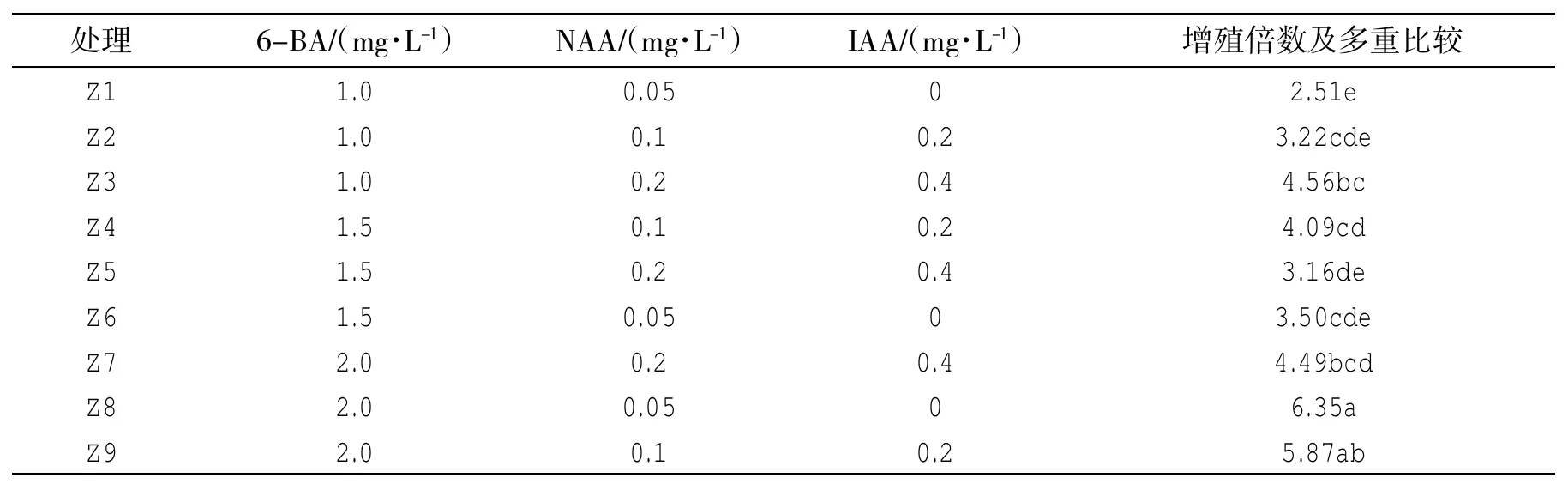
表2 正交实验设计表、增殖倍数及多重比较结果
以MS为基础培养基,并加入2%的琼脂和3%的蔗糖。选6-BA(1.0、1.5、2.0 mg/L)、NAA(0.1、0.3、0.6 mg/L)、IAA(0.2、0.4、0.8 mg/L)3种激素,选用正交设计L9(34)方法(见表2)。将初代培养生长30 d后的欧洲花楸单节切段,植入9种培养基中。每瓶植入3~4个外植体,每种培养基接种3~4瓶,重复3次。接种20 d后观察材料生长状况,统计其增殖倍数。
1.4 生根培养
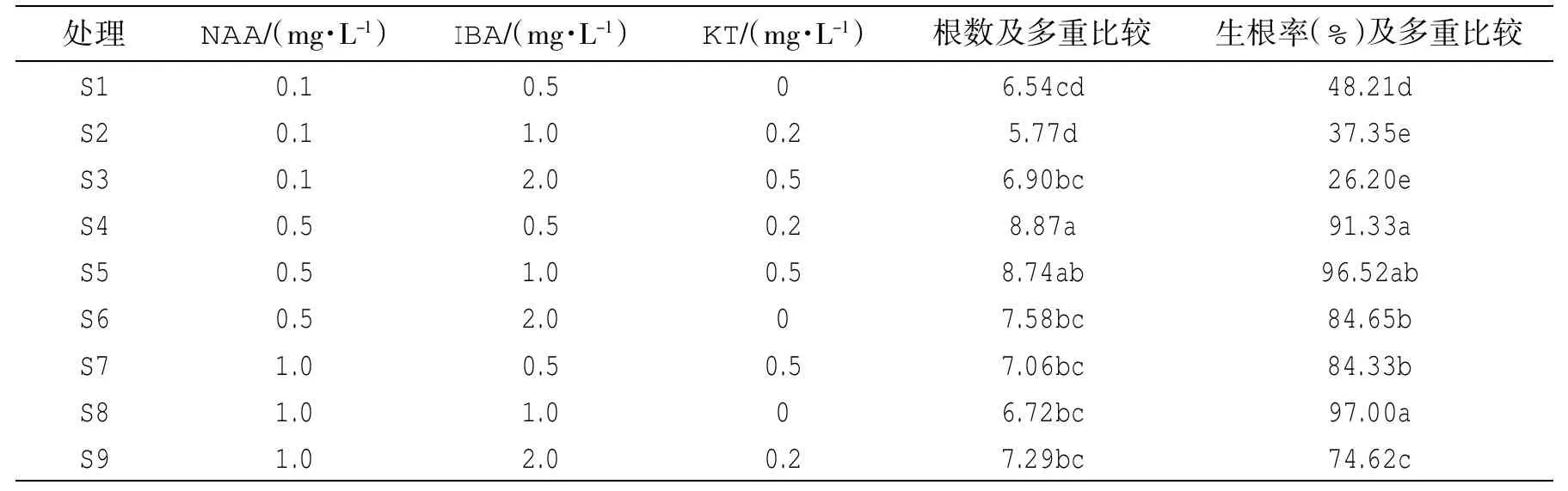
表3 正交实验设计表及生根系数多重比较
生根培养基中,MS为基本培养基,附加激素为KT(0.5、1.0、2.0 mg/L)、NAA(0.1、0.5、1.0 mg/L)和IBA(0、0.5、1.0 mg/L)3种,将试管苗分成每段约2.0~3.0 cm后分别植入添加不同浓度的L9(34)的9种生根培养基中(见表3),观察幼苗生根情况及其生根数量。
1.5 数据分析
采用方差分析和差异显著性测验(SSR法),对欧洲花楸腋芽增殖倍数、幼苗生根数和生根率等指标进行分析。
2 结果与分析
2.1 叶片、腋芽分化能力比较
将叶片、腋芽植入相同培养基中观察其诱导分化状况得出:腋芽分化能力明显强于叶片,叶片植入两周出现愈伤组织,三周后没有出现再分化;而腋芽植入一周开始萌动,两周已有幼芽分化,一个月的生长高度约为2.0~3.5 cm。
2.2 腋芽诱导培养基的筛选
通过试验确定基础培养基诱导次序为1/2MS>MS>H。通过对基础培养基、6-BA及NAA3个因素的方差分析,对欧洲花楸腋芽诱导率顺序为基本培养基>6-BA>NAA。分析结果表明:3种因素均为影响分化率的主导因子,达到了极显著水平(P=0.000 1)。由表1可知,f2与f3培养基分化效果最好,且差异不显著。但通过对试管苗的观察,f3中的幼苗存在玻璃化现象,而f2中的幼苗粗壮,生长势强。因此筛选f2(1/2MS+6-BA1.0 mg/L+NAA0.02 mg/L)为最佳诱导培养基,诱导率可达94.81%。
2.3 幼苗增殖培养基的筛选
选取MS为基本培养基,选择激素6-BA、NAA和IAA3种,将试管苗剪为2.0 cm左右,将其植入不同激素配比的培养基中,两周后统计的增殖倍数并进行方差分析并利用SSR法多重比较。由表2可知:以Z3培养基中的幼苗增殖倍数最高,达到6.35倍,确定细胞分裂素6-BA为影响欧洲花楸芽增殖生长的重要因子,最佳浓度为2.0 mg/L。因此筛选出欧洲花楸最佳增殖培养基为Z3:MS+BA2.0 mg/L+ NAA0.05 mg/L,每周增殖系数为4.16。
2.4 幼苗生根培养基的筛选
将增殖培养的试管苗植入9种生根培养基中,两周后调查试管苗的生根数量并观察根系茁壮度及其长度,通过正交设计进行方差分析,3种激素影响力为IBA>NAA>KT,影响生根的主要因子为IBA和NAA。通过对生根数量和生根率的多重比较得出结论(表3):S5、S6培养基中的试管苗生根数量较多,两者差异不显著;培养基S4、S5、S8生根率较高,一周左右出现根系生长,两周左右根系长度可达1.0~2.0 cm,两者间差异并不显著。综上所述,确定生根数量多且根系茁壮的最佳生根培养基为S5(MS+ NAA0.1 mg/L+IBA0.5 mg/L),根系数量为8.74条,生根率为96.52%。
3 结论与讨论
(1)离体无性系快速繁殖是植物组织培养技术应用最广泛的方向之一,离体培养的成功与否主要取决于外植体、基础培养基、外源激素培养基以及生长条件等多种因素。在欧洲花楸离体培养中,确定以腋芽为外植体效果好于叶片,叶片诱导分化后只有愈伤组织分化,未有器官形成。有研究显示:通过愈伤组织分化形成的再生植株的严重缺点是遗传性不稳定,易产生变异[3]。而且选择适当的外植体可以减少褐变的发生。综上所述,确定欧洲花楸腋芽为外植体进行组织培养快速繁殖体系的建立。
(2)外源激素可以诱导出愈伤组织、胚状体、不定芽、根等器官,最终获得再生植株或次生物质[4]。6-BA是一种活性较强的细胞分裂素,主要功能为促进细胞分裂和芽的形成。如在本实验腋芽分化诱导中,以f2(1/2MS+6-BA 1.0 mg/L+NAA 0.02)为最佳培养基,诱导率为94.81%;在继代增殖培养中,以Z3(MS+BA2.0 mg/L+NAA0.05 mg/L)为最佳培养基,每周增殖系数为4.16;在生根培养中,确定最佳生根培养基为S5(MS+NAA0.1 mg/L+IBA0.5 mg/ L),根系数量为8.74条,生根率为96.52%。
(3)在本研究中f3(1/2MS+6-BA2.0 mg/L+NAA 0.05 mg/L)中幼苗有明显玻璃化现象,而玻璃化的发生是“生长因子不平衡的产物”、是培养物“中毒”,不能很好适应培养基和培养环境的结果。增加琼脂浓度,适当提高培养基中蔗糖含量、适当降低培养基中NH+4浓度,改善培养器内温度、湿度及光照都是减少玻璃化发生的方法[5]。
[1]周丹,宿宗艳,李文娟,李长海.欧洲花楸应用价值的探讨[J].中国林副特产,2007,10(5):83-84.
[2]田艳丽,郑国庆,徐娟,李长海.欧洲花楸有性繁殖试验[J].陕西林业科技,2009,2:15-16.
[3]郑玉梅,刘青林.木本观赏植物离体快速繁殖技术的进展[J].北京林业大学学报,2001,23(增刊):75-82
[4]韩磊,汪东旭等.植物组织培养技术及其应用研究进展[J].种子(Seed),2005,24(1):38-43.
[5]杨丽琴,李瑞,王俊,等.植物组织培养的三大难题[J].北方园艺,2008(4):104-107
(责任编辑:杨婷婷)
Isolated Culture and Establishment of a Rapid Propagation System for Sorbus aucuparia
MA Ying,LAN Shibo,LI Hongyan
(Forestry Research Institute of Heilongjiang Province,Harbin 150081,China)
In this paper the leaves and axillary buds of Sorbus aucuparia were used as explants for induction tests and the axillary buds were used as explants for induction culture.The best culture media for induction culture,multiplication culture and rooting culture were screened out by orthogonal tests,and a asexual propagation system of“primary culture-subculture -rooting culture”was established
Sorbus aucuparia;Isolated culture;Orthogonal tests;Rapid propagation
S792.25
:A
:2095-0152(2014)01-0030-03
2014-01-08
2014-01-11
马盈(1981-),女,助理研究员,硕士,研究方向为林木遗传育种。E-mail:191008853@qq.com
