猪繁殖与呼吸综合征病毒基因工程双标记疫苗rHN4-△25+NP49株最小免疫剂量的测定
2014-04-13姜一峰周艳君虞凌雪夏天奇李丽薇童光志
姜一峰,周艳君,童 武,虞凌雪,程 群,杨 莘,夏天奇,李丽薇,高 飞,童光志
(中国农业科学院上海兽医研究所,上海 200241)
猪繁殖与呼吸综合征病毒基因工程双标记疫苗rHN4-△25+NP49株最小免疫剂量的测定
姜一峰,周艳君,童 武,虞凌雪,程 群,杨 莘,夏天奇,李丽薇,高 飞,童光志
(中国农业科学院上海兽医研究所,上海 200241)
将35头40日龄猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus, PRRSV)、猪瘟病毒(Classical swine fever virus,CSFV)、猪圆环病毒(Porcine circovirus type 2,PCV2)抗原及抗体均为阴性的健康仔猪,随机分成7组,每组5头,命名为XJ1~XJ7组。XJ1~XJ6组分别免疫PRRSV基因工程双标记疫苗rHN4-△25+NP49株,接种剂量分别为102TCID50/头、103TCID50/头、104TCID50/头、105TCID50/头、106TCID50/头和107TCID50/头,XJ7组为对照组,按1mL/头剂量接种DMEM。各试验组在免疫后28 d,用3×104.0TCID50/头剂量感染HP-PRRSV HuN4第5代强毒,疫苗免疫和攻毒后观察和检测各组试验猪的免疫效果。结果表明:攻毒前XJ2-XJ6组 PRRSV ELISA抗体在免疫后14 d全部转为阳性,XJ1组在免疫后21 d转为阳性,但维持在较低水平;XJ2-XJ6组针对标记基因NP49的特异性抗体在免疫后28 d转阳性。攻毒后对照组全部发病,且死亡2头,XJ1有4头发病,XJ2-XJ6组无发病和死亡,本研究结果表明PRRSV基因工程双标记疫苗rHN4-△25+NP49株对仔猪提供免疫保护的最小免疫剂量为103TCID50/头。
猪繁殖与呼吸综合征病毒;基因工程双标记疫苗;最小免疫剂量
猪繁殖和呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的一种以仔猪呼吸道症状和母猪繁殖障碍为特征的传染病,给世界养猪业造成了巨大的损失。PRRSV是单股正链RNA病毒,属尼多病毒目、动脉炎病毒科、动脉炎病毒属,与其同属的还有马动脉炎病毒(Equine arteritis virus,EAV),鼠乳酸脱氢酶增高症病毒(Lactate dehydrogenase elevating virus,LDV)和猴出血热病毒(Simian hemorrhagic fever virus, SHFV)[1,2]。PRRSV基因组全长约15 kb,编码13个非结构蛋白和8个结构蛋白,5'端有帽子结构,3'端有polyA尾[3-5]。
2006年以来,我国发生了以高热、高死亡率和传播迅速为特征的由高致病性猪繁殖和呼吸综合征病毒(Highly pathogenic Porcine reproductive and respiratory syndrome virus,HP-PRRSV)引起的高致病性猪繁殖和呼吸综合征,给养猪业造成了巨大损失,目前HP-PRRSV已经成为我国主要流行株[6-9]。尽管针对HP-PRRSV的疫苗已经投入使用,使疾病得到了一定程度的控制,但由于现有的疫苗均无法从血清学上对野毒株和疫苗株进行区分,给该病的防控和净化造成了巨大的困难,研制能够在血清学上区分疫苗毒和野毒的标记疫苗将对PRRS的防控和净化产生巨大的推动作用[10-12]。基于此本研究室在HuN4-F112反向遗传操作操作平台的基础上,构建并获得了PRRSV基因工程双标记疫苗rHN4-△25+NP49株,并通过免疫试验证实该标记疫苗对HP-PRRSV攻击具有较好的免疫保护效果[13-15],为了进一步评价该基因 标记疫苗对仔猪的免疫剂量,本研究将PRRSV基因工程双标记疫苗rHN4-△25+NP49株分别以不同剂量免疫试验仔猪,进行了最小免疫剂量的测定。
1 材料方法
1.1 毒株及细胞PRRSV基因工程双标记疫苗毒rHN4-△25+NP49株由上海兽医研究所猪病研究室制备并保存;Marc-145细胞由上海兽医研究所猪病研究室保存。
1.2 试验猪及检测试剂35头40日龄PRRSV、抗原、抗体阴性的健康仔猪购自广东大华农猪场;PRRSV抗体检测试剂盒购自IDEXX公司;NP49多肽由吉尔生化上海有限合成。
1.3 动物试验将35头40日龄PRRSV、CSFV、PCV2抗原、抗体阴性的健康仔猪随机分成7组,依次命名为XJ1~XJ7组,每组5头。XJ1~XJ6组分别免疫PRRSV基因工程双标记疫苗rHN4-△25+NP49株,接种剂量分别为102TCID50/头、103TCID50/头、104TCID50/头、105TCID50/头、106TCID50/头和107TCID50/头,XJ7组为对照组,按1 mL/头剂量接种DMEM。免疫后28 d,所有猪按3×104.0TCID50/头剂量感染HP-PRRSV HuN4第5代强毒,观察临床表现(体温、呼吸症状、食欲、生长状态和神经症状等)。分别在免疫后0、3、7、14、21、28 d,以及攻毒后3、7、14、21、28 d采集血液并分离血清。攻毒后28 d剖杀剩余试验猪,进行组织病理学观察。
1.4 PRRSV ELISA抗体检测将不同时间点采集的猪血清,按IDEXX公司 Herd Check PRRS X3抗体检测试剂盒说明检测针对PRRSV的特异性抗体变化。
1.5 NP49-ELISA抗体检测将采集的猪血清1∶40倍稀释后,按孙晶等[16]建立的方法,检测NP-49特异性抗体水平。
1.6 病毒分离将攻毒后不同时间采集的猪血液经双抗(100 μg /mL的青霉素和100μg mL的链霉素)处理后,接种在Marc-145细胞上,按文献[10]进行病毒分离。
1.7 组织病理学观察剖取试验猪的肺、肾、脾以及腹股沟淋巴结等组织,用含10%甲醛溶液固定后,按文献[17]进行组织病理切片的制作和观察。
2 结果
2.1 临床症状各标记疫苗免疫组的试验猪在接种疫苗后均无过敏反应,接种部位无炎性反应。疫苗接种后除个别仔猪出现一过性的发热和厌食外,其余试验猪均无异常表现。攻毒后,XJ1组猪攻毒后有3头猪体温升高超过40.5℃,累计3~7 d,之后趋于正常(图1),部分猪出现厌食、精神沉郁现象,无仔猪死亡。XJ2~XJ6组攻毒后体温仅个别猪出现一过性体温升高,随后迅速转为正常。XJ7组试验猪攻毒后体温升高均超过40.5℃以上,持续3~10 d,伴有厌食、嗜睡、被毛逆立、精神沉郁以及后肢不能站立等临床症状,最终有2头猪死亡,详见表1。
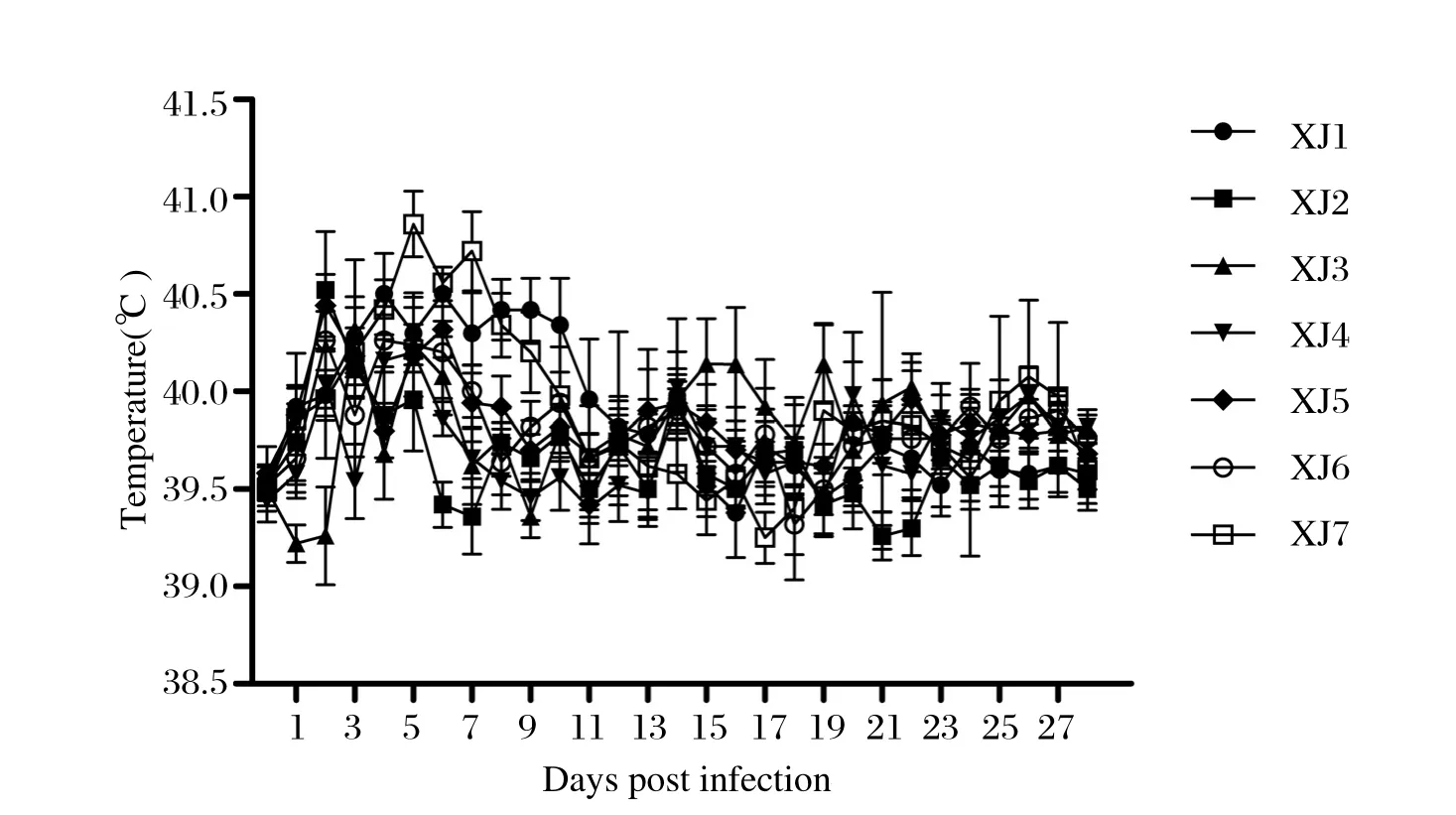
图1 PRRSV基因工程双标记疫苗(rHN4-△25+NP49株)不同接种剂量组攻毒后仔猪体温变化Fig. 1 Mean rectal temperature of piglets after challenge with rHN4-△25+NP49 strain at different dosage
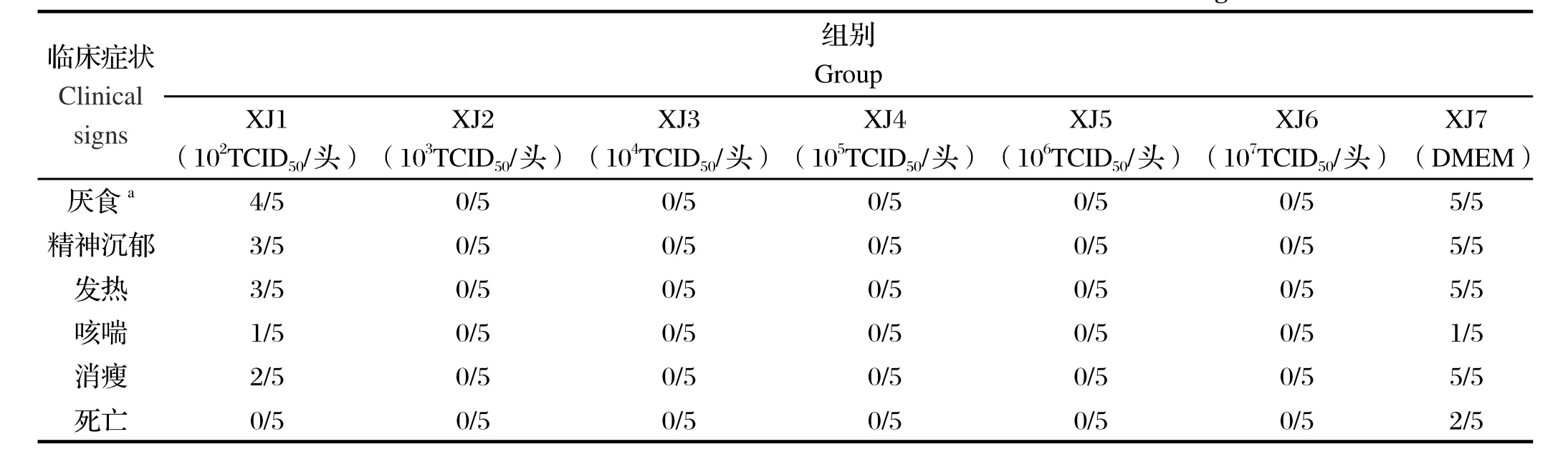
表1 不同剂量组免疫攻毒后临床表现统计结果Table 1 Protection eff cacy of rHN4-△25+NP49 strain at different dosage
2.2 PRRSV抗体变化PRRSV ELISA抗体检测结果显示XJ2~XJ6组免疫后14 d即可检出到针对PRRSV的特异性抗体,XJ1组抗体出现较晚,在免疫后21 d才能够检测到针对PRRSV的抗体。XJ7组免疫后各时间点PRRSV抗体均为阴性,攻毒后各组猪针对PRRSV的抗体均迅速升高(图2)。
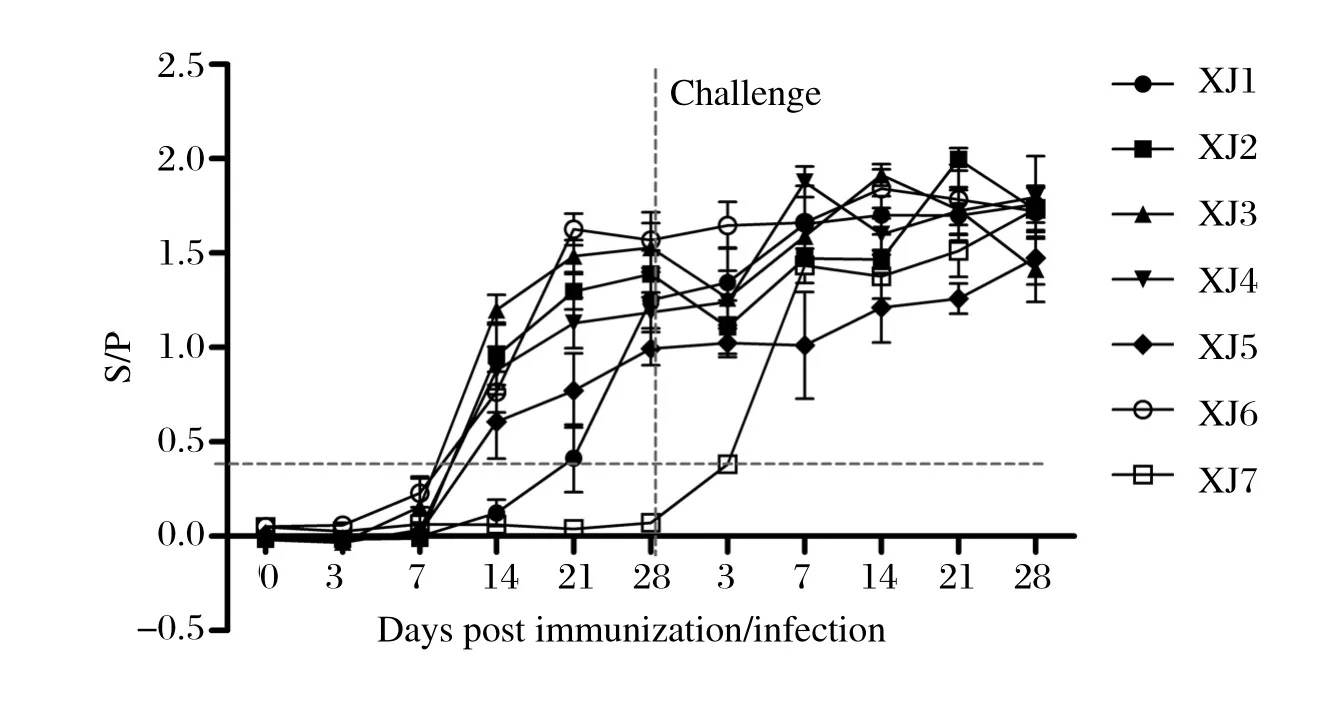
图2 免疫及攻毒后各组猪血清中针对PRRSV抗体变化情况Fig. 2 PRRSV specific antibody responses in piglets of different groups before and after challenge
2.3 NP49-ELISA抗体检测结果XJ2~XJ6组在免疫28 d后能够检测到针对NP49的特异性抗体,XJ1组在免疫后42 d才能够检测出针对NP49的抗体,而XJ7组至试验结束均无法检测到针对NP49特异性抗体(图3)。
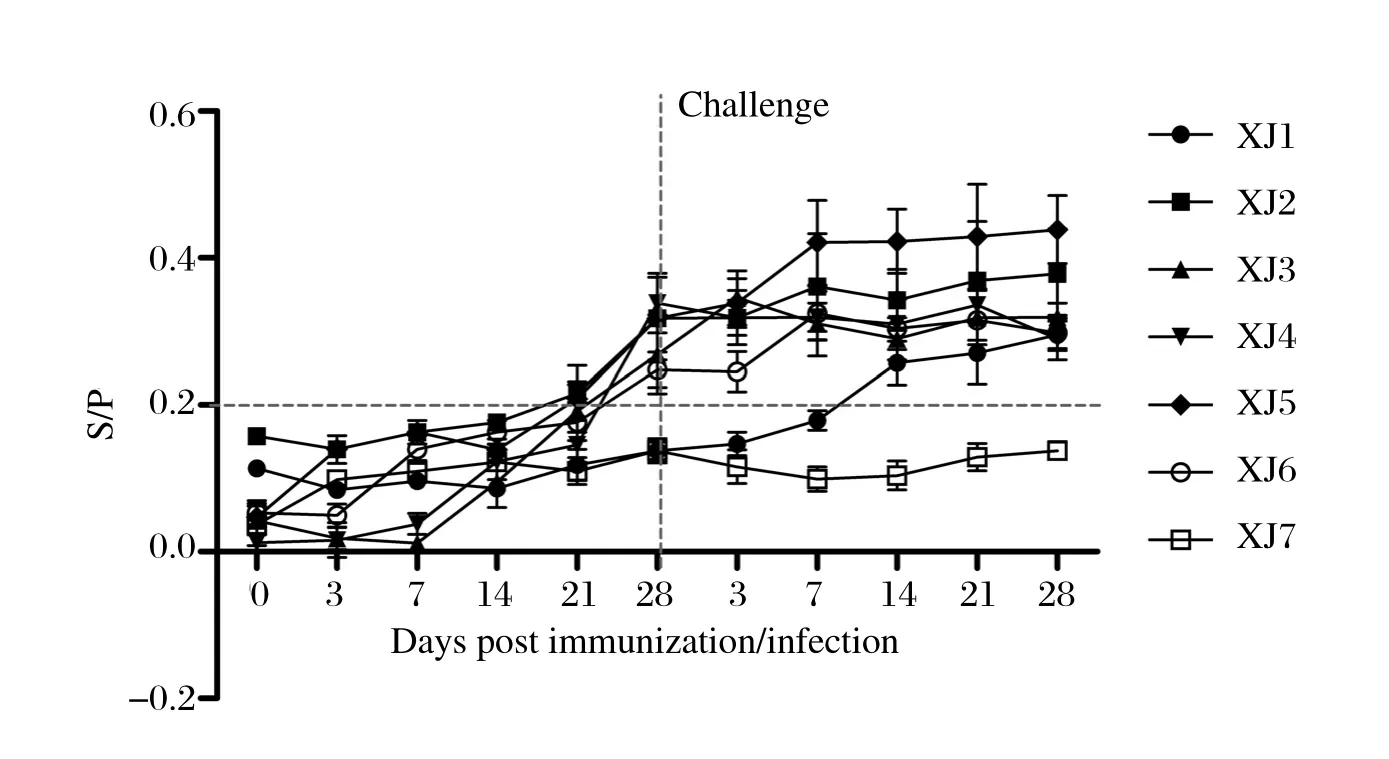
图3 免疫后各组NP49特异性抗体检测结果Fig. 3 NP49 special antibody responses in piglets of different groups after challenge
2.4 病毒分离结果血液中病毒分离结果显示,在攻毒后3 d所有试验组的猪血液内均能分离到PRRSV,XJ2~XJ6组在攻毒后21 d病毒分离率较低,攻毒后28 d所有试验猪均分离不到病毒。XJ1组攻毒后28 d有2只猪血液中能够分离出病毒,XJ7组在攻毒后28 d有3只猪血液中能够分离出病毒(表2)。
2.5 剖检病理观察试验猪剖检后眼观病理变化结果显示,攻毒后XJ2~XJ6组各组织脏器基本正常。XJ1组攻毒后所有猪肺脏均有明显病变,其中3头肺脏最严重出血或实变;3头脾脏出血;2头腹股沟淋巴结出血或者肿胀。XJ7组所有猪剖检肺脏均有严重出血和实变;4头猪淋巴结肿胀出血;1头猪肾脏出血;2头猪脾脏出血(表3)。
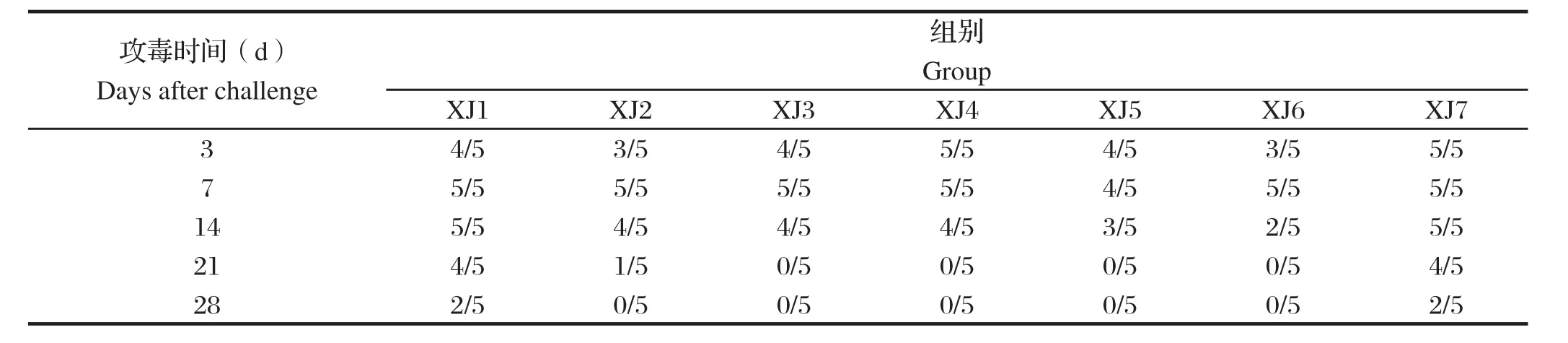
表2 各免疫组试验猪攻毒后血液中病毒分离结果Table 2 Development of viremia in after HP-PRRSV challenge piglets
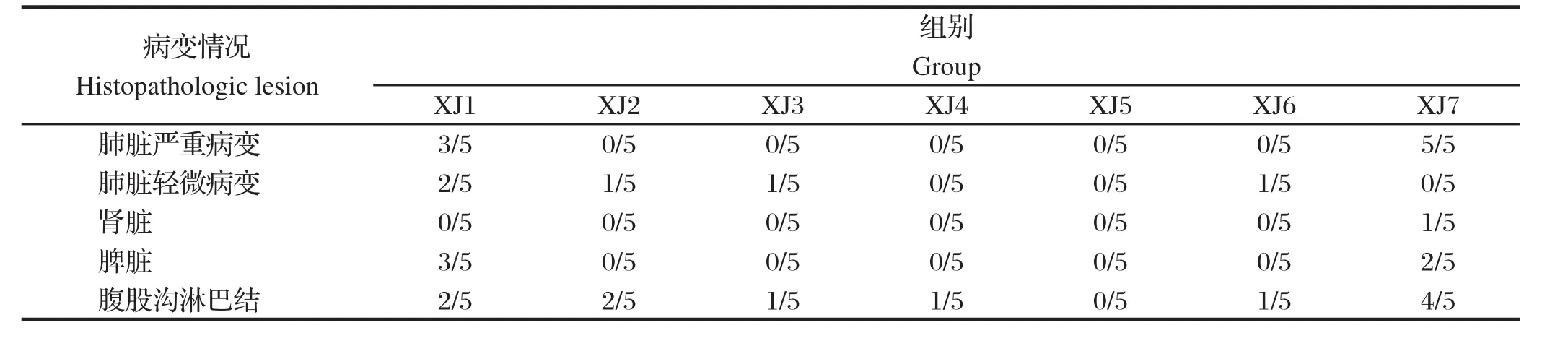
表3 攻毒后各组试验猪剖检眼观组织脏器病变情况Table 3 Histopathologic lesion in organs of vaccinated piglets in different groups after HP-PRRSV challenge
2.6 组织病理学观察结果组织病理学观察结果显示XJ2~XJ6组各组织脏器均无病变(图4A-D)。XJ7组试验猪的肺脏表现主要为肺出血、淋巴细胞浸润、肺泡隔增宽形成间质性肺炎(图4E),肾组织无明显病理变化(图4F),脾脏表现为淋巴细胞浸润(图4G),淋巴结表现为滤泡和淋巴小结崩解(图4H)。
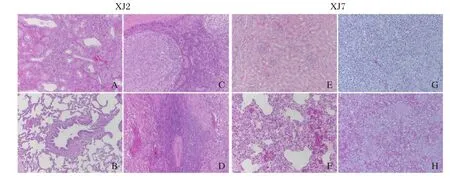
图4 XJ2组以及XJ7组试验猪组织病理学观察结果Fig. 4 Histologic analysis of piglets in group XJ2 and XJ7
3 讨论
2006年后,HP-PRRS成为我国流行的主要毒株[9,18],虽然针对HP-PRRSV灭活疫苗和减毒活疫苗很快研制出来并推向临床使用,使疫病得到了一定程度的控制[10-12],但现有疫苗的鉴别诊断方法对试验条件要求高、周期长,给疫病流行情况的判定、净化和清除造成了巨大困难,因此研制一种能够用血清学方法快速简便的对疫苗免疫和野毒感染动物进行区分的HP-PRRSV疫苗显得尤为重要。针对以上问题,在已有的PRRSV HuN4-F112反向遗传操系统基础上,本实验室成功获得PRRSV基因工程双标记疫苗rHN4-△25+NP49株[13,14]。对其最小免疫剂量测定试验结果显示,仔猪免疫PRRSV基因工程双标记疫苗rHN4-△25+NP49株后能够迅速产生针对PRRSV的抗体,能够抵抗HP-PRRSV的攻击。XJ2-XJ6组所有猪在免疫后14 d即能检测出较高水平的PRRSV ELISA抗体。XJ1组免疫后PRRSV ELISA抗体产生时间较晚(免疫后21 d),同时抗体水平也低于XJ2~XJ6组,提示以102TCID50/头份的剂量免疫,产生完全免疫保护的时间可能会迟于其他各免疫组。NP49特异性抗体检测结果显示,XJ2~XJ6组在免疫28 d后能够检测到针对NP49的特异性抗体,而对照XJ7组则到试验结束均无法检测出针对NP49的特异性抗体,表明PRRSV基因工程双标记疫苗rHN4-△25+NP49株免疫后,可以通过建立NP49-ELISA方法特异性识别经过标记疫苗免疫的动物,进而达到鉴别诊断目的。
血液中病毒含量测定结果显示,XJ2-XJ6组试验猪的病毒血症持续时间约为14 d(仅XJ2组有1头猪血液中21 d能够分离到病毒,28 d则所有猪血液中均无法分离到病毒)。XJ1组大部分猪病毒血症持续到21 d(4/5),对照组XJ7病毒血症至少持续到攻毒后21 d(2头持续到28 d),提示103~107TCID50/头份的剂量免疫能够有效抑制病毒在体内的复制。
攻毒后对照XJ7组所有猪均发病,最终死亡2头,而XJ2~XJ6组猪无死亡,无临床症状。剖检后XJ2~XJ6组仅有个别猪肺部或者淋巴结有轻微的病变,临床观察结果显示,这些肺部或者淋巴结有轻微病变的猪并未出现临床病理表现;剖检眼观结果显示,这些病变轻微,未对组织器官造成显著损伤;组织病理学观察结果也显示这些病变对组织器官影响轻微(数据未列出)。由于试验用猪是无特定病原体的猪而不是SPF猪,因此个别猪肺部或者淋巴结的病变不排除是由于细菌或其他病原感染造成的。XJ1组虽然无仔猪死亡,但攻毒后有4头猪发病,剖检结果显示有3头肺部严重出血或者实变,显示出典型的PRRSV引发的病变,不同的猪脾脏和淋巴结也有不同程度的病变,说明以102TCID50/头份的剂量免疫,免疫后28 d依然无法提供完全的免疫保护。以上结果表明:以103~107TCID50/头份的剂量免疫PRRSV基因工程双标记疫苗rHN4-△25+NP49株能够保护仔猪抵抗HP-PRRSV的攻击,PRRSV基因工程双标记疫苗rHN4-△25+NP49株最小免疫剂量为103TCID50/头份。
[1] Meulenberg J J, Hulst M M, de Meijer E J,et al. Lelystad virus belongs to a new virus family, comprising lactate dehydrogenase-elevating virus, equine arteritis virus, and simian hemorrhagic fever virus[J]. Arch Virol Suppl, 1994, 9∶ 441-448.
[2] Snijder E J, Horzinek M C, Spaan W J. The coronaviruslike superfamily[J]. Adv Exp Med Biol, 1993, 342∶ 235-244.
[3] Snijder E J, Meulenberg J J. The molecular biology of arteriviruses[J]. J Gen Virol, 1998, 79(Pt 5)∶ 961-979.
[4] Dea S, Gagnon C A, Mardassi H,et al. Current knowledge on the structural proteins of porcine reproductive and respiratory syndrome (PRRS) virus∶ comparison of the North American and European isolates[J]. Arch Virol, 2000, 145(4)∶ 659-688.
[5] Wu W H, Fang Y, Farwell R,et al. A 10-kDa structural protein of porcine reproductive and respiratory syndrome virus encoded by ORF2b[J]. Virology, 2001, 287(1)∶ 183-191.
[6] Tian K, Yu X, Zhao T,et al. Emerg ence of fatal PRRSV variants∶ unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark[J]. PLoS One, 2007, 2(6)∶ e526.
[7] Zhou Y J, Hao X F, Tian Z J,et al. Highly v irulentporcine reproductive and respiratory syndrome virus emerged in China[J]. Transbound Emerg Dis, 2008, 55(3-4)∶ 152-164.
[8] Zhou L, Chen S, Zhang J,et al. Molecular variation analysis o f porcine reproductive and respiratory synd rome virus in China[J]. Virus Res, 2009, 145(1)∶ 97-105.
[9] Zhou L, Yang H. Porcine reproductive and respiratory syndrome in China[J].Virus Res, 2010, 154(1-2)∶ 31-37.
[10] Tian Z J, An T Q, Zhou Y J,et al. An attenuated live vaccine based on highly pathogenic porcine reproducti ve and respiratory syndrome virus (HP-PRRSV) protects piglets against HP-PRRS[J]. Vet Microbiol, 2009, 138 (1-2)∶ 34-40.
[11] Han W, Wu J J, Deng X Y,et al. Molecular mutations associated with the in vitro passage of virulent porcine reproductive and respiratory syndrome virus[J]. Virus Genes, 2009, 38(2)∶ 276-284.
[12] Leng X, Li Z, Xia M,et al. Evaluation of the efficacy of an attenuated live vaccine against highly pathogenic porcine reproductive and respiratory syndrome virus in young pigs[J]. Clin Vaccine Immunol, 2012, 19(8)∶ 1199-1206.
[13] 徐彦召, 周艳君, 童武, 等. 表达外源基因的猪繁殖与呼吸综合征病毒(PRRSV)感染性克隆的构建及病毒拯救[J]. 农业生物技术学报, 2012, 20(5)∶ 473-480.
[14] Xu Y Z, Zhou Y J, Zhang S R,et al. Stable expression of foreign gene in nonessential region of nonstructural protein 2 (nsp2) of porcine reproductive and respiratory syndrome virus∶ applications for marker vaccine design[J]. Vet Microbiol, 2012, 159(1-2)∶ 1-10.
[15] Zhang S R, Zhou Y J, Jiang Y F,et al. Generation of an infectious clone of HuN4-F112, an attenuated live vaccine strain of porcine reproductive and respiratory syndrome virus[J]. Virol J, 2011, 8∶ 410.
[16] 孙晶, 周艳君, 徐彦召, 等. 猪繁殖与呼吸综合征基因标记疫苗株NP49-ELISA鉴别诊断方法的建立[J].中国动物传染病学报, 2013, 21(6)∶ 12-18.
[17] Qiu H J, Tian Z J, Tong G Z,et al. Protective immunity induced by a recombinant pseudorabies virus expressing the GP5 of porcine reproductive and respiratory syndrome virus in piglets[J].Vet Immunol Immunopathol, 2005, 106 (3/4)∶ 309-319.
[18] An T Q ,Tian Z J, Xiao Y,et al. Origin of highly pathogenic porcine reproductive and respiratory syndrome virus, China[J]. Emerg Infect Dis, 2010, 16(2)∶ 365-367.
STUDIES ON MINIMUM IMMUNIZATION DOSE OF DUAL-MARKER VACCINE RHN4-Δ25+NP49 STRAIN AGAINST HIGHLY PATHOGENIC PORCINE REPRODUCTIVE AND RESPIRATORY SYNDROME VIRUS
JIANG Yi-feng, ZHOU Yan-jun, TONG Wu, YU Ling-xue, CHENG Qun, YANG Shen, XIA Tian-qi, LI Li-wei, GAO Fei, TONG Guang-zhi
(Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
Thirty f ve 40-days old piglets without Porcine reproductive and respiratory syndrome virus (PRRSV), Porcine circovirus (PCV2) and Classical swine fever virus (CSFV) were selected and randomly divided into 7 groups (XJ1-XJ7). Each of piglets in groups XJ1-XJ6 was inoculated with 102TCID50to 107TCID50of HP-PRRS dual-marker vaccine rHN4-Δ25+NP49 strain, respectively. Group XJ7 served as infection control. On 28 day post immunization, all animal were infected with 3×104TCID50HuN4-F5 strain. Fever and other clinical signs were recorded daily. Pigs in group XJ2-XJ6 developed high level of humoral response against PRRSV from day 14 post immunization while piglets in group XJ1 developed a low level PRRSV antibody response from day 21 post immunization. Fourpiglets in group XJ1 and 5 piglets in XJ7 had various disease manifestations, including persistently high fever and anorexia. Two piglets in group XJ7 died at days 5 and 20 post challenge. On the contrast, piglets in groups XJ2-XJ6 did not show any clinical signs post challenge. These results indicated that the minimum immunization dose of rHN4-Δ25+NP49 strain was 103TCID50, which conferred effective protection against HP-PRRSV.
Porcine reproductive and respiratory syndrome virus; dual-marker vaccine; minimum immunization dose
S852.659.6
A
1674-6422(2014)02-0039-07
2013-10-09
863计划项目(2011AA10A208-2);国家国际科技合作重点计划项目(2010DF33920);国家自然科学基金项目(31100121);科研院所技术开发研究专项资金(2012EG134237);上海市科技兴农重点攻关项目(沪农科攻字(2012)第2-5号);上海市重点基础研究项目(11JC1415200)
姜一峰,男,博士,主要从事动物病毒分子生物学研究;周艳君,女,研究员,博士,主要从事动物病毒分子生物学研究
童光志,E-mail:gztong@shvri.ac.cn
