不同剂量地塞米松及不同免疫调节剂对鸡免疫功能的影响
2014-04-13宋道桢付石军常维山
郑 蓓,赵 翠,宋道桢,付石军,常维山
(1.山东农业大学动物科技学院,泰安 271000;2.山东省滨州畜牧兽医研究院,滨州 256600)
不同剂量地塞米松及不同免疫调节剂对鸡免疫功能的影响
郑 蓓1,赵 翠1,宋道桢2,付石军2,常维山1
(1.山东农业大学动物科技学院,泰安 271000;2.山东省滨州畜牧兽医研究院,滨州 256600)
本文旨在研究不同剂量地塞米松及不同免疫调节剂对鸡免疫功能的作用,以确定临床上地塞米松的用量上限及寻找一种效果较好的免疫调节剂。将10日龄鸡随机分为对照组、0.1、0.5、1.5 mg/kg· BW地塞米松组,通过饮水添加地塞米松,检测多种免疫指标。结果表明地塞米松可影响正常鸡的免疫功能, 0.1、0.5、1.5 mg/kg· BW地塞米松均可极显著抑制鸡外周血T淋巴细胞增殖(P<0.01),但对B淋巴细胞无明显影响;0.5、1.5 mg/kg· BW地塞米松可极显著抑制鸡白细胞介素-2的活性(P<0.01);0.5、1.5 mg/kg· BW地塞米松组的新城疫抗体水平显著低于对照组(P<0.05);0.5、1.5 mg/kg·BW地塞米松组淋巴细胞比率显著低于对照组(P<0.05);地塞米松组的鸡总体重、免疫器官及法氏囊指数显著低于对照组。将10日龄鸡随机分为4组,分别为对照组、干扰素组、干扰肽组和胸腺肽组,试验前5 d所有组饮水中均添加0.5 mg/kg· BW地塞米松,5 d后各组分别在饮水中添加相应的免疫调节剂,试验结束后检测免疫指标。结果表明:干扰素、胸腺肽组的T淋巴细胞转化率极显著高于对照组(P<0.01);胸腺肽组的新城疫抗体水平显著高于对照组(P<0.05),白细胞数、淋巴细胞数极显著高于对照组(P<0.01),总体重显著高于对照组(P<0.05);干扰素组的脾脏指数显著高于对照组(P<0.05)。试验结果说明当地塞米松的用量超过0.5 mg/kg· BW可抑制鸡的免疫功能,而干扰素和胸腺肽对鸡群有免疫调节作用,可在一定程度上提高鸡群的免疫力。
地塞米松;鸡;免疫功能;免疫调节
由各种应激因素引起的免疫应激会导致血液中糖皮质激素的含量显著上升,抑制机体的细胞免疫功能,使机体的免疫力降低,导致动物生产性能下降,给养殖业带来巨大的经济损失[1]。引发免疫抑制产生的原因很多,其中地塞米松的滥用导致的免疫抑制虽然不表现明显的临床症状[2],但是造成的潜在后果特别严重,给生产造成的持续损失也比较长久[3]。地塞米松被广泛应用于兽医临床疾病防治中,并且收到了很好的效果[4]。然而,很多使用地塞米松治愈的鸡又很容易感染其他疾病死亡,而且很多是已经免疫过的疾病[5]。现在,对地塞米松的大量使用甚至滥用已经引起了人们的极大关注[6]。地塞米松严重损害了动物机体的生长代谢及免疫功能,使家禽对多种病原菌的免疫应答能力降低甚至消失[7,8],导致家禽疾病的发病率和治疗难度增加,造成了巨大的经济损失[9]。
针对此种现象,本试验通过给予鸡群不同剂量的地塞米松,检测地塞米松对鸡群各项免疫指标的影响,观察地塞米松对正常鸡免疫功能的影响,用药的剂量与抑制程度是否有关系,为临床合理使用地塞米松提供科学依据,避免地塞米松的不合理使用带给养鸡业的经济损失。同时构建地塞米松对鸡免疫抑制的模型。
养鸡业是畜牧养殖业中一个重要支柱产业,伴随其养殖规模不断扩大,市场占有比例的不断提高,为了创造更大的经济效益,降低养殖成本,减少经济损失,鸡的疫病防治成为了人们关注的焦点[10]。当前多种因素都会造成动物机体的免疫抑制,进而继发多种病原微生物的感染,多病齐发给畜禽养殖业造成了不可估量的损失[11]。随着科技水平的提高,免疫增强剂的作用越来越受到重视,特性确定、高效稳定、无毒无残留的免疫增强剂是未来疾病防疫的重要物品 。免疫增强剂的种类多达上百种,现在市场上常用的免疫调节剂的效果如何,能否增强机体的免疫力。本文选取了胸腺肽、干扰素和微生态制剂干扰肽做临床试验,以选取效果较好的免疫调节剂指导生产应用。
1 材料与方法
1.1 实验动物与试剂10日龄肉鸡购自某养鸡场。1640培养液购自Thermo赛默飞世尔生物化学制品有限公司;犊牛血清购自中美合资兰州民海生物工程有限公司;淋巴细胞分离液、ConA、LPS、MTT购自Sigma公司;Wright-Giemsa 混合染液购自Solarbio公司;鸡干扰素-γ酶联免疫检测试剂盒购自上海朗顿生物技术有限公司;干扰素购自四川世红生物技术有限公司;干扰肽购自大连三仪动物药品有限公司;胸腺肽购自辰欣药业有限公司。
1.2 试验方法
1.2.1 实验动物分组及处理 将10日龄鸡随机分为3组地塞米松实验组和1组空白对照组。实验组分别按每天每只鸡0.1、0.5、1.5 mg/kg·BW饮水给药,早晚各1次。其余饲养条件实验组和对照组相同。
在10日龄鸡群饮水中添加0.5mg/kg·BW地塞米松,连用5 d后,将鸡群随机分为4组,分别为对照组、干扰素组、干扰肽组和胸腺肽组,在饮水中添加相应的免疫调节剂。试验结束后,检测免疫指标。
1.2.2 淋巴细胞转化试验 无菌采取鸡肝素抗凝血,常规方法分离外周血淋巴细胞,用1640培养液配成1×107/mL淋巴细胞悬液。96孔细胞培养板,每孔加入淋巴细胞悬液100 μL。分别加入ConA(终浓度45 μg/mL)或LPS(终浓度25 μg/mL)。将培养板37℃培养56 h,加入5 mg/mL MTT溶液10 μL,摇匀,继续培养4 h,加入0.04 mol/L酸化异丙醇100 μL,在波长490 nm处测定OD值。
1.2.3 脾脏T淋巴细胞IL-2体外诱生 将实验鸡迫杀,无菌取脾脏,研磨,以淋巴细胞分离液密度梯度离心分离淋巴细胞,制备活细胞率>95%的1640单细胞悬液。于24孔细胞培养板每孔加入1×107/mL单细胞悬液1 mL,含2.5 μg/mL ConA的1640完全营养液1 mL。置5%CO2、37℃细胞培养箱静置培养,20 h后取出细胞培养板,将培养液移入离心管内2000×g离心20 min,收取上清液,-20℃冻存备检。
鸡外周血T淋巴细胞产生的白细胞介素-2 (IL-2)活性的检测:取正常鸡脾脏,分离淋巴细胞,制备靶细胞悬液,培养48 h。96孔培养板,每孔加入100 μL待测样品及100 μL靶细胞悬液,37℃培养18 h,每孔加入5 mg/mL MTT溶液,继续培养4 h,加入酸化异丙醇,测定OD490值。
1.2.4 新城疫抗体水平检测 对13日龄鸡群点眼滴鼻接种新城疫疫苗,2 d后采血分离血清,常规血凝抑制方法检测血清中新城疫抗体水平。
1.2.5 血清中IFN-γ含量测定 参照鸡干扰素-γ酶联免疫检测试剂盒说明书操作,酶标仪450 nm波长读数。
1.2.6 白细胞数、淋巴细胞数及淋巴细胞比率 翅膀静脉采集抗凝血,血细胞分析仪读数。
1.2.7 免疫器官指数 试验结束后鸡空腹称活体重,然后进行屠宰,分离出免疫器官(脾脏和法氏囊),并立即分别称其新鲜重量。免疫器官指数=免疫器官鲜重/活体重×100。
1.2.8 白细胞吞噬功能检测 在肝素抗凝血中加入葡萄球菌,37℃孵育1~2 h,每隔10 min轻轻晃动1次。取孵育液滴于载玻片上,推成薄片,待自然干后用Wright-Giemsa 混合染液染色,蒸馏水轻轻冲去染液,自然晾干。油镜镜检,记数 100 个以上白细胞,并计算白细胞吞噬率:吞噬细胞百分率(%)= 吞噬细菌的中性粒细胞数÷吞噬和未吞噬的中性粒细胞总数×100%。
2 结果
2.1 地塞米松对鸡外周血淋巴细胞转化的影响从表1可以看出,0.1、0.5、1.5 mg/kg·BW用药组的T淋巴细胞转化率极显著低于对照组(P<0.01),用药组和对照组B淋巴细胞转化率差异不具有显著统计学意义。干扰素组和胸腺肽组的T淋巴细胞转化率极显著高于对照组(P<0.01),干扰素组的B淋巴细胞转化率显著高于对照组(P<0.05)。说明地塞米松可降低T淋巴细胞的转化率,干扰素可提高T淋巴细胞和B淋巴细胞的转化率,胸腺肽对T淋巴细胞转化率也有促进作用。
2.2 地塞米松对诱生鸡外周血淋巴细胞IL-2活性的影响从表2可以看出,0.5、1.5 mg/kg·BW用药组的IL-2活性极显著低于对照组(P<0.01)。说明大剂量的地塞米松可降低鸡外周血淋巴细胞IL-2的活性。干扰素组、干扰肽组和胸腺素组的IL-2略高于对照组,但差异无显著统计学意义(P> 0.05)。

表2 不同剂量地塞米松及不同免疫调节剂对鸡外周血淋巴细胞IL-2活性的影响Table 2 Effects of different levels of dexamethasone and different immune modulators on the IL-2 activity in chickens
2.3 新城疫抗体水平0.5、1.5 mg/kg·BW用药组的抗体效价显著低于对照组(P<0.05)。胸腺肽组的效价显著高于对照组(P<0.05)。说明大剂量的地塞米松可降低血清中新城疫抗体的效价。胸腺肽可提高血清中新城疫抗体的效价,提高机体抵抗新城疫病毒的水平(表3)。

表3 不同剂量地塞米松及不同免疫调节剂对新城疫抗体效价的影响Table 3 Effects of different levels of dexamethasone and different immune modulators on the Newcastle disease antibody activity in chickens
2.4 血清中IFN-γ含量检测结果显示0.1、0.5 mg/kg·BW用药组的IFN-γ含量略高于对照组,1.5 mg/kg·BW用药组的IFN-γ含量略低于对照组,但是差异均无显著性统计学意义(P>0.05)。对免疫抑制的鸡群使用不同免疫调节剂后,各组的IFN-γ含量差异也不具有显著统计学意义(P>0.05)(表4)。
2.5 白细胞数、淋巴细胞数及淋巴细胞比率从表5可以看出,0.5、1.5 mg/kg·BW用药组的淋巴细胞比率显著低于对照组(P<0.05)。胸腺肽组的白细胞数和淋巴细胞数极显著高于对照组(P<0.01)。说明高剂量的地塞米松可降低白细胞中淋巴细胞的比率。胸腺肽可提高血液中白细胞数和淋巴细胞数,白细胞是机体的一项重要免疫指标,说明胸腺肽可提高机体的免疫力。

表4 不同剂量地塞米松及不同免疫调节剂对血清中IFN-γ含量的影响Table 4 Effects of different levels of dexamethasone and different immune modulators on IFN-γ content in chickens

表5 血液中白细胞数、淋巴细胞数及淋巴细胞比率Table 5 Numbers of white blood cells,lymphocyte count and lymphocyte ratio in the blood
2.6 免疫器官指数脾脏和法氏囊作为禽的重要免疫器官,它们的器官指数可直接反映免疫器官的发育状态。本试验结果显示,在地塞米松作用下,0.1、0.5、1.5 mg/kg·BW用药组的总体重显著低于对照组(P<0.05),0.1、1.5 mg/kg·BW用药组的脾脏重量显著低于对照组(P<0.05),0.1、0.5、1.5 mg/kg· BW用药组的法氏囊重量极显著低于对照组(P<0.01),0.1、0.5、1.5 mg/kg·BW用药组的法氏囊指数极显著低于对照组(P<0.01)。由此说明在地塞米松的作用下, 免疫器官的发育阻滞。胸腺肽组的总体重显著高于对照组(P<0.05),干扰素组的脾脏指数显著高于对照组(P<0.05)。地塞米松可抑制免疫器官脾脏和法氏囊的正常发育,而通过添加干扰素或胸腺肽可在一定程度上对免疫器官的正常发育起到促进作用(表6)。
2.7 白细胞吞噬实验从表7可以看出,用药组的白细胞吞噬率和对照组差异无显著统计学意义(P>0.05)。干扰素组、胸腺肽组、干扰肽组的白细胞吞噬率和对照组差异无显著统计学意义(P> 0.05)。
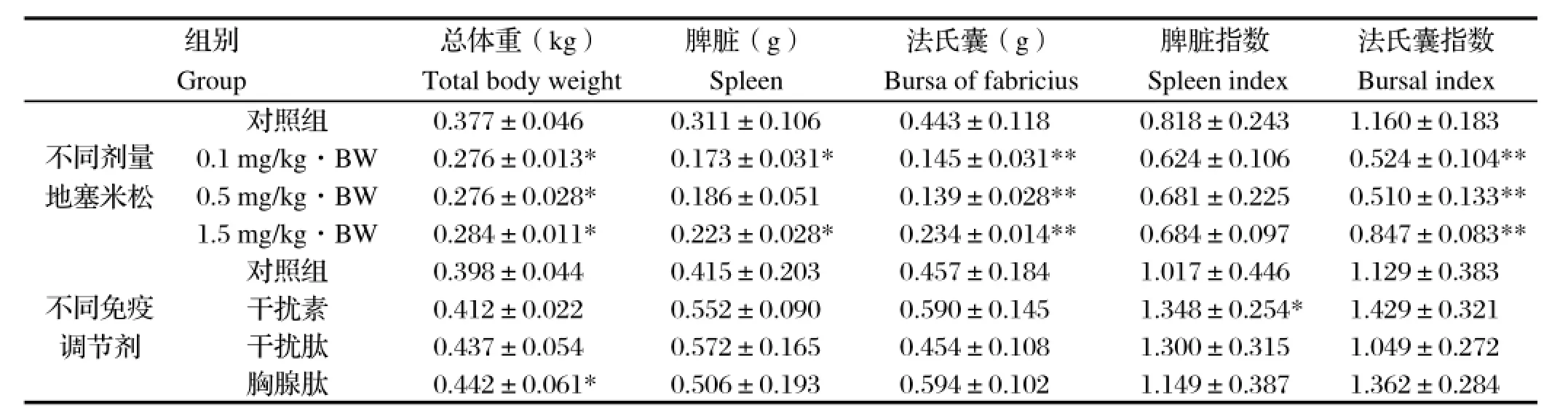
表6 总体重、免疫器官重量及免疫器官指数Table 6 The overall weight,immune organ weight and organ index

表7 不同剂量地塞米松及不同免疫调节剂对鸡血液白细胞吞噬功能的影响Table 7 Effects of different levels of dexamethasone and different immune modulators on leukocyte phagocytosic activity in chickens
3 讨论
当动物机体受到各种有害刺激时体内糖皮质激素会相应升高,从而导致机体的免疫抑制[13,14]。地塞米松用量的确定极其重要,超过安全剂量后地塞米松可引起免疫抑制[15,16]。孙雷等[17]通过自由饮水方式给予鸡群不同剂量地塞米松,测定新城疫和传染性法氏囊病病毒的抗体效价,结果表明在较小剂量 0.5 mg/kg/d时影响不大,但在大剂量≥1.0 mg/kg/d时已有显著的抑制作用,影响免疫效果。操继跃等[18]分别向免疫期间的各组鸡群给予不同剂量的地塞米松后,对雏鸡新城疫病毒和传染性法氏囊病病毒抗体滴度进行监测。结果表明小剂量(0.1 mg/kg)地塞米松对抗体滴度影响不显著,而中、大剂量地塞米松可使肉鸡新城疫病毒、传染性法氏囊病病毒的抗体滴度显著低于对照组。地塞米松对鸡的临床用药推荐剂量约为0.1 mg/kg,可见若严格按推荐剂量给药,则对体液免疫无显著影响,但当用量在0.5 mg/kg以上时,便会造成明显的免疫抑制,直接造成免疫失败,会给养鸡业带来巨大的损失。因此,临床上使用地塞米松时应严格控制剂量。
本研究通过饮水给予鸡群地塞米松后,通过各项免疫指标的检测观察鸡群的免疫力的变化,更全面分析得出地塞米松的安全使用量。通过试验发现,地塞米松试验组的鸡的T淋巴细胞转化率、IL-2活性、新城疫抗体水平、淋巴细胞比率、法氏囊指数等免疫指标显著低于正常对照组的鸡。试验结果可以说明,饮水中添加地塞米松可降低鸡的免疫力。建议在临床应用中不要滥用地塞米松去治疗鸡的疾病,用量超过每天0.5 mg/kg·BW时会显著引起免疫力降低,容易导致其他疾病的发生。
在实际生产中有很多因素能导致家禽产生免疫抑制,并给养殖业带来重大经济损失。因此建立适度而稳定的免疫抑制模型对研究免疫增强剂至关重要[19]。研究结果说明,按照0.5 mg/kg/d的剂量饮水给予地塞米松能够复制出较理想的免疫抑制模型。
目前国内外关于鸡干扰素给药方式对抗体产生的报道,多以注射给药为主,不适合临床推广[20]。有资料表明,以鸡的胸腺提取液喂鸡,能促进外周血淋巴细胞的生长。单独使用胸腺肽对鸡新城疫和传染性支气管炎的治愈率达到70%以上,胸腺肽对鸡新城疫病毒和传染性喉气管炎病毒强毒混合感染的小鸡有一定的预防与治疗作用。已有研究表明使用乳酸 L-68 粪肠球菌制剂在动物肠道内增殖时,能改善肠道内环境促进动物健康,通过添加乳酸 L-68粪肠球菌对改善鸡健康状况和饲养环境方面有初步外观表现。对肉鸡的免疫增强作用方面,乳酸L-68粪肠球菌能明显提高循环血液中的抗体水平。
本试验选择胸腺肽、干扰素和微生态制剂干扰肽,通过饮水口服添加给予鸡群,研究它们对机体免疫功能的影响。干扰素、胸腺肽组的T淋巴细胞转化率极显著高于对照组,胸腺肽组的新城疫抗体水平、白细胞数、淋巴细胞数、总体重显著高于对照组,干扰素组的脾脏指数显著高于对照组,说明干扰素和胸腺肽对鸡群有免疫调节作用,可提高鸡群的免疫力。结果表明干扰素和胸腺肽可以在一定程度上缓解由地塞米松引起的免疫抑制,恢复由地塞米松引起的免疫力降低。因此在临床上用地塞米松治疗疾病痊愈后,或者其他因素引起的免疫抑制病,可以在饮水中添加干扰素和胸腺肽等免疫调节剂,以恢复或提高机体免疫力,增强机体对其他疾病的抵抗力。
[1] 张丽云,张媛,罗明,等. 银翘解毒合剂对鸡免疫功能的影响[J]. 中国兽医杂志,2001,37(10): 28-29.
[2] 夏洪生,张玲梅,李克松,等. 地塞米松诱导脾淋巴细胞凋亡模型的制备[J]. 深圳中西医结合杂志,2004,14(5): 270-271.
[3] 王水琴,王选年,潘兴华,等. RU486对地塞米松诱导鸡淋巴细胞免疫抑制的逆转效应[J]. 中国兽医科技,1999,29(6): 10-12.
[4] 李庆章,刘忠贵. 鸡T淋巴细胞IL-2的体外诱生及活性检测[J]. 中国兽医学报,1994,14 (2): 160-163.
[5] 张乐萃,王金宝,周克年,等. 中药对免疫抑制鸡免疫器官形态学影响的研究[J]. 中兽医医药杂志,1998,2: 9-11.
[6] 李 宁,张 红,王燕玲,等. 低剂量碳离子全身辐射对小鼠淋巴细胞增殖及血清干扰素的影响[J]. 中国组织工程研究与临床康复,2007,11(13): 6581-9584.
[7] 乔彦良,盛英霞,遇欣,等. 甲硝唑对鸡细胞免疫和体液免疫功能的作用[J]. 中国兽医杂志,2001,37(8): 3-7.
[8] 邵良平,周伦江,李国平,等. 不同剂量甘露寡聚糖对鸡细胞免疫和肠道微生态的影响[J]. 福建农业大学学报,1999,28(1): 86-89.
[9] Greco D S,Harpold L M. Immunity and the endocrine system[J]. Vet Clin North Am Small Anim Pract,1994,24(4): 765-782.
[10] 戴卓见. 鸡应激性疾病的发生机制及特殊表现[J]. 中国兽医科技,1995,25(10): 24-25.
[11] 王选年,冯春花,王水琴,等. 米非司酮486阻断鸡GR及其对地塞米松诱导的免疫抑制的逆转效应[J]. 动物医学进展,2000,21(4): 7-9.
[12] 宋清明,李万猛. 家禽免疫抑制性疾病[J]. 中国家禽,2001,(18): 13-14.
[13] 王水琴,黎立,潘兴华,等. 淋巴细胞凋亡抑制与鸡马立克氏病的发生[J]. 中国兽医杂志,1998,24(10): 6-8.
[14] 顾云娣,王燕平,钟翠平. 抗原免疫对外周淋巴器官中细胞凋亡的影响[J]. 四川解剖学杂志,2001,9(2): 11-12.
[15] 潘兴华,陈志龙,黄丽娜,等. 淋巴细胞糖皮质激素受体与免疫的相互关系[J]. 生理科学进展,1999,30(4): 399-400.
[16] 谢玉生. 浅谈地塞米松在兽医临床中的应用[J]. 中国兽医杂志,1998,24(11): 37.
[17] 孙雷,操继跃. 地塞米松对鸡群体液免疫的影响[J]. 兽药与饲料添加剂,2002,7(6): 5-7.
[18] 操继跃,窦树龙,张韶东,等. 地塞米松和左旋咪唑对雏鸡体液免疫应答的影响[J]. 中国兽医学报,2002,22(5): 500-502.
[19] 夏洪生,李克松. 黄芪多糖对地塞米松诱导的脾淋巴细胞凋亡的影响[J]. 深圳中西医结合杂志,2001,(4): 193-199.
[20] 操继跃,窦树龙,张韶东,等. 地塞米松和左旋咪唑对雏鸡体液免疫应答的影响[J]. 中国兽医学报,2002,22(5): 500-502.
EFFECTS OF DIFFERENT DOSES OF DEXAMETHASONE AND DIFFERENT IMMUNE MODULATORS ON IMMUNE RESPONSES IN CHICKENS
ZHENG Bei1,ZHAO Cui1,SONG Dao-zhen2,FU Shi-jun2,CHANG Wei-shan1
(1. College of Animal Science and Technology,Shandong Agricultural University,Tai'an 271000,China; 2. Shandong Binzhon Animal Science & Veterinary Medicine Academy,Binzhou 256600,China)
The present study focused on effect of different doses of dexamethasone on the immune functions of chickens. Ten-day-old chickens were orally administered with 0.1,0.5 or 1.5 mg/kg·BW dexamethasone,respectively,and a number of immune indexes were tested. The result showed that dexamethasone affected normal immune functions in chickens. Dexamethasone suppressed proliferative capacity of T lymphocytes in chicken peripheral blood but had no obvious effect on B lymphocytes. In addition,dexamethasone inhibited activity of interleukin-2 in chickens. The Newcastle disease antibody level was low in dexamethasone treated chickens. The Lymphocyte ratios and chickens’ overall weights,immune organ indexes and fabricius of bursa in dexamethasone treated chickens were lower thanthose of non-treated control group. These results showed that 0.5,1.5 mg/kg· BW dexamethasone inhibited immune functions of chickens. In the next study,ten-day-old chickens were given drinking water containing dexamethasone at 0.5 mg/kg·BW for consecutive 5 days and then interferon,interferon-like peptide or thymus peptide were added to the water. T lymphocyte conversion rates in chickens receiving thymus peptide and interferon were signifi cantly higher than that of non-treatment controls,indicating their immunoregulatory role.
Dexamethasone; chicken; immunity; immunoregulation
S859.793
A
1674-6422(2014)05-0054-07
2014-04-01
山东省农业产业技术体系家禽创新团队岗位科学家研究经费(SDAIT-13-011-11)
郑蓓,女,硕士研究生,预防兽医学专业
常维山,E-mail:1651542031@qq.com
