大鼠肝细胞微球皮下移植生成肝组织初探
2014-04-11张兰李则学刘海亮李沛雨
张兰,李则学,刘海亮,李沛雨
解放军总医院 普通外科研究所,北京 100853
对于先天性肝代谢紊乱及终末期肝病所致的急、慢性肝功能衰竭,肝移植是目前唯一有效的救治手段,但供体短缺严重制约该技术广泛应用[1-2]。肝组织工程技术的发展为各种肝病治疗提供一种潜在方法[1-4]。通过创建可植入工程化肝移植物体内再生工程化肝组织可为病损肝脏提供肝功能支持或直接对其进行修复[5-6]。迄今为止已证实包括肝细胞/支架材料复合物、肝细胞片层等多种肝移植物体内植入后可再生有功能的工程化组织[7-12]。肝细胞微球是肝细胞在非贴壁培养过程中相互聚集形成的三维类组织样细胞聚集体;体外研究表明肝细胞在形成微球后可更好的保持其活性和功能[13-15],但尚未见将其用于体内构建组织工程肝的报道。本研究旨在评价肝细胞微球皮下移植形成肝组织的可行性。
材料和方法
1 材料 共10只SD大鼠(200 g左右,购于军事医学科学院动物中心),Ⅳ型胶原酶(美国Sigma公司),肝细胞培养基(HepatoZYME-SFM,美国Gibco BRL公司),D-Hank's液。倒置显微镜(Nikon),光学显微镜(Olympus),CO2培养箱(Heal Force),超净工作台(北京冠鹏净化设备有限公司)。
2 肝细胞分离 5只SD大鼠,经水合氯醛麻醉,开腹后自门静脉插管固定后,立即向门静脉灌注39℃无钙、镁的Hnak'液,并同时切断下腔静脉。当肝脏变白时,向肝脏中注入20 ml 39℃Ⅳ型胶原酶溶液。剪下肝脏,将其分别置于5个培养皿中,并加入相同浓度的Ⅳ型胶原酶溶液于37℃培养箱中继续消化10 min。弃去胶原酶溶液,加入DMEM溶液,用镊子撕去肝包膜,使肝细胞分散到溶液中。100目滤网过滤肝细胞,离心(100 g、5 min)收集肝实质细胞。用DMEM溶液洗涤肝细胞3遍,台盼蓝染色检测肝细胞活性在90%以上备用。
3 肝细胞微球培养 新鲜分离的肝细胞接种在经琼脂糖包被的培养皿中,加入肝细胞培养基HepatoZYME-SFM进行培养,每隔4 h手动摇晃1次以加速微球形成。
4 肝细胞微球体内植入 低速离心收集肝细胞微球,重悬于肝细胞培养基中。移植前将肝细胞微球置于注射器中,分别注射植入5只SD大鼠腹股沟处皮下腔中。
5 组织学观察 1周后,手术切下腹股沟处组织,10%中性福尔马林固定,石蜡包埋,切成10 μm切片,H.E.染色。光学显微镜观察。
结 果
1 肝细胞微球形成 新鲜分离的肝细胞接种在琼脂糖包被的培养皿上。体外培养3 d,光镜下可见致密的肝细胞微球形成,外形为圆形,边缘光滑;微球直径在43 ~ 185 μm(图1A)。组织学观察显示肝细胞微球保持天然肝细胞特有特征:胞体为圆形,核大而圆,多为双核(图1B)。
2 体内植入 皮下植入1周后,肝细胞微球成活并同周围组织整合在一起。HE染色显示植入的肝细胞保持肝特异的细胞形态,细胞为圆形,核大而圆,多为双核。见图2。

图1 肝细胞在琼脂糖包被的培养皿上形成肝细胞微球 A: 倒置显微镜观察肝细胞在培养3d后形成肝细胞微球; B: 组织学检查显示肝细胞保持肝特异的形态学特征Fig. 1 Inverted microscopy showing formation of hepatic spheroids in agar-coated dish 3 days after plating (A) and histological examination demonstrating the specific morphology of hepatocytes (B)
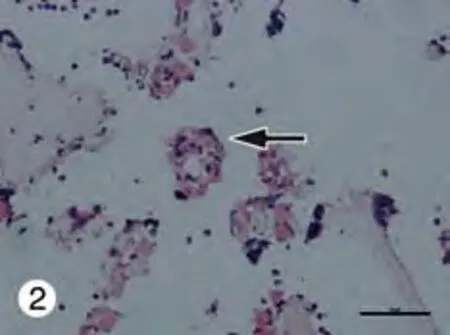
图2 皮下植入1周肝细胞微球(黑色箭头)成活并形成肝样组织Fig. 2 Surviving hepatic spheroids with formation of 3-dimensional liver-like tissue 1 week after subcutaneous transplantation (black arrow)
讨 论
本研究证实大鼠肝细胞微球通过直接注射的方式植入腹股沟皮下腔中可以成活并形成三维肝样组织,显示出良好的促肝组织再生潜能。因腹股沟皮下腔具备空间较大、易于操作、安全性好,且可将移植物可逆的移去等优点,近年来在组织工程肝构建中日益受到重视[11-12]。然而,腹股沟血管网结构贫乏,对构建方法提出了更高的要求。迄今为止,皮下创建工程化肝组织均需要借助预先形成的血管腔;即便如此,所形成的工程化肝组织厚度也只有几百个微米,也就是几层细胞厚度[11-12]。此外,植入的肝细胞易去分化也成为皮下创建工程化肝组织需要克服的困难[11]。本研究证实肝细胞微球不仅可在皮下腔中成活、形成三维肝样组织,而且很好的保持肝细胞特异细胞形态,表明其良好的促肝细胞植入和保持肝细胞特性的能力,具有潜在的用于在皮下腔进行工程化肝组织再生的潜能;而且,采用我们以前建立的肝单元融合创建工程化肝组织方法有望将肝细胞微球相互融合形成大块工程化肝组织[16]。此外,移植肝细胞微球无需支架避免因其引入而引起的免疫排斥的影响。肝细胞微球可通过直接注射方式进行移植也使得该方法不仅操作简单,而且可以最大限度的保存植入位点血管网为植入肝细胞提供良好的微环境。值得一提的是本实验所建立的琼脂糖微球培养法相对于生物反应器、摇晃培养法等不仅简单,而且可以快速形成(3 d)肝细胞微球,具有良好的用前景[14-15,17]。综上所述,我们创立的琼脂糖肝细胞微球培养联合肝细胞微球腹股沟皮下腔移植是一种新的、简单、有效的体内创建工程化肝组织的方法。今后的研究应致力于构建更大体积的工程化肝组织及其功能的研究。
1 Fiegel HC, Kaufmann PM, Bruns H, et al. Hepatic tissue engineering: from transplantation to customized cell-based liver directed therapies from the laboratory[J]. J Cell Mol Med, 2008,12(1):56-66.
2 Booth C, Soker T, Baptista P, et al. Liver bioengineering: current status and future perspectives[J]. World J Gastroenterol, 2012, 18(47): 6926-6934.
3 Palakkan AA, Hay DC, Anil Kumar PR, et al. Liver tissue engineering and cell sources: issues and challenges[J]. Liver Int,2013, 33(5): 666-676.
4 Duncan AW, Soto-Gutierrez A. Liver repopulation and regeneration:new approaches to old questions[J]. Curr Opin Organ Transplant,2013, 18(2): 197-202.
5 Arenas-Herrera JE, Ko IK, Atala A, et al. Decellularization for whole organ bioengineering[J/OL]. Biomed Mater, 2013, 8(1):014106.
6 Lu T, Li Y, Chen T. Techniques for fabrication and construction of three-dimensional scaffolds for tissue engineering[J]. Int J Nanomedicine, 2013, 8:337-350.
7 Kasuya J, Tanishita K. Microporous membrane-based liver tissue engineering for the Reconstruction of three-dimensional functional liver tissues in vitro[J]. Biomatter, 2013, 2(4): 290-295.
8 Shi G, Coger RN. Use of perfluorocarbons to enhance the performance of perfused three-dimensional hepatic cultures[J]. Biotechnol Prog, 2013, 29(3):718-726.
9 Cheng TY, Wu HC, Huang MY, et al. Self-assembling functionalized nanopeptides for immediate hemostasis and accelerative liver tissue regeneration[J]. Nanoscale, 2013, 5(7): 2734-2744.
10 Ohashi K, Waugh JM, Dake MD, et al. Liver tissue engineering at extrahepatic sites in mice as a potential new therapy for genetic liver diseases[J]. Hepatology, 2005, 41(1):132-140.
11 Yokoyama T, Ohashi K, Kuge H, et al. In vivo engineering of metabolically active hepatic tissues in a neovascularized subcutaneous cavity[J]. Am J Transplant, 2006, 6(1):50-59.
12 Ohashi K, Yokoyama T, Yamato M, et al. Engineering functional two- and three-dimensional liver systems in vivo using hepatic tissue sheets[J]. Nat Med, 2007, 13(7):880-885.
13 Ambrosino G, Basso SM, Varotto S, et al. Isolated hepatocytes versus hepatocyte spheroids: in vitro culture of rat hepatocytes[J]. Cell Transplant, 2005, 14(6): 397-401.
14 Brophy CM, Luebke-Wheeler JL, Amiot BP, et al. Rat hepatocyte spheroids formed by rocked technique maintain differentiated hepatocyte gene expression and function[J]. Hepatology, 2009, 49(2): 578-586.
15 Tostões RM, Leite SB, Serra M, et al. Human liver cell spheroids in extended perfusion bioreactor culture for repeated-dose drug testing[J]. Hepatology, 2012, 55(4):1227-1236.
16 Zhao Y, Xu Y, Zhang B, et al. In vivo Generation of thick,vascularized hepatic tissue from collagen hydrogel-based hepatic units[J]. Tissue Eng Part C Methods, 2010, 16(4): 653-659.
17 Doillon CJ, Gagnon E, Paradis R, et al. Three-dimensional culture system as a model for studying Cancer cell invasion capacity and anticancer drug sensitivity[J]. Anticancer Res, 2004, 24(4):2169-2177.
