原发性硬化性胆管炎26例临床分析
2014-04-11罗开发张晓梅
罗开发,苏 璇,张晓梅,李 闻
解放军总医院 消化科,北京 100853
原发性硬化性胆管炎(primary sclerosing cholangitis,PSC)是一种慢性胆管阻塞性疾病,主要特征为肝内外胆管慢性进行性炎症及纤维化,逐渐形成肝内外胆管多灶性狭窄与扩张交替,最终发展为胆汁性肝硬化、门静脉高压和肝脏功能衰竭。该病1867年由Hoffmann首次描述,1967年Thorpe正式提出PSC这一概念,之后该病报道不多。近年随着经内窥镜逆行胰胆管造影(endoscopic retrograde cholangiopancreatography,ERCP)和磁共振胰胆管造影(magnetic resonance cholangiopancreatography,MRCP)的广泛应用,该病的诊断率明显提高。本文通过对本院26例PSC回顾性分析,结合文献报道,总结对该病临床特征的认识,提高诊断率,减少误诊率。
资料和方法
1 一般资料 2006 - 2011年间本院诊治26例PSC患者。其中男16例,女10例,年龄35 ~ 60 (42.5±6.8)岁。同期收治慢性胆系疾病患者217例,26例PSC占12%(26/217)。
2 诊断标准 2010美国肝病学会发布的《原发性硬化性胆管炎诊疗指南》[1]:1)血清碱性磷酸酶(alkaline phosphatase,ALP)、γ-谷氨酰转肽酶(gamma glutamyltranspeptidase,GGT)、血清胆红素等胆汁淤积生化指标升高[2];2)胆管造影[MRCP和(或)ERCP和(或)经皮肝穿刺胆管造影(percutaneous transhepatic cholangiography,PTC)]显示典型的多灶狭窄和节段性扩张,典型者可呈现串珠样、枯树枝样改变;3)排除继发性硬化性胆管炎、胆管癌、IgG相关硬化性胆管炎等可引起胆道狭窄的疾病;4)对于临床、生化符合PSC但胆管造影正常的患者,肝穿刺活检病理组织学表现为胆管炎症和纤维化,典型者可表现为胆管向心性纤维化即“洋葱皮样改变”。同是符合前三者的可诊断为PSC,同是符合后两者的可归类为小胆管PSC。
3 分析指标 1)临床特征;2)ALP,GGT,丙氨酸氨基转移酶(alanine aminotransferase,ALT),天冬氨酸氨基转移酶(aspartate aminotransferase,AST),血清总胆红素(total bilirubin,TBil)等实验室指标;3)免疫球蛋白IgG,抗中性粒细胞胞浆抗体(antineutrophil cytoplasmic antibodies,ANCA),抗核抗体(anti-nuclear antibodies,ANA),抗平滑肌抗体(antismooth muscle antibody,SMA)等免疫指标;4)ERCP、MRCP、PTC、超声等影像学表现;5)肝脏病理学检查;6)治疗及预后。并通过电话进行随访。
4 统计学方法 采用SPSS18.0统计软件,计数资料以例数(百分率)表示;计量正态资料以±s表示,计量非正态资料以中位数及四分位数间距表示。
结 果
1 临床特征 本组26例,男16例,女10例,男女比例接近2∶1。分析病例资料,各临床症状出现的频次(见表1),可见PSC主要以黄疸、乏力、纳差为主,其次为皮肤瘙痒、发热、消瘦、脾肿大、发热。部分患者同是合并自身免疫性胰腺炎、溃疡性结肠炎。
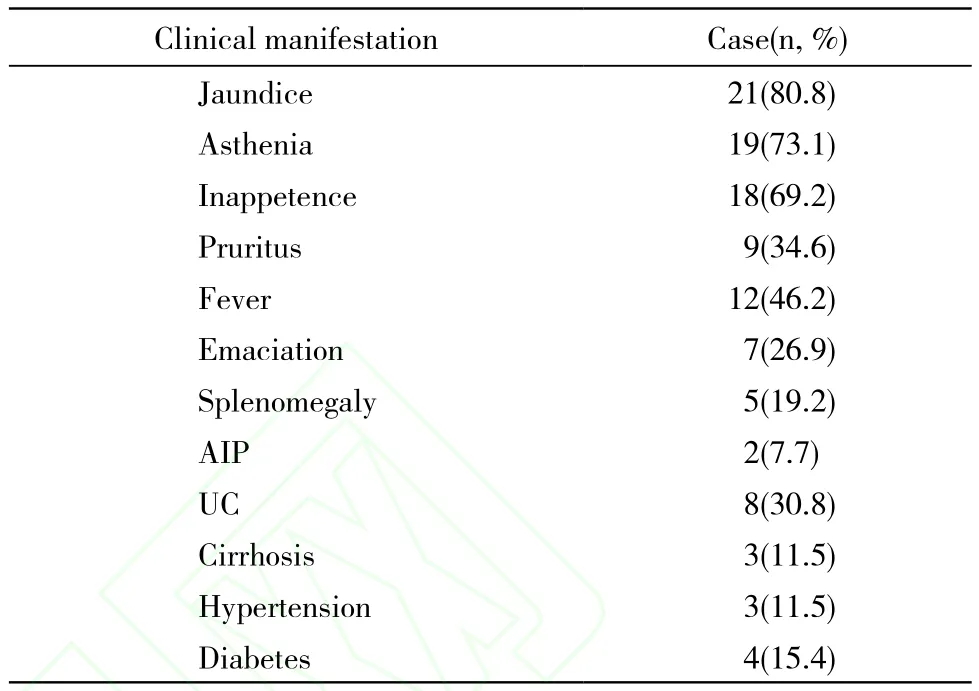
表1 26例PSC患者临床表现Tab. 1 Clinical manifestations of 26 PSC patients
2 实验室检查 26例血清生化学检查变化,主要包括ALP,GGT,ALT,AST和TBil改变(表2)。依据肝脏生化试验的分析与监测共识意见(草案)的标准[2]:轻度升高:ALT、AST、GGT及ALP介于正常上限的1 ~ 5倍,TBil 17.1 ~171 μmol/L;中度升高:ALT、AST、GGT及ALP介于正常上限的5 ~ 10倍,TB 171 ~ 342 μmol/L;重度升高:ALT、AST、GGT及ALP在正常上限10倍以上,TBil 342 μmol/L以上,本组中主要以轻度升高为主(见表3)。
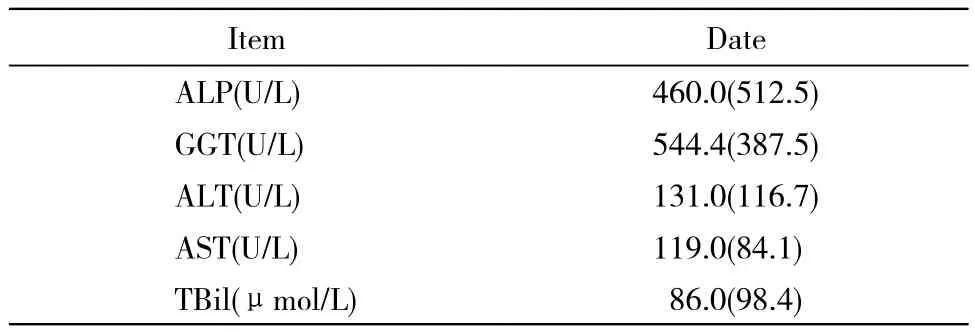
表2 26例PSC患者实验室检查Tab. 2 Laboratory test fndings in of 26 PSC patients(Md, P75-P25)
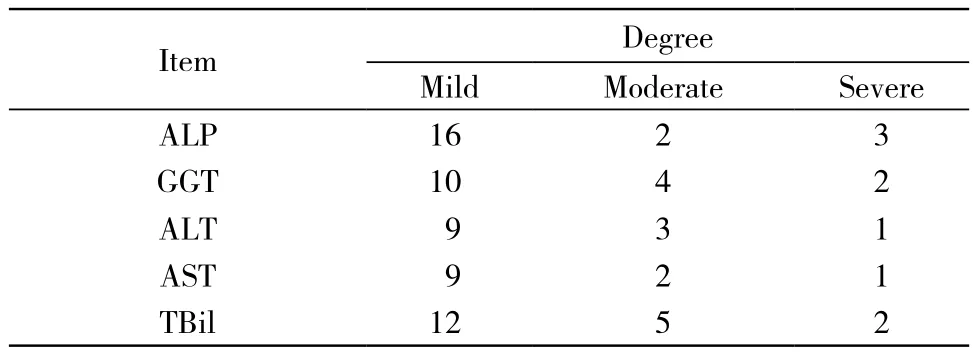
表3 PSC患者实验室检查分级Tab. 3 Laboratory tests showing ser um levels of ALP, GGT, ALT, AST, and TBiL
3 免疫学检查 26例中IgG升高18例(69.2%),ANCA阳性9例(34.6%),ANA阳性4例(15.4%), SMA阳性1例(3.8%)。
4 超声表现 21例(80.8%)表现为不同程度的胆管壁增厚、僵硬、毛糙,肝内外胆管节段性扩张和狭窄并伴有不同程度的淤胆。脾肿大5例(19.2%),腹水4例(15.4%)。
5 影像学表现 ERCP和(或)MRCP显示多灶性狭窄和节段性扩张的胆管改变。本组中14例(61.5%)胆管表现为“串珠样”改变(图1A);3例(11.5%)肝内外胆管未见狭窄,但可见轻度跳跃性扩张(图1B);5例(19.2%)显示肝内胆管广泛受累,胆管腔狭窄,其影像学表现酷似“枯树枝样”改变(图1C);2例(7.7%)可见肝内胆管僵硬,多发节段性狭窄及扩张,肝外胆管扩张(图1D)。
6 胃镜及结肠镜表现 胃窦溃疡3例(11.5%),十二指肠溃疡2例(7.7%),结肠镜检查见溃疡性结肠炎8例(30.7%)。
7 组织病理学表现 26例患者中19例行肝穿病理检查,其中13例(68.4%)表现为胆管周围纤维化,小胆管反应性增生、肝小叶内慢性淤胆、汇管区炎性细胞浸润、纤维组织增生(图2);余下6例(23.1%)无特异性改变。
8 治疗及预后 给予口服熊去氧胆酸(ursodexycholic acid,UDCA)剂量10 ~ 20 mg/(kg·d),其中12例合并胆道感染者给予抗感染治疗,19例胆道狭窄所致胆汁淤积者行ERCP下胆道支架植入术解除胆道梗阻。2例合并自身免疫胰腺炎患者行胆管、胰管支架植入术同时使用激素治疗;8例合并溃疡性结肠炎,皮肤瘙痒给予消胆胺等对症支持治疗。经治疗1个月左右,21例临床症状体征明显改善,2例自身免疫胰腺炎效果不理想,3例肝硬化患者治疗欠佳转科治疗。出院后定期电话随访,随访时间从2006年8月- 2013年2月,26例中4例因肝功能衰竭死亡,5例失访,余下17例仍在随访中。
讨 论
原发性硬化性胆管炎(PSC)是一种慢性胆汁淤积性自身免疫性肝病,主要特征为肝内外胆管的慢性进行炎症及纤维化、进行性发展最终发展为胆汁性肝硬化、门静脉高压、肝脏功能衰竭等[3]。PSC目前具体病因和发病机制不明确,可能与感染、药物、自身免疫、基因变异、血管变异等有关联[4]。研究显示PSC可见于任何年龄,发病平均年龄40岁左右,以男性多见,男女比例为2∶1[5-6],本组患者发病年龄平均(42.5±6.8)岁,男女比例接近2:1,与上述研究基本相符。
PSC临床表现变异性大,发病缓慢隐匿,早期可无明显症状,早期诊断存在一定困难。PSC患者就诊时主要表现为反复发作性黄疸、乏力、纳差、皮肤瘙痒、肝区疼痛、消瘦、疲劳、肝大、腹胀、或伴有畏寒、发热等[3];PSC患者常常合并炎症性肠病(inflammatory bowel disease,IBD),以UC多见,Boonstra[7]大样本研究显示PSC患者66%合并IBD,其中83%为UC。此外,PSC患者也常常合并其它自身免疫性疾病。本组研究显示患者突出表现为黄疸、乏力、纳差、皮肤瘙痒、发热、消瘦、脾肿大,其中8例合并有UC,2例合并AIP。
大量研究表明:ALP、GGT在PSC患者中呈明显升高,但无特异性[3]。当病情进展时部分患者出现总胆红素升高。本组26者中,ALP、GGT、AST、ALT、TBil以轻度升高为主,中位数也呈现升高趋势。Chapman[1]研究显示60%患者会出现IgG升高,50% ~ 80%患者出现ANCA阳性,7% ~ 77%患者出现ANA阳性,13% ~ 20%患者出现SMA阳性。但这些因子的特异性同样不高,但可以为其鉴别诊断提供参考。本组IgG升高18例(69.2%),ANA阳性4例(15.4%),与上述相符,而ANCA阳性9例(34.6%),低于上述研究,可能与本组研究样本量偏少有关。
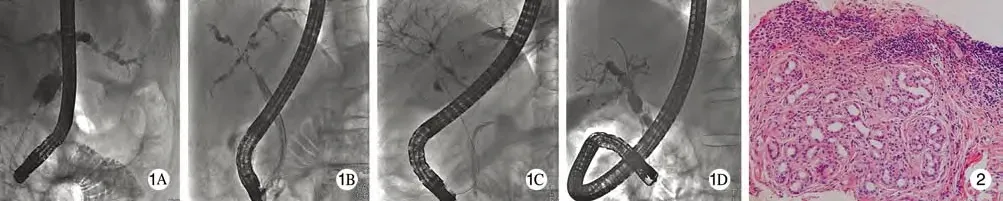
图1 原发性硬化性胆管炎患者ERCP表现 A: 肝内胆管节段扩张并狭窄, 呈串珠样改变; B: 肝门部胆管狭窄、僵硬,肝内胆管轻度扩张;C: 肝内各级胆管呈枯树枝状; D: 总胆管中下段狭窄,上段胆管不规则扩张,肝内胆管僵硬,多发节段性狭窄及扩张图 2 肝纤维组织显著增生、大量炎细胞浸润、小胆管增生明显(HE染色,×200)Fig. 1 ERCP showing segmental stricture and dilatation of intrahepatic bile duct with string-like changes (A), portal bile duct stenosis and stiff and intrahepatic bile duct dilation (B), withered arborization of intrahepatic bile duct (C), and common bile duct stricture and stenosis (D) in PSC patientsFig. 2 Histopathology showing signifcant proliferation of hepatic fbrous tissue, infltration of infammatory cells, and proliferation of small bile duct (HE staining,×200)
目前诊断PSC主要依据影像学,过去认为内镜下逆行胰胆管造影(ERCP)是金标准[8],Bangarulingam[9]认为ERCP是侵入性检查,可导致严重的并发症,而磁共振胰胆管造影(MRCP)为非侵入性检查,可以克服上述缺点。比较MRCP与ERCP对PSC的诊断,其结果显示MRCP相对于ERCP诊断的敏感性、特异性分别80%和87%[10]。因此,PSC指南建议疑似PSC患者首先进行MRCP检查,如果不能确诊可进一步行ERCP检查[1]。对于PSC随访患者可以首选MRCP检查。超声对PSC具有辅助诊断价值,常见的改变为肝内外胆管节段性扩张与狭窄,同时超声检查还有利于评估病情及其相关并发症的诊断和评估。超声内镜对肝外胆管管壁厚度、管径大小的测量及成像有帮助,但对肝内小胆管检查受限[11]。
PSC行肝脏病理检查的典型表现为洋葱皮样改变。但PSC早期病变不具有特异性,洋葱皮样征并非PSC特有。Burak等[12]对138名PSC患者进行回顾性分析,认为病理检查对PSC诊断有限,但病理检查可以为PSC鉴别诊断提供必要的依据。本组病理检查未见明显的洋葱皮样征,但可见胆管周围纤维化,肝小叶内慢性淤胆、汇管区炎性细胞浸润、纤维组织增生。
关于PSC治疗,研究显示低剂量UDCA(13 ~ 15 mg/(kg·d)对改善PSC患者的肝功能有作用,但高剂量使用UDCA(28 ~ 30 mg/(kg·d))不能给患者增加效益,反而增加风险[13-14]。近年发表的大样本临床跟踪研究显示:UDCA虽然在改善肝功能方面有作用,但对预后无作用[15-17]。当PSC患者胆管存在明显狭窄可考虑内镜下治疗,如果严重狭窄,内科治疗不佳,同是患者无肝硬化时,应建议行手术治疗[1]。
综上所述,到目前为止,PSC的病因不明、具体发病机制不清尚无有效的治疗方法。当前治疗的主要目标是减轻症状、防止和积极处理相关并发症、延长患者的生存期。对于终末期的PSC患者,积极准备肝移植,提高患者的生存质量。
1 Chapman R, Fevery J, Kalloo A, et al. Diagnosis and management of primary sclerosing cholangitis[J]. Hepatology, 2010, 51(2):660-678.
2 Chinese Society of Hepatology, Chinese Medical Association,DigestiveDisease Branch of Chinese Medical Association, Analysis of Live biochemicaltests and monitoring consensus (draft)[R]. Chinese medicalassociation ninth national conference on degestive diseases, 2009:38-45.
3 Singh S, Talwalkar JA. Primary sclerosing cholangitis: diagnosis,prognosis, and management[J]. Clin Gastroenterol Hepatol, 2013,11(8):898-907.
4 Pollheimer MJ, Halilbasic E, Fickert P, et al. Pathogenesis of primary sclerosing cholangitis[J]. Best Pract Res Clin Gastroenterol, 2011, 25(6):727-739.
5 Wiencke K, Boberg KM. Current consensus on the management of primary sclerosing cholangitis[J]. Clin Res Hepatol Gastroenterol,2011, 35(12): 786-791.
6 European Association for the Study of the Liver. EASL Clinical Practice Guidelines: management of cholestatic liver diseases[J]. J Hepatol, 2009, 51(2):237-267.
7 Boonstra K, van Erpecum KJ, van Nieuwkerk KM, et al. Primary sclerosing cholangitis is associated with a distinct phenotype of inflammatory bowel disease[J]. Inflamm Bowel Dis, 2012, 18(12):2270-2276.
8 Lee YM, Kaplan MM. Primary sclerosing cholangitis[J]. N Engl J Med, 1995, 332(14):924-933.
9 Bangarulingam SY, Gossard AA, Petersen BT, et al. Complications of endoscopic retrograde cholangiopancreatography in primary sclerosing cholangitis[J]. Am J Gastroenterol, 2009, 104(4):855-860.
10 Berstad AE, Aabakken L, Smith HJ, et al. Diagnostic accuracy of magnetic resonance and endoscopic retrograde cholangiography in primary sclerosing cholangitis[J]. Clin Gastroenterol Hepatol,2006, 4(4): 514-520.
11 Lutz HH, Wasmuth HE, Streetz K, et al. Endoscopic ultrasound as an early diagnostic tool for primary sclerosing cholangitis: a prospective pilot study[J]. Endoscopy, 2012, 44(10): 934-939.
12 Burak KW, Angulo P, Lindor KD. Is there a role for liver biopsy in primary sclerosing cholangitis?[J]. Am J Gastroenterol, 2003, 98(5): 1155-1158.
13 Imam MH, Lindor KD. Primary sclerosing cholangitis: providing a safe and effective treatment[J]. Expert Rev Gastroenterol Hepatol,2012, 6(3): 255-257.
14 Triantos CK, Koukias N, Nikolopoulou V, et al. Ursodeoxycholic acid in primary sclerosing cholangitis[J]. Aliment Pharmacol Ther,2012, 35(5):622-623.
15 Imam MH, Sinakos E, Gossard AA, et al. High-dose ursodeoxycholic acid increases risk of adverse outcomes in patients with early stage primary sclerosing cholangitis[J]. Aliment Pharmacol Ther, 2011,34(10): 1185-1192.
16 Triantos CK, Koukias NM, Nikolopoulou VN, et al. Meta-analysis:ursodeoxycholic acid for primary sclerosing cholangitis[J]. Aliment Pharmacol Ther, 2011, 34(8): 901-910.
17 Lindor KD, Kowdley KV, Luketic VA, et al. High-dose ursodeoxycholic acid for the treatment of primary sclerosing cholangitis[J]. Hepatology, 2009, 50(3): 808-814.
