萃取精馏分离甲醇-苯
2014-04-10高兴娜许宪硕
高兴娜,白 鹏,许宪硕
(天津大学化工学院,天津 300072)
甲醇和苯是重要的有机溶剂,在精细化工、医药等领域有着广泛的使用。生产过程中形成甲醇-苯混合物废液,直接排放不仅造成经济损失,而且会对环境和生态造成一定的影响和破坏,从经济和环保的角度出发,都要求对甲醇-苯废液进行回收利用。
常压下,甲醇和苯能够形成最低共沸物,共沸温度为57.5 ℃,共沸组成为w(甲醇)39.1%,w(苯)60.9%[1]。普通的精馏方法无法分离共沸物系,需要采用特殊的精馏方法。文献报道用膜分离[2]、加盐萃取精馏[3]和离子液体[4-5]的方法来消除甲醇-苯物系的共沸。其中膜分离中的分离膜和离子液体费用高;加盐萃取精馏技术尤其是盐效应预测理论上还有很多亟待完善的地方,因此工业化的工作没有通用的理论模型作指导,并且设备要求高。而萃取精馏具有设备简单、投资小、操作费用少、通用性强、可用同一塔处理不同种类和组成的物系等优点,特别适用于化工、制药等产品更新较快的场合。
本研究对甲醇-苯二元混合物系,测定其在常压下的汽液平衡组成,采用UNIFAC[9-10]模型及Antoine方程计算平衡时甲醇的汽液相组成,并通过基团贡献法[6-7]计算选择出适宜萃取剂氯苯。为验证氯苯作为萃取剂的分离效果,进行了间歇精馏实验。由于间歇精馏处理量小,工业上通常采用连续精馏,因此,对甲醇-苯二元混合物系进行连续精馏模拟,为工业生产提供一定的基础参考依据。
1 实验部分
1.1 实验装置
1.1.1甲醇-苯汽液平衡实验装置
本实验是在玻璃制的汽相单循环平衡釜中进行,其装置如图1所示,装置由加热釜、沸腾室、平衡室、测温口、采样口和冷凝器构成。
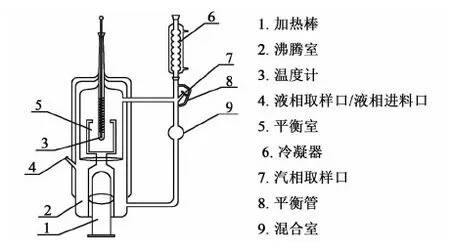
图1 汽液平衡釜Fig.1 Vapor-liquid equilibrium still
1.1.2甲醇-苯间歇萃取精馏实验装置
实验采用普通的间歇萃取精馏装置,如图2所示。
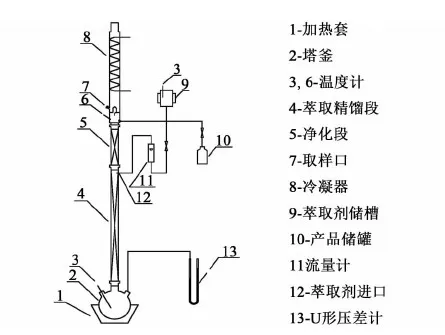
图2 间歇萃取精馏实验装置图Fig.2 Experimental facilities of batch extractive distillation
实验装置主要部分说明如下:1)塔釜为2 000 mL的三口瓶,分别连接精馏塔塔身、测温点温度计和U型管压差计,根据U型管压差计的压差大小调节加热套加热电压,进而调节加热功率;2)玻璃塔体为φ30 mm,内装不锈钢θ网环填料(φ3 mm×3 mm)。塔身上段为萃取剂未作用段(精馏段),高度为0.30 m,下段为萃取剂作用段(萃取段),高度为1.2 m;为传热和传质发生的场所;3)回流比控制器连接电磁铁用来控制精馏过程中的回流比大小,进而控制塔顶物料的采出;4)溶剂由高位槽经转子流量计和阀门,以一定流速进入塔内。
1.2 实验物系
1.2.1甲醇-苯汽液平衡实验物系
本实验选用甲醇质量分数分别为5%~95%的甲醇-苯溶液为原料,加入溶剂氯苯配制成溶剂与原料物质的量之比为1∶1的混合溶液。在正确的操作条件下,使整个体系达到稳定,并维持2 h,分别在汽液相取样口取样,并用气相色谱仪测定其组成。
1.2.2甲醇-苯间歇萃取精馏实验物系
本实验原料液为甲醇质量分数35%的甲醇-苯溶液,体积为500 mL,加入溶剂氯苯,在一定回流比、溶剂流率下,考察溶剂对分离效果的影响及其塔顶产品浓度。
1.3 分析方法
定量分析的仪器是鲁南瑞红SP-6890型气相色谱仪,数据处理的工作站为浙江大学N2000色谱工作站,使用相对校正因子法对色谱采集的浓度数据进行校正。
分析条件:色谱柱为GDX-102,规格φ3 mm×2 m。汽化室温度160 ℃,检测室温度160 ℃,柱室温度60 ℃,载气为N2,柱前压为0.20 MPa,检测器为氢火焰检测器。
2 实验结果与讨论
2.1 萃取剂的选择
运用基团贡献法[6-7]并结合经验初步选择乙二醇、DMF、水和氯苯作为预选的溶剂。在甲醇-苯共沸组成下,按照溶剂比(物质的量之比:氯苯/甲醇-苯混合物)1∶1加入溶剂,计算加入溶剂后二元物系的相对挥发度[7],最终计算出二元物系相对挥发度的理论值为: DMF 1.206,乙二醇1.352,水1.623,氯苯3.128。从计算结果中可以看出:在相同的溶剂比下,氯苯作为萃取剂时的甲醇-苯的相对挥发度在理论计算值中最大,并且氯苯与二元物系的溶解度也比较大。故综合考虑,选取氯苯作为甲醇-苯二元共沸体系萃取精馏的有效萃取剂。
2.2 甲醇-苯的汽液平衡关系
对甲醇-苯二元共沸物系,利用汽液平衡釜测定常压下的甲醇-苯二元物系的等压汽液平衡数据,将该实验数据、Gmehling[8]发表的等压汽液平衡数据及采用UNIFAC[9-10]模型及Antoine方程计算平衡时甲醇的汽液相组成的结果进行比较,结果如图3所示。
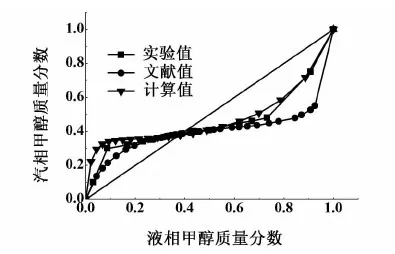
图3 甲醇-苯汽液平衡相图Fig.3 Gas-liquid equilibrium phase diagram of methanol and benzene
由图3可得,本实验装置和实验方法可行,甲醇-苯二元物系汽液平衡采用改进的UNIFAC热力学方程亦是可行的。通过实验测定溶剂比(物质的量之比:氯苯/甲醇-苯混合物)0.8,1.0和2.0下甲醇-苯的汽液平衡关系,经色谱校正因子校正得图4。
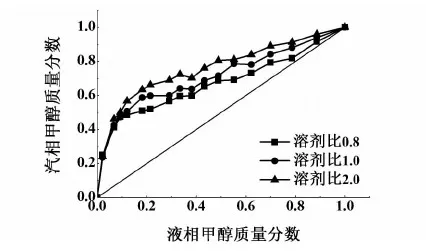
图4 不同溶剂比下汽液平衡相图Fig.4 Gas-liquid equilibrium phase diagram under different solvent ratio
由图4可看出,加入氯苯的溶剂比为0.8时,虽能打破二元共沸物的共沸组成,但是在高浓度区,甲醇-苯的相对挥发度比较小,分离比较困难;加入氯苯的溶剂比为1.0时,可以很大程度上改变其二元组分的相对挥发度;加入氯苯的溶剂比为2.0时,同样大大地增加了甲醇-苯二元组分的相对挥发度,但是相对溶剂比是1.0时的分离效果没有特别明显的优势,所以综合考虑,溶剂比为1.0时更加适宜。
2.3 间歇萃取精馏实验结果
间歇精馏塔为填料塔,塔板数为30块理论板,溶剂进口在靠近塔顶的第4块理论板处,压降控制在300 Pa,实验考察了回流比为2~5(溶剂物质的量之比为1.0)、溶剂进料流率(R=3)情况下,间歇萃取精馏过程中塔顶馏分质量分数的变化规律。图5是氯苯为溶剂,回流比分别为2、3、4、5时,甲醇-苯共沸物系进行萃取精馏实验所得到的结果。图6是氯苯为溶剂,回流比为3,改变溶剂进料流率,对甲醇-苯共沸物系进行萃取精馏实验所得到的结果。
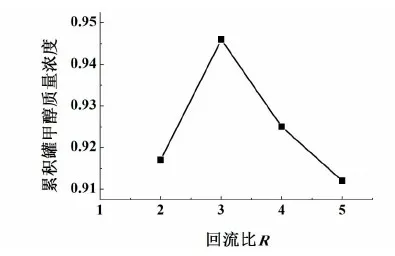
图5 回流比对产品纯度的影响Fig.5 Effect of reflux ratio on methanol mass fraction
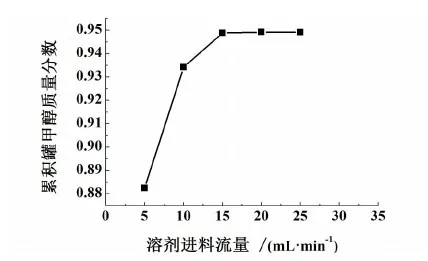
图6 萃取溶剂流率对产品纯度的影响Fig.6 Effect of solvent flow rate on methanol mass fraction
由图5可看出,在回流比为2~3之间时,塔顶馏分中轻组分的浓度随回流比的增大而增大;在回流比为3之后,由于溶剂加入量不变,每块塔板上液体量增多,导致溶剂比减小,溶剂的作用减弱,而导致精馏塔分离效率的下降。所以,在萃取精馏塔操作时,存在一个最适宜回流比的范围,本实验选取回流比为3。
由图6可看出,当溶剂进料流率较低即溶剂比较小时,随着溶剂进料流率的增加,塔顶甲醇浓度呈现快速的增长的趋势;但当溶剂流率增加至15 mL/min以后即溶剂比为1.0时,随着溶剂流率的增加,甲醇浓度增加效果不显著,基本维持不变。过高的溶剂流量不仅会浪费原料,还会造成塔内热负荷过高,增加溶剂回收塔的负担,同时增加了操作和设备成本,不利于综合效率的提高。因此,综合考虑溶剂比选择1.0比较合适。
2.4 连续萃取精馏模拟结果
2.4.1连续萃取精馏流程
以氯苯作为萃取剂,连续分离甲醇-苯二元共沸物系的工艺流程图见图7。模拟原料进料量为100 kmol/h,甲醇摩尔分数为50%,进料温度为298.15 K;萃取剂为氯苯纯溶剂,进料温度为353.15 K;萃取精馏塔的理论塔板数为30,溶剂回收塔的理论塔板数为20,两塔操作压力均为常压101.3 kPa。
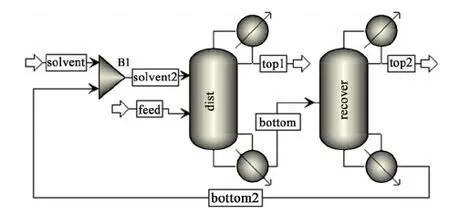
图7 连续萃取精馏工艺流程图Fig.7 Flowsheet of continuous extractive distillation
2.4.2萃取精馏塔回流比对塔顶甲醇纯度的影响
用Aspen Plus分析了回流比R的变化对萃取精馏塔塔顶甲醇纯度的影响,结果如图8。
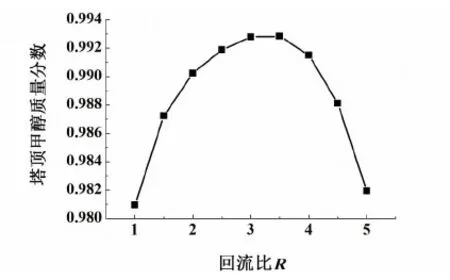
图8 回流比对产品纯度的影响Fig.8 Effect of reflux ratio on methanol mass fraction
由图8可看出,在回流比小于3时,随着回流比的增加,产品纯度增加,并且增加速率较大;但当回流比大于3时,随着回流比的增加,塔顶产品纯度却迅速下降。这是由于溶剂加入量不变,每块塔板上液体量增多,导致溶剂比减小,溶剂的作用减弱,而导致精馏塔分离效率的下降。因此,当R=3时比较合适。
2.4.3萃取剂流量对塔顶甲醇纯度的影响
用Aspen Plus分析了萃取剂流量的变化对萃取精馏塔塔顶甲醇纯度的影响和萃取精馏塔内甲醇、苯和氯苯的浓度分布,结果分别如图9和图10。
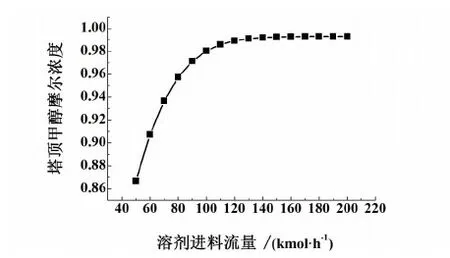
图9 萃取溶剂流量对产品纯度的影响Fig.9 Effect of solvent flow rate on methanol mass fraction
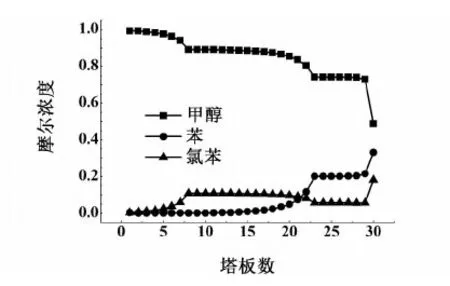
图10 萃取精馏塔内甲醇、苯和氯苯的浓度分布图Fig.10 Composition profiles of methanol, benzene and chlorobenzene in the extractive distillation column
由图9可看出,当溶剂比较小即溶剂进料流率较低时,随着溶剂进料流率的增加,塔顶甲醇浓度呈现快速的增长的趋势;但当溶剂流率增加至120 kmol/h以后即溶剂比为1.2时,随着溶剂流率的增加,甲醇浓度增加效果不显著,基本维持不变。
3 结论
1) 采用UNIFAC模型对常压下甲醇-苯二元物系进行计算,计算结果与实验结果相吻合,说明在常压条件下模拟以氯苯为萃取剂甲醇-苯二元物系的萃取精馏时可以采用UNIFAC模型进行模拟。并通过汽液平衡实验确定最适宜溶剂比是1.0。
2) 对甲醇-苯物系进行了间歇萃取精馏实验,实验中填料塔的理论塔板数是30,其中净化回收段理论板数是4,回流比是3,溶剂物质的量之比是1.0时,塔顶甲醇的回收率是98%。
3) 采用Aspen Plus模拟软件,对甲醇-苯二元物系进行连续萃取精馏模拟研究。在优化的模拟工艺参数条件下,萃取精馏塔塔顶甲醇质量分数达到99.2%。该连续模拟结果为进一步实验研究及工业应用提供理论和实践基础。
参考文献:
[1]程能林.溶剂手册[M].第4版.北京:化学工业出版社,2007
[2]Mandal S, Pangarkar V G. Separation of ethanol-benzene and methanol-toluene mixture by pervaportion: Effects of thermodynamics and structural phenomenon[J]. Journal of Membrance Science, 2002, 201:175-190
[3]Natarajan T S, Srinivasan D. Vapor-liquid equilibrium data for the systems acetone-methanol an methanol-benzene in the presence of dissolve salts[J]. Journal of Chemical Engineering Data, 1980,25:215-218
[4]李群生,Magtuf Z,朱炜,等. 甲醇-苯-1-辛基-3-甲基咪唑四氟硼酸盐物系汽液平衡的测定[J]. 石油化工, 2011, 40(5): 541-544
Li Qunsheng,Magtuf Z, Zhu Wei,etal. The vapor-liquid measurement of methanol-benzene-1-octyl-3-methyl imidazole four fluoroborate system[J]. Petrochemical Technology, 2011, 40(5): 541-544(in Chinese)
[5]李群生,马各土夫,朱炜,等. 甲醇-苯-离子液体等压汽液平衡数据的测定[J].北京化工大学学报, 2011, 38(3):12-16
Li Qunsheng,Magtuf Zuhir, Zhu Wei,etal. The vapor-liquid measurement of methanol-benzene-ionic liquid[J]. Journal of Beijing University of Chemical Technology, 2011, 38(3):12-16(in Chinese)
[6]李秀丽. UNIFAC及其修正模型的评价研究[D]. 山东:青岛科技大学, 2009
[7]李永霞, 秦海洋, 黄雪莉. 萃取精馏的条件及选择萃取剂的研究[J]. 计算机与应用化学, 2009, 26(10):1 324-1 328
Li Yongxia, Qin Haiyang, Huang Xueli. The research of extraction distillation conditions and extractant selection[J]. Computers and Applied Chemistry, 2009, 26(10): 1 324-1 328(in Chinese)
[8]Gmehling, J, Onken U. Vapor-liquid equilibrium data collection; DECHEMA Chemistry data series[M]. DECHEMA: Frankfurt, 1977
[9]Weidlich U, Gmehling J. A modified UNFIAC model(1): Prediction of VLE, hH and γH[J]. Ind Eng Chem Res, 1987, 26(7): 1 372-1 381
[10]Gmehling J, Jiding L, Martin S. A modified UNFIAC model(2): Present parameter matrix and results for different thermodynamic properties[J]. Ind Eng Chem Res, 1993, 32(1): 178-193
