马尾松内生真菌产油脂菌株的分离、筛选和鉴定
2014-04-09邓慧华吴承祯谢安强潘伟彬
邓慧华, 洪 伟, 吴承祯, 谢安强, 潘伟彬, 段 萍
(1. 福建农林大学林学院, 福建 福州 350002; 2. 龙岩市林业科学研究所, 福建 龙岩 364000;3. 福建省高校森林生态系统过程与经营重点实验室, 福建 福州 350002; 4. 武夷学院, 福建 南平354300;5. 闽西职业技术学院, 福建 龙岩 364021)
植物内生真菌泛指那些在其生活史中的某一阶段或在整个生活史中都生活在植物组织内部,但并没有引起植物组织明显病害症状的一类真菌[1-2];大量研究结果表明植物内生真菌能产生与其宿主相同的代谢产物[3-4]。按照协同演化理论[5],宿主植物与其内生真菌长期共生并相互影响,内生真菌极有可能具有与宿主植物相同的次生代谢产物合成途径,其形成机制为:一是相关基因的直接传递,这种传递可发生在寄生生物与寄主间或共生生物与寄主间的相互作用过程中;二是在共同生活的环境中长期接触而传递遗传物质[6-7]。油脂植物内生真菌能否产生与其宿主相同的代谢产物?许多研究者对此进行了相关研究,并从油脂植物内生真菌中筛选出产油菌株。游玲等[8]对油樟〔Cinnamomumlongepaniculatum(Gamble) N. Chao ex H. W. Li〕的产油脂内生真菌进行了初步研究;戴传超等[9]对大戟科(Euphorbiaceae)4种药用植物及其内生真菌的脂肪酸组分进行了比较研究;作者所在的研究团队曾对桉树(Eucalyptussp.)和雷公藤(TripterygiumwilfordiiHook. f.)等树种的内生真菌进行了较为广泛的研究[10-13]。
马尾松(PinusmassonianaLamb.)是国产松属(PinusLinn.)中分布最广的重要用材树种,富含松脂,是中国主要的产脂树种。内生真菌与马尾松协同进化,有可能产生与其宿主相同的代谢产物,但有关马尾松内生真菌产油脂的研究未见报道。为此,作者对马尾松不同部位的内生真菌进行分离,从中筛选出产油脂菌株;并采用形态学和分子生物学鉴定方法对菌种进行初步鉴定,以期为马尾松内生真菌的开发利用奠定研究基础。
1 材料和方法
1.1 材料
马尾松样株种植于福建省漳平五一国有林场,于2011年6月挑选15株生长性状良好、无病虫害症状的健康植株,各株分别采集根、茎和叶片;其中根、茎样品均采集10 cm以上的条段,用沾水的棉花包住根的两端和枝条底部带回实验室,备用。
1.2 方法
1.2.1 内生真菌的分离、培养和菌体收集 参照文献[14-16]采用组织块法分离内生真菌。将马尾松根、茎和叶片分别剪成3~5 cm小段,用蒸馏水冲洗干净后用体积分数75%乙醇表面消毒2~5 min,然后再用体积分数 0.1%HgCl2进一步消毒10~30 s,最后用无菌水冲洗3次。无菌条件下吸干表面水分,用刀片将根和茎切成3 mm×3 mm的小片、将叶片切成3 mm的小段,接入PDA培养基平板上,置于27 ℃培养箱中避光培养3~7 d。待组织块周围长出菌丝后,挑取尖端菌丝移至新的PDA培养基中,逐步纯化获得纯培养物。分离纯化后的菌株接种于斜面培养基上保存、备用。
挑取菌丝块接种于200 mL马铃薯葡萄糖液体培养基中,于27 ℃、125 r·min-1条件下培养7 d;用4层纱布过滤菌体后用蒸馏水充分洗涤,于65 ℃烘干至恒质量,备用。
1.2.2 产油脂菌株的初步筛选 参照文献[17]进行内生真菌油脂含量的初步检测。取少许振荡培养的菌丝,吸干液体培养基后加入苏丹黑染液(参照文献[18]配制)1~2 mL,于室温染色5 min,然后将菌丝用水洗涤5 min;挑取菌丝制作临时装片,镜检观察菌丝内油滴的数量、大小和颜色[7]。
1.2.3 油脂提取及含量测定 用酸热法[19]提取油脂。称取一定量菌体,按1 g 菌体加入10 mL 的比例加入4 mol·L-1HCl,振荡混匀后室温放置30 min,沸水浴处理10 min后立即于-20 ℃速冷30 min;加入2倍体积V(三氯甲烷)∶V(甲醇)=1∶1提取液,充分振荡后于5 000 r·min-1离心5 min;取三氯甲烷层,加等体积质量分数0.1%NaCl溶液,混匀后于 5 000 r·min-1离心5 min;将三氯甲烷层挥发除去溶剂后获得油脂,称取油脂质量。油脂质量与菌体干质量的百分比即为油脂含量[7]。实验重复3次。
1.2.4 菌种的形态学鉴定 挑取纯化的真菌菌丝接种于PDA培养基上,采用3点接种法培养,肉眼观察菌落正反面特征;采用直接挑取制片法或载玻片培养法对孢子进行显微观察。根据菌丝体和孢子的形态特征、参照文献[20]对菌株进行初步鉴定。
1.2.5 菌种的分子生物学鉴定 利用核糖体ITS片段对菌种进行分子生物学鉴定
1.2.5.1 基因组DNA提取 采用CTAB法[21-22]提取基因组DNA,稍作改进。待测菌株用100 mL马铃薯葡萄糖培养液摇瓶培养5~6 d,4层纱布过滤,吸干培养基后将菌丝体冷冻干燥。将干燥的菌丝体在液氮中研磨3次至粉状,加入2 mL事先预热至65 ℃的CTAB提取液及20 μL巯基乙醇,混匀后于65 ℃温浴1 h;加入等体积的V(苯酚)∶V(三氯甲烷)∶V(异戊醇) =25∶24∶1混合液,10 000 r·min-1离心10 min,上清液重复1次上述步骤;于上清液中加入0.7倍体积异丙醇,4 ℃静置10 min后,于10 000 r·min-1离心10 min,沉淀用预冷的体积分数70%乙醇洗涤2次后吸干溶剂,获得的DNA用200 μL DDW溶解;用质量分数0.8%~1.2%琼脂糖(50 mL琼脂糖加入1 μL EB)电泳检测DNA纯度。
1.2.5.2 PCR扩增和测序 参照文献[23]进行ITS片段扩增。PCR扩增引物为真菌核糖体DNA通用引物ITS5(5′-GGAAGTAAAAGTCGTAACAAGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)(上海生工生物技术有限公司),用ABI 9700型PCR仪进行PCR扩增。PCR扩增反应体系总体积25 μL,包含10×PCR Buffer 2.5 μL (Mg2+free)、 50 mmol·L-1Mg2+0.8 μL、10 mmol·L-1dNTPs 0.5 μL、10 μmol·L-1ITS5 0.5 μL、10 μmol·L-1ITS4 0.5 μL、5 U·μL-1PlantinumTaqDNA聚合酶0.2 μL、模板DNA 1 μL和重蒸水 19 μL。 扩增程序为: 95 ℃预变性3 min; 95 ℃变性30 s、55 ℃退火30 s、72 ℃延伸50 s,共38个循环;最后于72 ℃延伸10 min。
PCR产物用质量分数1.5%琼脂糖电泳检测,电泳产物用Axygen凝胶回收试剂盒(美国Axygen公司)回收纯化(操作步骤按照产品说明书进行);纯化产物由上海英骏生物技术有限公司采用ABI 3730型测序仪测序。
将测序得到的ITS片段序列与GenBank核酸数据库中相应的序列进行BLAST分析,利用ClustalX 2.1软件进行多序列比对[24];应用MEGA 5.0软件中的Neighbor-joining(NJ)法构建系统发育树[25-26],自展值设为1 000。
2 结果和分析
2.1 内生真菌分离结果
从马尾松根、茎和叶片中分离出21株不同形态的真菌菌株。其中,从根中分离出4株,占总菌株数量的19.05%;从茎中分离出6株,占总菌株数量的28.57%;从叶片中分离出11株,占总菌株数量的52.38%。从叶片中分离获得的真菌菌株数量最多。
2.2 产油脂菌株的初步筛选及油脂含量比较
鉴定结果显示:在分离获得的21株马尾松内生真菌菌株中,有14株内生真菌的菌丝内有油滴存在;其中,油滴较大较多的3株菌株分别为ZP-1、ZP-2和ZP-3,分别分离自马尾松的叶片、根和茎。
菌株ZP-1、ZP-2和ZP-3的油脂含量见表1。结果显示:菌株ZP-1、ZP-2和ZP-3的平均油脂含量分别为细胞干质量的29.12%、25.03%和30.56%,其中分离自茎的菌株ZP-3的平均油脂含量最高,3株内生真菌的平均油脂含量均在20%以上。方差分析结果表明:在α=0.01水平上,F(2, 6)=10.92,F=96.48, 表明3株菌株的油脂含量差异极显著。
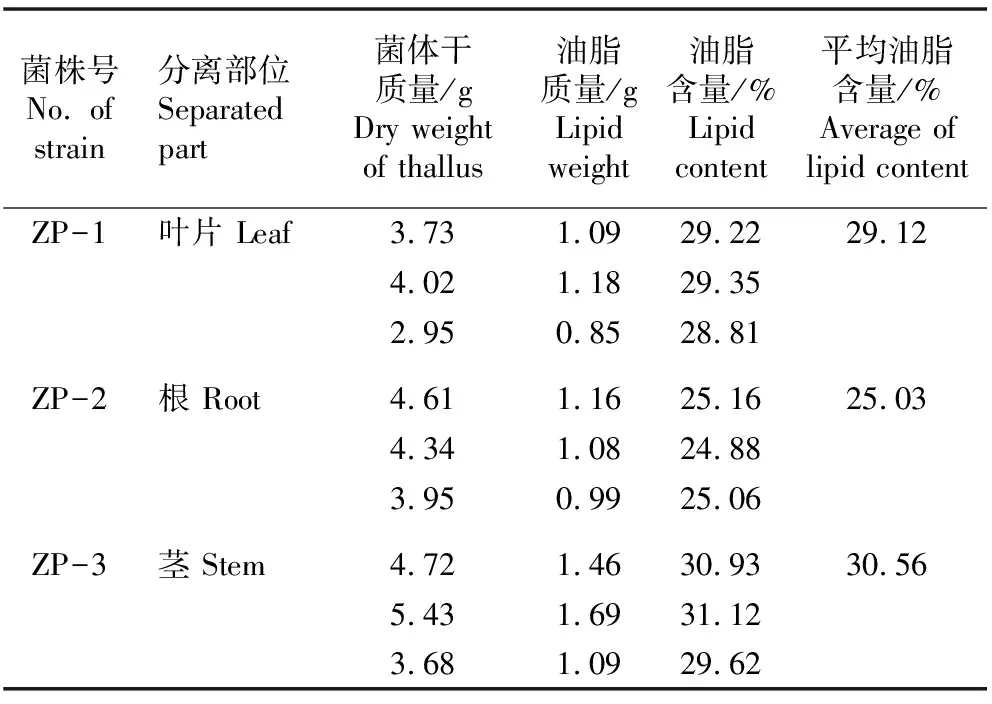
表1 分离自马尾松叶片、根和茎的3株内生真菌油脂含量比较
2.3 菌株的分类鉴定结果
2.3.1 菌株的形态学鉴定结果 分离自马尾松叶片、根和茎的内生真菌菌株ZP-1、ZP-2和ZP-3的菌落形态见图1。菌株ZP-1的菌落呈淡紫色,短绒毛状且较致密;分生孢子梗呈近球形,在菌丝端或短茎上轮生,初步鉴定菌株ZP-1属于拟青霉属(PaecilomycesBainier)。菌株ZP-2的菌落呈白色,绒毛状;分生孢子椭圆形或圆柱形,初步鉴定菌株ZP-2属于生赤壳菌属(BionectriaSpeg.)。菌株ZP-3的菌落呈桃红色,表面潮湿、菌丝密集,气生菌丝发达并呈绒毛状;小型分生孢子呈卵圆形或纺锤形,大型分生孢子呈镰刀形,初步鉴定菌株ZP-3属于镰刀菌属(FusariumLink)。

1. 菌株ZP-1菌落正面 Colony front of strain ZP-1; 2. 菌株ZP-1菌落背面 Colony back of strain ZP-1; 3. 菌株ZP-2菌落正面 Colony front of strain ZP-2; 4. 菌株ZP-2菌落背面 Colony back of strain ZP-2; 5. 菌株ZP-3菌落正面 Colony front of strain ZP-3; 6. 菌株ZP-3菌落背面 Colony back of strain ZP-3.
2.3.2 菌株的分子生物学鉴定结果 用真菌通用引物ITS5和ITS4对分离自马尾松叶片、根和茎的内生真菌菌株ZP-1、ZP-2和ZP-3的核糖体DNA ITS片段进行扩增,获得的ITS序列与GenBank中的相关序列进行比对分析。研究结果表明:菌株ZP-1与拟青霉属种类的ITS序列相似性达到99%;菌株ZP-2与生赤壳菌属种类的ITS序列相似性达到99%;菌株ZP-3与镰刀菌属种类的ITS序列相似性达到99%。Landeweert等[27]认为:ITS序列相似性大于或等于99%,鉴别为相同种;ITS序列相似性大于95%但小于99%,鉴别为相同属;ITS序列相似性序列相似性小于或等于95%,鉴别为相同科。根据这一标准,可对3株菌株的菌种进行鉴定。
菌株ZP-1、ZP-2和ZP-3与相似真菌的NJ系统树分别见图2、图3和图4。在各自的系统树上菌株ZP-1与Purpureocilliumlilacinum(KC790527.1) 聚在同一个分支(图2), 菌株ZP-2与Bionectriasp. EXMQ-9 (FJ233188.1)聚在同一个分支(图3), 菌株ZP-3与Fusariumsp. JJP-2009a (FJ210605.1)和Fusariumsp. R2 (JX391934.1)聚在同一个分支(图4),表明它们之间均有密切的亲缘关系。
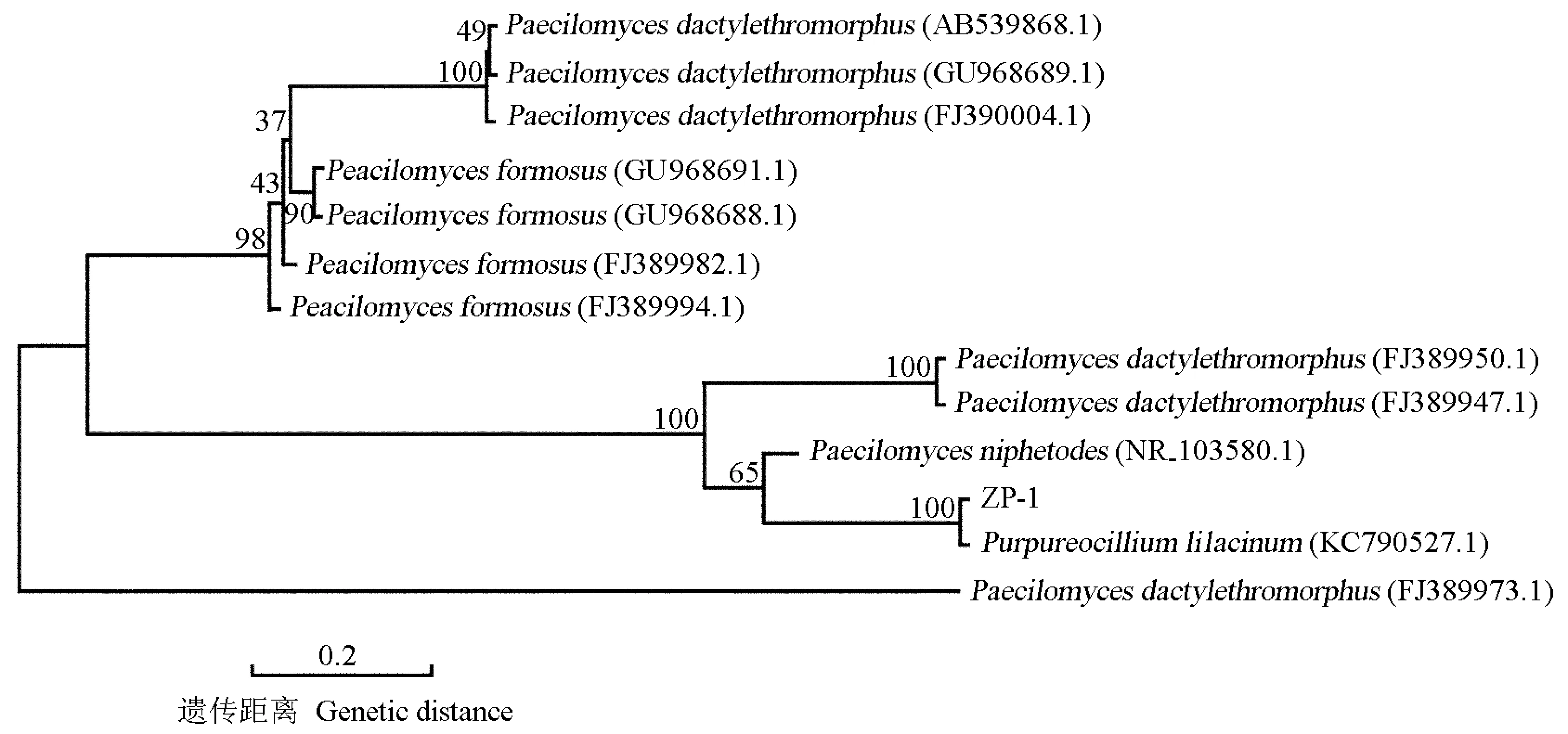
分支上的数值代表1 000次重复抽样检测的自展支持率 The datums on the branches indicate the bootstrap value of 1 000 replications.
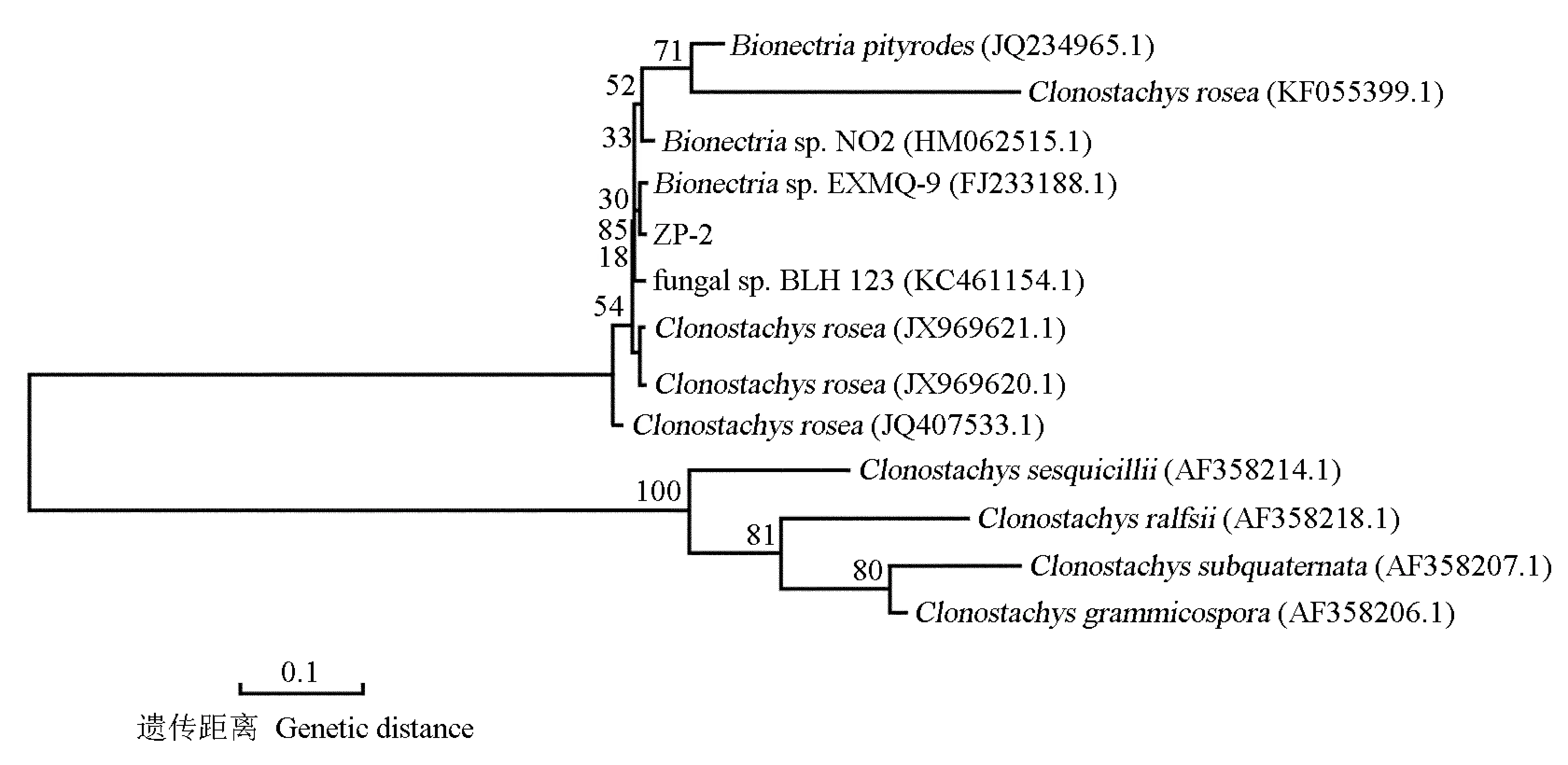
分支上的数值代表1 000次重复抽样检测的自展支持率 The datums on the branches indicate the bootstrap value of 1 000 replications.

分支上的数值代表1 000次重复抽样检测的自展支持率 The datums on the branches indicate the bootstrap value of 1 000 replications.
综合分析分子生物学和形态学鉴定结果,初步鉴定菌株ZP-1属于半知菌亚门(Deuteromycotina)丝孢纲(Hyphomycetes)丝孢目(Hyphomycetales)丝孢科(Hyphomycetaceae)拟青霉属菌种;菌株ZP-2属于子囊菌门(Ascomycota)子囊菌纲(Ascomycetes)肉座菌目(Hypocreales)生赤壳科(Bionectriaceae)生赤壳菌属菌种;菌株ZP-3属于镰刀菌属,镰刀菌属又称镰孢霉属,无性时期属于半知菌亚门(Deuteromycotina)丝孢纲(Hyphomycetes)瘤座孢目(Tuberculariales)瘤座孢科(Tuberculariaceae),有性时期属于子囊菌亚门(Ascomycota),有性态常为赤霉属(GibberellaSacc.)。
3 讨 论
上述研究结果表明:马尾松不同器官内生真菌的数量差异较大,其中从叶片中获得的内生真菌菌株数量多于根和茎,这与其他树种不同器官内生真菌的分布规律有差异。宋萍等[13]的研究结果显示:从雷公藤枝中分离获得的内生真菌菌株数量多于根和叶;高智辉等[28]的研究结果显示:在核桃(JuglansregiaLinn.)的根、茎和叶中,从茎部获得的内生真菌最多,从根部获得的内生真菌最少;窦学娥[29]从桑树(MorusalbaLinn.)根部分离获得的内生真菌数量最多,茎部次之,桑树叶片中内生真菌最少。在马尾松内生真菌的分离过程中,由于其根和茎会分泌较多油脂,阻碍了根、茎组织块与PDA培养基的接触,而且散布在培养基表面的油脂对内生真菌的生长也不利,因而,从马尾松根和茎获得的内生真菌较少。而从马尾松根部获得的内生真菌数量最少,与根系分泌物对根际微生物生长的影响有一定关系[12]。如何消除马尾松根、茎内油脂分泌对内生真菌分离的影响?则有待进一步研究。
植物内生真菌的数量和种类还与寄主植物种类、生长年限、生长环境、气候条件、取样时间、取样数量以及分离方法等因素有关。本研究中,由于采样数量和采样地点有限,马尾松内生真菌的数量和种类也存在一定的局限性。
内生真菌与宿主长期协同进化,极有可能具有与宿主植物相同的次生代谢产物合成途径,所以,从油脂植物内生真菌中寻找产油菌株是一条可行的途径[7]。马尾松富含松脂,是中国主要产脂树种,内生真菌与马尾松长期共生,可能产生与其宿主相同的代谢产物。研究结果表明:马尾松内生真菌中存在大量产油菌株,其中的菌株ZP-1、ZP-2和ZP-3的油脂含量均在20%以上。一般认为,油脂含量超过其生物体总量20%的微生物为产油微生物[30],因而,马尾松内生真菌菌株ZP-1、ZP-2和ZP-3可确定为产油脂内生真菌,它们是可用于微生物油脂生产的物种新资源,为进一步开发生物柴油的新油源奠定了基础。但这些菌株所产油脂的化学组成是否与松脂相似?是否可以直接用马尾松内生真菌的油脂提取物研制松脂?则有待进一步研究。内生真菌在植物生长发育和系统演化过程中有重要作用,其代谢物能够促进植物生长并能增强植物的抗逆性,但产油脂内生真菌与马尾松松脂产生的关系则有待进一步确定。
参考文献:
[1] PETRINI O.Fungal endophytes of tree leaves[M]∥ANDREWS J H, HIRANO S S. Microbial Ecology of Leaves. New York: Springer-Verlag, 1991: 179-197.
[2] GANLEY R J, BRUNSFELD S J, NEWCOMBE G. A community of unknown, endophytic fungi in western white pine[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(27): 10107-10112.
[3] 邹文欣, 谭仁祥. 植物内生菌的生物与次生产物多样性及其潜在应用价值[M]∥李承森. 植物科学研究进展: 第2卷. 北京: 高等教育出版社, 1999: 183-190.
[4] GUO L D, HYDE K D, LIEW E C Y. Detection and taxonomic placement of endophytic fungi within frond tissues ofLivistonachinensisbased on rDNA sequences[J]. Molecular Phylogenetics and Evolution, 2001, 20(1): 1-13.
[5] ROTH J, LEROITH D, COLLIER E S, et al. The evolutionary origing of intercelluar communication and the Maginot Lines of the mind[J]. Annals of the New York Academy of Science, 1986, 436: 1-11.
[6] 谷 苏, 邵 华, 蒋晓华, 等. 药用植物内生真菌多样性及其活性成分的潜在应用价值[J]. 中国药学杂志, 2001, 36(1): 14-15.
[7] 彭小伟, 陈洪章. 南方红豆杉内生真菌产油及降解纤维素的研究[J]. 菌物学报, 2005, 24(3): 457-461.
[8] 游 玲, 王 松, 魏 琴, 等. 油樟内生真菌产油脂初步研究[J]. 工业微生物, 2010, 40(1): 60-63.
[9] 戴传超, 余伯阳, 徐增莱, 等. 大戟科4种药用植物及其内生真菌脂肪酸组分研究[J]. 中国中药杂志, 2001, 26(9): 592-595.
[10] 谢安强, 洪 伟, 吴承祯. 桉树内生菌对尾巨桉幼苗抗寒生理指标的影响[J]. 林业科学, 2012, 48(6): 170-174.
[11] 谢安强, 洪 伟, 吴承祯, 等. 10株桉树内生真菌对尾巨桉(E.urophylla×E.grandis)光合作用的影响[J]. 福建林学院学报, 2011, 31(1): 31-37.
[12] 李 键, 唐佳栋, 吴承祯, 等. 雷公藤根际微生物特征研究[J]. 中国生态农业学报, 2011, 19(4): 878-882.
[13] 宋 萍, 洪 伟, 吴承祯, 等. 雷公藤内生真菌的分离及抗肿瘤活性研究[J]. 北华大学学报: 自然科学版, 2009, 10(4): 310-313.
[14] 吴晓菡, 李文超, 秦路平. 天目山山胡椒不同部位内生真菌组成及多样性分析[J]. 植物资源与环境学报, 2012, 21(2): 107-113.
[15] 袁秀英, 白红霞, 白玉明, 等. 杨树内生真菌的分离和拮抗生防菌的筛选[J]. 林业科学研究, 2006, 19(6): 713-717.
[16] 李 永, 朴春根, 贺 伟, 等. 2个欧美杨品种树皮内生真菌多样性及优势种群动态变化[J]. 林业科学, 2013, 49(6): 90-96.
[17] 刘吉华, 袁 生, 戴传超. 一种新的丝状真菌油脂含量快速鉴定方法[J]. 生物技术, 1998, 8(1): 43-44.
[18] 诸葛健, 王正祥. 工业微生物技术手册[M]. 北京: 中国轻工业出版社, 1994: 209-213.
[19] 李植峰, 张 玲, 沈晓京, 等. 四种真菌油脂提取方法的比较研究[J]. 微生物学通报, 2001, 28(6): 72-75.
[20] 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1982.
[21] 黄文瑜. 马尾松内生真菌诱导植物对病原菌的抗性及其作用机制的研究[D]. 厦门: 厦门大学生命科学院, 2008: 28-30.
[22] 范文洁, 洪 伟, 李 键, 等. 雷公藤总DNA提取方法的研究[J]. 福建林学院学报, 2011, 31(1): 8-12.
[23] WHITE T J, BRUN T, LEE S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetic[M]∥INNIS M A, GLEFAND D H, SNINSKY J J, et al. PCR Protocols: A Guide to Methods and Application. New York: Academic Press, 1990: 315-322.
[24] Thompson J D, Higgins D G, Gibson T J. CLUSTAL W: improving the sensitivity of progressive multiple sequence alignments through sequence weighting, position-specific gap penalties and weight matrix choice[J]. Nucleic Acids Research, 1994, 22(22): 4673-4680.
[25] Hall T A. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT[J]. Nucleic Acids Symposium, 1999, 41: 95-98.
[26] TAMURA K, DUDLEY J, NEI M, et al. MEGA4: molecular evolutionary genetics analysis (MEGA) software version 4.0[J]. Molecular Biology Evolution, 2007, 24(8): 1596-1599.
[27] LANDEWEERT R, LEEFLANG P, KUYPER T W, et al. Molecular identification of ectomycorrhizal mycelium in soil horizons[J]. Applied and Environmental Microbiology, 2003, 69(1): 327-333.
[28] 高智辉, 翟梅枝, 王云果, 等. 核桃内生真菌的分离鉴定[J]. 西北林学院学报, 2012, 27(5): 121-123.
[29] 窦学娥. 桑树内生真菌的分离鉴定及产油菌MacrophominaphaseolinaMOD-1的研究[D]. 泰安: 山东农业大学林学院, 2008: 22-27.
[30] RATLEDGE C, WYNN J P. The biochemistry and molecular biology of lipid accumulation in oleaginous microorganisms[J]. Advances in Applied Microbiology, 2002, 51: 1-51.
