甲泼尼龙琥珀酸钠、环磷酰胺、甲氨蝶呤穿透神经精神狼疮患者血脑屏障的能力
2014-04-08张奉春
陆 慧,郑 昕,胡 蓓,张奉春#
(首都医科大学宣武医院神经内科,北京 100053)
神经精神狼疮(neuropsychiatric systemic lupus erythematosus,NPSLE)是指系统性红斑狼疮(systemic lupus erythematosus,SLE)神经系统损害相关的神经精神表现,其发病率为14%~75%[1]。目前,国内NPSLE急性期主要采用大剂量甲泼尼龙琥珀酸钠(methylprednisolone sodium succinate,MPSS)500~1 000 mg/d或加用环磷酰胺(cyclophosphamide,CP)静脉冲击,联合鞘内注射甲氨蝶呤(methotrexate,MTX)和地塞米松的治疗方案。
与正常人相比,NPSLE患者的血脑屏障易受破坏或发生通透性改变,药物穿透血脑屏障进入脑脊液的程度可能有所改变。但是,目前对于NPSLE患者激素和免疫抑制剂穿透血脑屏障的研究相对较少,现行的治疗方案在脑脊液局部是否可以有效尚缺乏可靠证据支持。本研究拟通过前瞻性研究方法,收集NPSLE患者血液及脑脊液样本,建立在人血浆与脑脊液中MPSS、CP和MTX的定量分析方法并测定其浓度,评价这3种药物穿透NPSLE患者血脑屏障的能力。
材料和方法
样本收集及分组
全部患者均来自2011年12月至2012年5月北京协和医院住院且均确诊为NPSLE患者。诊断参考1999年美国风湿病协会(American College Of Rheumatology,ACR)NPSLE命名和定义分类标准。所有患者均因病情需要正在接受3种方案(静脉滴注MPSS、静脉滴注CP和口服MTX)中1种或多种治疗,试验期间收集其血液及脑脊液样本。所有患者均自愿签署知情同意书。
试验用药
MPSS组:注射用MPSS粉末,比利时辉瑞医药公司生产。MPSS粉末溶于100 ml/250 ml葡萄糖溶液中,每位受试者一次静脉滴注40或500或1 000 mg MPSS,滴注速度为40~60滴/min,输注时间至少为30 min。
CP组:注射用CP粉末(0.2 g/瓶),中国江苏恒瑞医药股份有限公司生产。每位受试者一次静脉滴注0.4或0.8 g CP。给药前1周内未使用过CP。CP粉末溶解于100 ml生理盐水中,滴注速度为40~60滴/min,输注时间至少滴注30 min。
MTX组:MTX片剂(2.5 mg/片),中国上海信谊制药厂生产。每位受试者一次口服10 mg或15 mgMTX,服药前1周内未使用过MTX。
仪器及试剂
仪器:超高效液相色谱仪(美国Waters公司)。
对照品:琥珀酸甲泼尼龙(中国食品药品检定研究院),环磷酰胺(中国食品药品检定研究院),甲氨蝶呤(中国食品药品检定研究院)。
内标:4′-氨基苯乙酮(美国Sigma Inc.公司)
试验方法
按药物在血浆和脑脊液中达峰时间采集样本,并测定其浓度。
血液样本采集:MPSS组分别于静脉滴注30 min和6 h后采集静脉血样本各3 ml;CP组于静脉滴注60 min后采集静脉血样本3 ml;MTX组于口服100 min后采集静脉血样本3 ml。采血均采用血浆肝素锂抗凝管。静脉血样本于4℃、1 500转/min×15 min条件下分离得到血浆,放置于-80℃冰箱冻存备用。MPSS组以MPSS和甲泼尼龙(methylprednisolone,MP)浓度之和表示。
脑脊液样本采集:MPSS组于静脉滴注6 h后采集脑脊液样本1 ml;CP组于静脉滴注60 min后采集脑脊液样本1 ml;MTX组于口服100 min后采集脑脊液样本1 ml。脑脊液样本放置于-80℃冰箱冻存备用。
浓度测定:建立超高效液相色谱/质谱串联(ultra performance liquid chromatography-mass spectrometry/mass spectrometry, UPLC-MS/MS)定量方法并对其进行了考核,同时确认血浆中MPS、CP和MTX的稳定性。
统计学处理
采用SPSS 19.0、Analys(美国AB Sciex公司)、SAS(美国SAS公司)软件。P<0.05为差异有统计学意义。
结 果
基础资料
共纳入MPSS组14例,CP组10例,MTX组11例患者,均为女性。
MPSS组
MPSS组样本血浆和脑脊液MPSS+MP峰值浓度为0.11%~3.72%,均值为(0.75%±0.90%)。3.72%为超出±3倍标准差的离群值,考虑为测量误差或个体差异所致,予以舍弃。剔除异常数据,峰值浓度比为0.11%~1.00%,均值为(0.52%±0.30%)(表1)。
相关系数矩阵及检验,给药6 h后血浆与脑脊液MPSS+MP浓度存在线性关系,回归方程为Y=0.131X+1.043,R=0.929,P=0.000,相关系数有统计学意义,线性关系显著(图1)。
CP组
CP组脑脊液和血浆峰值浓度为13.73%~32.94%,平均值为(22.74%±7.42%)(表2)。同期血浆和脑脊液CP浓度无正相关性。

表1 14例甲泼尼龙琥珀酸钠组患者用药后血浆及脑脊液甲泼尼龙琥珀酸钠+甲泼尼龙浓度

图1甲泼尼龙琥玻酸钠组患者给药6 h后血浆与脑脊液甲泼尼龙琥珀酸钠+甲泼尼龙浓度线性图
Fig1Linear graph of methylprednisolone sodium succinate + methylprednisolone concentrations in plasma and cerebrospinal fluid after 6h in methylprednisolone sodium succinate group
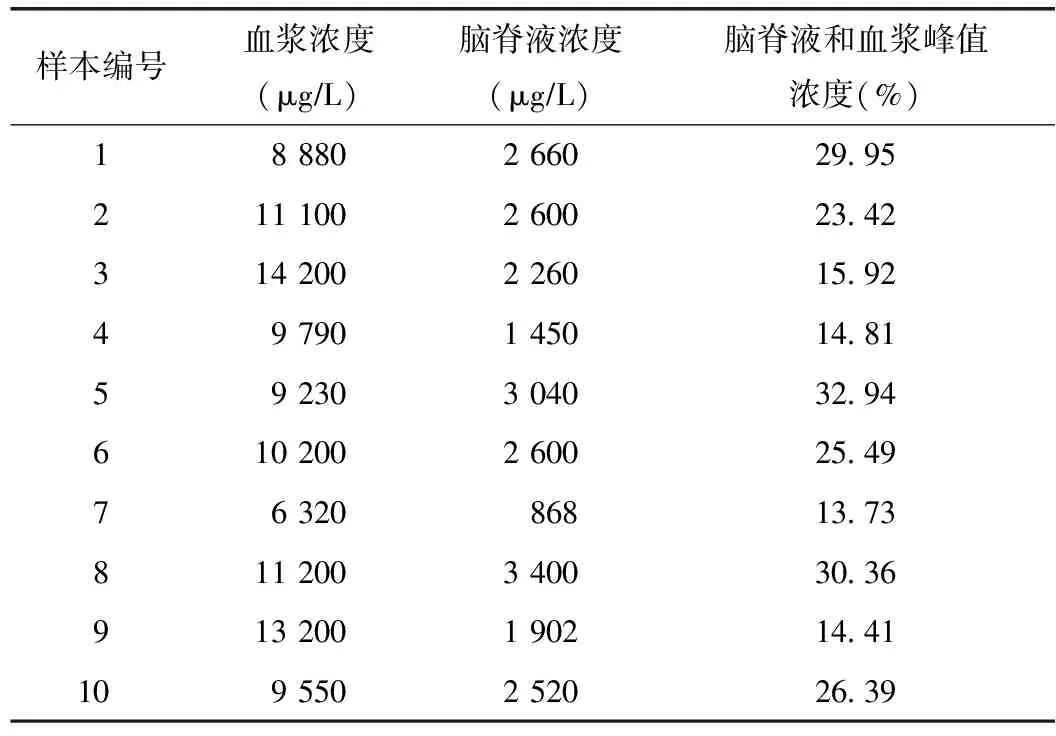
表2 10例环磷酰胺组患者血浆和脑脊液环磷酰胺浓度
MTX组
MTX组脑脊液与血浆峰值浓度为0~28.82%,均值为(2.78%±8.65%)(表3)。28.82%为超出±3倍标准差的离群值,予以舍弃。剔除异常数据后峰值浓度比为0~1.52%,平均值为(0.18%±0.48%)。同期血浆和脑脊液MTX浓度无正相关性。
讨 论
本研究为前瞻性、随机的药物试验,收集了MPSS、CP和MTX患者血液及脑脊液样本,建立人血浆和脑脊液中MPS、CP和MTX的UPLC-MS/MS定量测定方法。方法学考核的各项结果均符合国家食品药品监督管理总局(China Food and Drug Administration, CFDA)指导原则及本实验室标准操作程序(standard operating procedures,SOP)的相关规定。

表3 11例甲氨蝶呤组患者血浆和脑脊液甲氨蝶呤浓度
ND:未测出
文献报道,无论何种给药方式,MPSS的药代动力学模型均为线性。血浆浓度达峰时间约30 min,脑脊液浓度约6 h达峰[2-10]。1个MPSS分子进入静脉后立刻水解为1个琥珀酸甲泼尼龙基团和1个钠离子,1个琥珀酸甲泼尼龙基团再继续分解为1个MP分子和1个琥珀酸基团,根据这一原理,计算MPS和MP浓度之和即可反映MPSS在体内的形式。CP血浆浓度达峰时间为30~60 min,脑脊液浓度达峰时间为50~60 min,脑脊液浓度约为血浆浓度的20%[11-14]。MTX口服方式下血浆浓度约1~2 h达峰,目前尚无文献报道MTX口服后脑脊液的达峰时间。有报道称在急性淋巴细胞白血病的患儿中,静脉大剂量使用MTX约100 min后脑脊液浓度达峰[15-17]。
本研究结果显示,MPSS穿透血脑屏障的比率为(0.52%±0.30%),MTX穿透血脑屏障的比率为(0.18%±0.48%),提示该两药穿透血脑屏障能力微弱,临床鞘内注射地塞米松和MTX为合理用药模式。CP穿透血脑屏障的比率为(22.74%±7.42%),提示CP穿透能力相对较高,静脉用药也可在中枢神经系统局部发挥药效。
文献报道,多发性硬化患者静脉滴注1 500 mg MPSS 2 h后血浆浓度与脑脊液浓度之比为150,3 h后该比值为25,约6 h后药物在脑脊液中达峰值,浓度约为522 μg/L[18-21]。本研究按文献报道的峰值浓度时间取样,测得的脑脊液MPS+MP浓度为1.7~50.92 μg/L,远低于上文数据。辉瑞新西兰公司2012年版MPSS说明书提到,NPSLE患者MPSS脑脊液与血浆峰值浓度比值约为5%~6%;而本研究中MPSS脑脊液与血浆峰值浓度比为(0.52%±0.30%),提示MPSS穿透血脑屏障比率低。MPSS为中等极性大分子,分子量为474.54,理论上其穿透血脑屏障的能力较弱,本研究结果与这一理论吻合。另外,血浆6 h与同期脑脊液MPS+MP浓度间存在线性关系,可以通过测量血浆浓度来估计同期脑脊液中的药物浓度,以合理用药,在保证治疗效果的同时,减少药物在局部不良反应。
CP为极性较小的中分子,相对分子质量为261 090,理论上其穿透血脑屏障的能力强于MPSS和MTX。本研究得到的CP脑脊液和血浆峰值浓度百分比与文献结果接近[22]。
MTX为极性分子,被动扩散吸收量较少,脑脊液中浓度更低,所以大部分患者在脑脊液中的浓度几乎检测不出来。本研究结果显示,口服MTX血脑屏障穿透率仅为(0.18%±0.48%),其值很低,提示口服小剂量MTX不能透过或仅能轻微透过血脑屏障。Valesini等[23]于1994年首次报道了同治疗中枢白血病相似的鞘内治疗方法,认为MTX 10 mg和DXM 20 mg鞘内注射治疗神经精神狼疮可发生戏剧性的治疗效果,症状在24 h内得到控制。本研究结果也证实了在NPSLE的治疗中,MTX鞘内注射合理,毒性作用及不良反应小,同时能最大限度地提高疗效。
由于时间、技术有限,本研究未能全面地研究NPSLE患者血浆和脑脊液中MPSS、MTX和CP的药代动力学,试验设计中这3种药物在血浆和脑脊液中的达峰时间仅为根据文献总结而来。但不同个体药物在达峰时间、达峰浓度、代谢速率和药时曲线下面积等方面个体间差异仍很大,本次测量得到的峰值浓度可能存在误差,如果条件允许,可以连续地多时间点同时收集血浆和脑脊液,得到精确的血浆和脑脊液的峰值浓度,这样对比得到的药物穿透能力也更有说服力。若在同一个体上实施脑脊液多点采集有困难,可扩大样本量,将入组患者按时间点分组,不同时间点分组,再进行组间对比,浓度最高的亚组的采集点即可认定为脑脊液的达峰时间。另外,本研究收集的患者多采用联合用药模式,实验中不可避免地会产生不同药物间的相互影响,一种药物可能对另一种药物的分布、代谢和排泄产生协同或拮抗的作用。今后设计此类试验时,可完善入组标准,选择一段时间内只用一个药物治疗的患者,以排除药物间的相互影响。
[1]Hermosillo-Romo D, Brey RL. Diagnosis and management of patients with neuropsychiatric systemic lupus erythematosus (NPSLE)[J].Best Pract Res Clin Rheumatol, 2002,16:229-244.
[2]Daley-Yates PT, Gregory AJ, Brooks CD. Pharmacokinetic and pharmacodynamic assessment of bioavailability for two prodrugs of methylprednisolone[J].Br J Clin Pharmacol, 1997,43:593-601.
[3]Derendorf H, Mollmann H, Krieg M, et al. Pharmacodynamics of methylprednisolone phosphate after single intravenous administration to healthy volunteers[J].Pharm Res, 1991,8:263-268.
[4]Chen TC, Mackic JB, McComb JG, et al. Cellular uptake and transport of methylprednisolone at the blood-brain barrier[J].Neurosurgery, 1996,38:348-354.
[5]Bannwarth B, Schaeverbeke T, Pehourcq F, et al. Prednisolone concentrations in cerebrospinal fluid after oral prednisone.Preliminary data[J].Rev Rhum Engl Ed, 1997,64:301-304.
[6]Al-Habet SM, Rogers HJ. Methylprednisolone pharmacokinetics after intravenous and oral administration[J].Br J Clin Pharmacol, 1989,27:285-290.
[7]Defer GL, Barre J, Ledudal P, et al. Methylprednisolone infusion during acute exacerbation of MS:plasma and CSF concentrations[J].Eur Neurol, 1995,35:143-148.
[8]Bernards CM. Cyclosporine-A-mediated inhibition of p-glycoprotein increases methylprednisolone entry into the central nervous system[J].Spinal Cord, 2006,44:414-420.
[9]Mollmann H, Rohdewald P, Barth J, et al. Pharmacokinetics and dose linearity testing of methylprednisolone phosphate[J].Biopharm Drug Dispos, 1989,10:453-464.
[10] Derendorf H, Mollmann H, Rohdewald P, et al. Kinetics of methylprednisolone and its hemisuccinate ester[J].Clin Pharmacol Ther, 1985,37:502-507.
[11] Arndt CA, Balis FM, McCully CL, et al. Cerebrospinal fluid penetration of active metabolites of cyclophosphamide and ifosfamide in rhesus monkeys[J].Cancer Res, 1988,48:2113-2115.
[12] Yule SM, Price L, Pearson AD, et al. Cyclophosphamide and ifosfamide metabolites in the cerebrospinal fluid of children[J].Clin Cancer Res, 1997,3:1985-1992.
[13] Struck RF, Alberts DS, Horne K, et al. Plasma pharmacokinetics of cyclophosphamide and its cytotoxic metabolites after intravenous versus oral administration in a randomized, crossover trial[J].Cancer Res, 1987,47:2723-2726.
[14] Arndt CA, Balis FM, McCully CL, et al. Cerebrospinal fluid penetration of active metabolites of cyclophosphamide and ifosfamide in rhesus monkeys[J].Cancer Res, 1988,48:2113-2115.
[15] 黄民,赵香兰. 急性淋巴性白血病儿童口服甲氨蝶呤的药代动力学研究[J].癌症, 1991,10:460-462.
[16] 赵帆, 王琦, 赵永新, 等. 大剂量甲氨蝶呤化疗的脑脊液药代动力学研究[J].中德临床肿瘤学杂志(英文版), 2006,5:101-103.
[17] 高晨, 高旻, 史卫忠, 等. 冰片对甲氨蝶呤透过血脑屏障影响的实验研究[J].中国临床药理学杂志, 2009,(02):134-137.
[18] 杜臻雁, 唐福林. 糖皮质激素抗炎作用机制的研究进展[J].中华医学杂志, 2006,86:2512-2515.
[19] Bruyn GA. Controversies in lupus:nervous system involvement[J].Ann Rheum Dis, 1995,54:159-167.
[20] Badsha H, Edwards CJ. Intravenous pulses of methylprednisolone for systemic lupus erythematosus[J].Semin Arthritis Rheum, 2003,32:370-377.
[21] 陆晓晔, 顾越英, 王元. 神经精神狼疮的治疗策略[J].中华临床免疫和变态反应杂志, 2007,1:202-206.
[22] Takada K, Illei GG, Boumpas DT. Cyclophosphamide for the treatment of systemic lupus erythematosus[J].Lupus, 2001,10:154-161.
[23] Valesini G, Priori R, Francia A, et al. Central nervous system involvement in systemic lupus erthematosus:a new therapeutic approach with intrathecal dexamethasone and methotrexate[J].Ann Rew Immunopathol, 1994, 16:313-321.
