系统性红斑狼疮患者血清基质金属蛋白酶水平变化
2014-04-08蒋中才
张 颖,蒋中才
(四川省绵阳市第三人民医院检验科,四川绵阳 621000)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种多发于青年女性的病因未明的自身免疫性结缔组织病。其发病机制是机体对自身抗原的免疫耐受缺失,从而导致淋巴细胞大量活化和增生,自身抗体大量产生和炎性介质的大量释放,最终摧毁多个靶器官[1]。
基质金属蛋白酶(matrix metalloproteinase,MMP)是一组在细胞外基质(extra cellular matrix,ECM)代谢过程中起主要作用的锌、钙离子依赖的蛋白水解酶家族。MMP以无活性的酶原形式分泌,激活后可裂解一种或多种细胞外基质成分,参与人体正常生理过程中ECM的修复和重构。某些MMP表达及分泌异常所引起的组织炎性损伤可能与疾病的病情和预后密切相关[2-6]。因此推测,MMP作为一类炎性介质可能参与了SLE的发病和组织损伤。本研究通过探讨SLE患者血清中MMP-3和MMP-9水平变化与SLE的相关性,了解MMP和SLE的关系,进一步探求SLE发病机制,寻求SLE诊断、预后评价或新的治疗靶分子。
材料和方法
对象及分组
2012年3月至2013年3月四川省绵阳市第三人民医院肾病风湿科门诊及住院SLE患者,诊断均符合美国风湿病学会1997年修订的SLE分类标准。根据SLE疾病活动性指数评分[7-8],参照殷文浩等[9]标准将纳入患者分为SLE活动期组与SLE非活动期组。根据有无累及神经系统、肾脏及关节分为不同病损组,将同时无神经系统、肾脏及关节炎者定义为无器官损害组。对照组均来自本院同期门诊健康体检者。受试者均排除自身免疫性疾病,且无心、肺、肝和肾损伤。
试剂和仪器
仪器:美国BECKMAN ACCESS特定蛋白分析仪,BD680酶标仪(美国Bio-Red公司),荧光显微镜(日本OLYMPUS BX-51),S002型恒温水浴箱(北京长源实验设备厂),TGL-16B高速离心机(上海安亭科学仪器厂),微量加样器(Eppendorf 10~1 000 μl)。
试剂:MMP-3,MMP-9检测试剂盒购自美国R&D Systems公司,采用ABC-ELISA法。抗双链DNA抗体检测试剂盒购自德国欧蒙医学实验诊断有限公司,采用绿蝇短膜虫间接免疫荧光法。
方法
清晨空腹抽取SLE患者及健康体检者静脉血约3 ml,4 000 r/min离心5 min,分离血清,避免溶血。按试剂说明书检测样本MMP-3、MMP-9、双链DNA,补体C3等。将血清MMP-3和MMP-9水平分为5个等级(根据结果极差人工分级),分析该两项水平变化与SLE疾病活动的相关性。
统计学处理
所有数据均通过SPSS11.0统计软件包进行处理。经过SPSS正态性检验,样本近似正态分布,统计量采用(均数±标准差)表示,均数比较用t检验、方差分析。P<0.05为差异有统计学意义。MMP-3和MMP-9水平与SLE活动期组病例数进行Cochran Armitage趋势χ2检验。
结 果
一般资料
共纳入SLE组患者85例,女79例,男6例;年龄17~65岁,平均37.1岁;病程1个月~14年,平均35.1个月。将其中临床资料相对充分的59例患者分为SLE活动期组22例,SLE非活动期组37例。对照组30例,女28例,男2例;年龄21~69岁,平均39.4岁。SLE组和对照组在性别及年龄构成上差异无统计学意义(P>0.05)。
血清MMP-3和MMP-9水平
SLE患者血清MMP-3水平显著高于对照组(P<0.01),血清MMP-9水平显著低于对照组(P<0.05)。
SLE活动期组和SLE非活动期组血清MMP-3水平均高于对照组(P<0.01);SLE活动期组血清MMP-9水平低于SLE非活动期组和对照组(P<0.05,P<0.01)。其余各组比较差异无统计学意义(均P>0.05)(表1)。
SLE活动期组血清MMP-3和MMP-9水平
Cochran Armitage趋势χ2检验显示,血清MMP-3水平与SLE活动期患者比例无明显相关(χ2=1.089,P>0.05)(表2);而随着血清MMP-9水平降低,SLE活动期患者比例升高(χ2=9.614,P<0.01)(表3)。

表1 SLE活动期与非活动期患者血清基质金属蛋白酶-3和基质金属蛋白酶-9水平
SLE:系统性红斑狼疮;与对照组相比,*P<0.05,#P<0.01;与SLE非活动期相比,△P<0.05

表2 血清基质金属蛋白酶-3与SLE活动期组患者比例的关系
SLE:系统性红斑狼疮
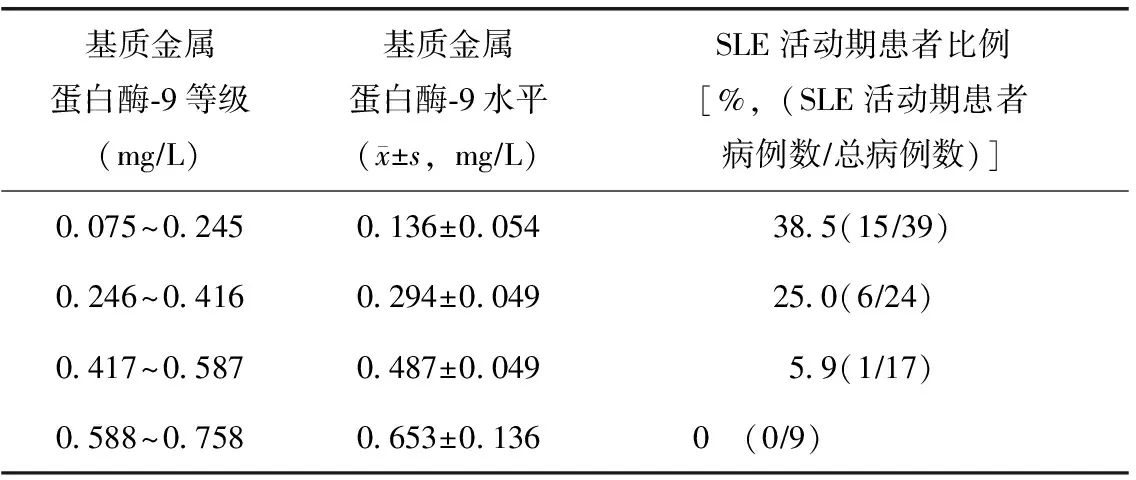
表3 血清基质金属蛋白酶-9与SLE活动期组患者比例的关系
SLE:系统性红斑狼疮
SLE不同病损患者血清MMP-3和MMP-9水平
85例SLE患者,无器官损害组22例,神经系统损害组17例,肾脏损害组27例,关节炎组19例。血清MMP-3水平各组间差异无统计学意义(均P>0.05);神经系统损害、肾损害和关节炎组患者血清MMP-9水平均低于无器官损害组(均P<0.05)(表4)。
讨 论
MMP-3又称为基质溶解素-1,相对分子质量为54000,是一种有着广泛底物的金属蛋白酶。除了可以降解几乎所有的ECM外,还可去除Ⅰ、Ⅱ、Ⅲ型原胶原N、C末端肽,起原胶原肽酶的作用和激活MMP-1,8,9[10]。MMP-3主要由成纤维细胞,巨噬细胞,内皮细胞等产生。有研究表明,MMP-3参与SLE的病理生理[11-13],其在SLE中的作用和意义尚不明确,比较倾向于其降解ECM,造成细胞外基质松解,便于免疫复合物沉积,刺激了局部炎症反应的发生。本实验结果显示,SLE患者组血清MMP-3明显高于对照组,提示MMP-3可能参与了SLE的发病过程。
已有大量研究表明[14-17],MMP-3可能与类风湿关节炎、肾小球肾炎及脑卒中等发病有关。关节痛和狼疮肾炎是SLE最常见的临床表现,脑卒中也是SLE患者死亡的一个重要原因,然而SLE患者受累关节和肾脏的病理表现不同于类风湿关节炎和慢性肾小球肾炎[18]。本研究根据不同病损情况将SLE患者分组比较血清MMP-3水平,但并未发现MMP-3明显变化。笔者推测MMP-3在SLE并发症中的病理机制可能是不同的,有待进一步研究。

表4 不同病损系统性红斑狼疮患者血清基质金属蛋白酶-3和基质金属蛋白酶-9水平
与无器官损害组相比,*P<0.05
MMP-9是MMP家族中分子结构最复杂的成员之一,是炎性反应重要的“调节剂”。MMP-9又称为Ⅳ型胶原酶或明胶酶B,主要有中性粒细胞和活化的巨噬细胞产生。MMP-9与其他金属蛋白酶一样,以水溶性酶原形式分泌至胞外。通常情况下,MMP-9分泌维持在较低水平,分泌出的MMP-9与ECM各种成分结合储存在ECM中,需在ECM中激活才具酶活性[19]。近年来,MMP-9与SLE疾病相关性研究发现,MMP-9的表达可影响炎性细胞因子的分泌和活性,辅助T细胞及Thl/Th2类细胞因子失衡,从而诱导和影响SLE疾病的发生及发展[20-21]。然而,MMP-9血清水平变化争议较大。Ainiala等[22]研究认为,SLE患者血清MMP-9水平总体并不升高,病情活动时有所下降。Faber-Elmann等[23]报道,SLE组血清MMP-9水平明显高于对照组,68%SLE患者血清MMP-9呈高水平,高水平的MMP-9与盘状红斑、雷诺现象、肺炎、口腔溃疡、抗心磷脂抗体相关。本实验结果提示,SLE非活动期患者与对照组血清MMP-9水平无明显差异;而SLE活动期患者血清MMP-9水平明显低于非活动期患者和对照组,且随着其水平降低,SLE活动期患者比例。提示随着血清MMP-9水平降低,SLE患者病情活动风险增大。Ikeda等[24]在SLE患者动脉粥样硬化风险研究中也得到了相似结果。另外,本研究显示SLE患者伴有肾脏损害、中枢神经系统损害和关节组织损伤时时,MMP-9水平也明显低于无器官没有系统损害的患者,提示MMP-9可能与SLE的进行性脏器损害有关。
综上所述,血清MMP-3可能参与了SLE的发病,其水平下降可能与狼疮病情改善有关,可作为治疗后病情好转的信号。而血清MMP-9水平和疾病活动或进行性脏器损害有关,有望作为评判SLE疾病活动和预后的指标。
[1]杨华夏, 张烜, 张文, 等.调节性T细胞与系统性红斑狼疮[J].中华临床免疫和变态反应杂志, 2009, 2:135.
[2]Mastui Y, Maedal M, Nakagami W,et al. The involvement of matrix metalloproteinases and inflammation in lumbar dischemiation[J].Spin,1998,23:863-869.
[3]Kanemoto M,Hukuda S,Komiya Y,et al.Immunohistochemical study of matrix metalloproteinases-3 and tissue inhibtors of metalloproteinase-1 in human interver-tebral disc[J].Spin,1996,21:1-8.
[4]Murphy Q,Cocket MI,Stephens PE,et al.Stormelysin is an activator of procollagenase:A study with natyral and recombinant enzymes[J].J Biol Chem,1987,248:265-268.
[5]Tolboom TC,Pieterman E,Vanderlaan WH,et al. Invasive properties of fibroblast-like synnoviocytes:correlation with gorwth characteristics and expression of MMP-1,MMP-3 and MMP-10[J].Ann Rheum Dis,2002,61:975-980.
[6]Petrow PK,Wernicke D,Schulze Westhof C,et al.Characterisation of the cell type-specificity of collagenase-3 mRNA expression in comparison with membrane Type-I matrix metalloproteinases and gelatinase A in the synovial membrane in rheumatoid arthritis[J].Ann Rheum Dis,2002,61:391-397.
[7]Basset P,Bellocq JP.A novel metalloproteinases gene specifically expressed in stromal cells of breast carcinonas[J].Nature,1990,348:699-704.
[8]Nagase H,Ogata Y,Suzuki K,et al.Substrate specificities and activation mechanisms of matrix metalloproteinases[J].Biochem Soc Trans,1991,19:715-718.
[9]殷文浩,鲍彰,郑敏.系统性红斑狼疮患者血清基质金属蛋白酶-9的检测[J].中华皮肤科杂志,2004,37:77-79.
[10] Celentano DC,Frishman WH.Matrix metalloproteinases and coronary artery disease:a novel therapeutic target.[J].Clin Pharmacol,1997,37:991-1000.
[11] Woessner JF.Matrix metalloproteinases and their inhibtors in connective tissue remodeling[J].FASEB,1991,5:2145-2154.
[12] Ribbens C,Martin Y,Porras M,et al.Increased matrix metalloproteinase-3 serun levels in rheumatic disease:relationship with sinovitis and steroid treatment[J].Ann Rheum Dis,2002,61:161-166.
[13] Stricklin GP,Welgus HG.Human skin fibroblast collagenase inhibitor purification and biochemical characterization[J].J Biol Chem,1983,258:12252-12258.
[14] Ribbens C,Andre B,Kaye O,et al.Synovial fluid matrixmetallop roteinase-3 levels are increased in inflammatory arthritides whether erosive or not[J].Rheumatology, 2000,39:1357-1365.
[15] Urushihara M,Kagami S,Kuhara T,et al.Glomerular distribution and gelatinolytic activity of matrix metalloproteinases in human glomerulonephritis[J]. Nephrol Dial Transplant, 2002,17:1189-1196.
[16] Ichikava Y,Yamada C,Horiki T,et al,Serum matrix metalloproteinase-3 and fibrin degradation product levels correlate with clinical disease activity in rheumatoid arthritis[J].Clin Exp Rheumatol,1998,16:533-540.
[17] Vaillant C,Meissirel C,Mutin M,et al.MMP-9 deficiency affects axonal outgrowth,migration, and apoptosis in the developing cerebellum[J].Mol Cell Neurosci,2003,24:359-408.
[18] 叶冬青.红斑狼疮[M].北京:人民卫生出版社. 2006:489-539.
[19] Visse R,Nagase H.Matrix Metalloproteinases and tissue inhibitors of metalloproteinases:structure, function and biochemistry[J].Cir Res,2003,92:827-839.
[20] Szegedi A,Simics E,Aleksza M,et al.Ultraviolet-A1 Phototherapy modulaies Th1Th2 and TclTc2 balance in Patients with systemic lupus erythematosus[J].Rheumatology(oxford), 2005, 44:925-931.
[21] Ronnblom L,Alm GV.Systemic lupus erythematosus and the type I interferon system[J].Arthritis Res Ther,2003,5:68-75.
[22] Ainiala H,Ietaharju A,Dastidar P,et al.Decreased serum matrix metalloproteinase-9 level in systemic lupus erythematosus patients with neuropsychiatric manifestations and brain magnetic resonance imaging abnormalities[J]. Arthitis Rheum,2004,50:858-865.
[23] Faber-Elmann A,Sthoeger Z,Tchemiack A, et al. Activity of matrixmetalloproteinase-9 is elevated in sera of patients with systemic lupus erythematosus[J].Clin Exp Immun, 2002, 127:393-398.
[24] Ikeda Y,Yagi S,Yamaguchi H,et al. Intra-vascular ultrasound findings of diffuse coronary atherosclerotic change in systemic lupus erythematosus with secondary antiphospholipid syndrome[J].J Circulation,2006,70:1082-1085.
