胃癌根治术后不同营养支持疗法的临床分析
2014-04-08周茂松潘生华
王 进,周茂松,潘生华
胃癌患者大多伴有不同程度的营养不良,再加上手术应激、持续胃肠减压、一定时间的禁食等因素,会进一步加重胃癌患者的营养不良[1],影响术后恢复。因此,胃癌术后营养支持是一项重要的治疗措施。目前广泛运用的营养支持方式主要分为肠内营养(EN)和肠外营养(PN),近年来手术之后采用肠内营养已逐渐受到重视[2]。我院采用鼻肠营养管行肠内营养支持在胃癌手术治疗方面,收到了较好的临床效果,现报道如下。
1 资料与方法
1.1 一般资料
选取宝应县人民医院2011年1月至2012年12月收治的60例经病理确诊为胃癌的患者为研究对象。其中男31例,女29例;年龄29~79岁,平均年龄(50.6±7.3)岁。贲门癌32例,胃体癌13例,胃窦癌15例;行胃十二指肠吻合(毕Ⅰ式)12例,食管胃吻合24例,全胃切除食管空肠吻合24例。将60例患者随机分为肠内营养组及肠外营养组,两组患者在性别、年龄、术前白蛋白、血红蛋白、手术方式、消化道重建方式及平均手术时间等方面的差异均无统计学意义(P>0.05),具有可比性。
1.2 营养支持方法
1.2.1 EN组 术日晨将胃管、鼻肠管一起置入胃内,手术时再将鼻肠管放置于距离屈氏韧带远端30~35 cm处。术后24 h内经鼻肠管注入生理盐水500 ml,观察病情变化,若术后48 h内患者一般情况良好,则给予经加温处理的肠内营养液(瑞素,华瑞公司生产)30~40 ml/h,500 ml/d,以后在此基础上每天增加500 ml,一直到维持剂量1 500 ml/d。滴速根据患者耐受力及反应给予增加,初始滴速为40~50 ml/h,逐渐增加,一直到140~150 ml/h。营养液温度保持在37 ℃~40 ℃。当能量及液体量不足时,由静脉进行补充。根据患者肛门排气及肠道恢复情况逐渐通过口腔从流质向半流质过度。
1.2.2 PN组 手术后24 h,通过手术前放置的中心静脉管给予患者营养支持。输入中长链脂肪乳、葡萄糖、白蛋白、水溶性及脂溶性维生素等药品,时间7~10 d,同样逐渐过渡到经口进食,并保证能量及氮量供应水平同肠内营养组。
1.3 观察指标
1.3.1 体质量 术前1天和术后第8天患者的体质量。增加:手术前后体质量增加大于或等于1.0 kg;稳定:手术前后体质量增加小于1.0 kg;减轻:手术前后体质量减轻大于或等于1.0 kg。
1.3.2 营养指标 术前1天和术后第8天患者的血红蛋白、白蛋白、血清前蛋白。
1.3.3 术后恢复情况 观察生命体征,注意有无伤口感染、肺部感染、吻合口瘘等并发症,观察记录肛门排气时间,以及平均住院时间。
1.4 统计学方法
2 结果
2.1 两组体质量的比较(表1)
治疗后EN组患者中体质量增加例数显著多于PN组(P<0.01)。
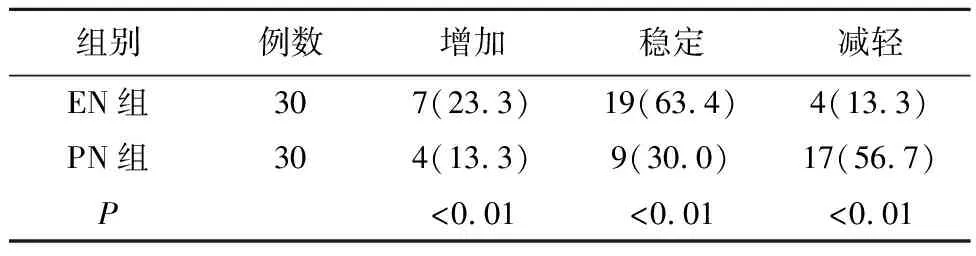
表1 治疗后两组患者体质量的比较[n(%)]
2.2 营养指标比较(表2)
术后两组患者的血红蛋白、白蛋白、血清前蛋白均有上升,但EN组手术后营养指标上升幅度明显优于PN组(P<0.01),差异有统计学意义。
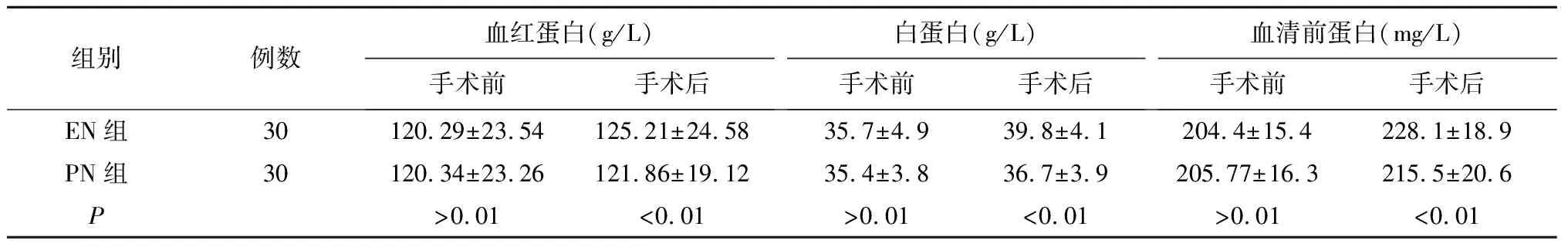
表2 两组患者手术前后营养指标的比较
2.3 术后并发症、肛门排气时间、平均住院时间比较(表3)
EN组的术后并发症发生率、肛门排气时间、平均住院时间明显少于PN组(均P<0.05)。

表3 两组患者手术后临床症状、并发症情况及平均住院时间比较
3 讨论
营养支持在消化道恶性肿瘤,特别是胃癌术后的治疗中尤其重要。营养支持主要包括EN和PN,PN的主要优点是迅速、足量提供机体所需的热量,但长期应用可导致肠黏膜屏障功能破坏,肠道内细菌和毒素易进入血液循环引起内毒素血症,代谢并发症,淤胆和肝功能损害等[3-4],故PN支持患者术后比EN支持的并发症发生率高,从而增加了患者的住院时间和住院费用。本组研究中PN组出现了5例伤口感染、4例肺部感染、2例吻合口瘘,其并发症的发生率明显高于EN组(P<0.05),在表3中也可以看到PN组的住院时间明显长于EN组。
与PN相比,EN给予的是要素饮食,有利于肠道吸收,为患者提供足够热量及氮源的同时,对应激蛋白及总蛋白的合成有促进作用。本研究中EN组患者手术后的血红蛋白、白蛋白、血清前蛋白明显上升,营养状况优于对照组(P<0.01), 故在治疗后EN组患者中体质量增加例数显著高于PN组(P<0.01)。同时EN能增加门静脉血供,促进胃肠道激素及胃液、胆汁、胰液的分泌,促使肠道淋巴组织分泌免疫球蛋白,从而保护机体体液免疫,进而有利于肠道黏膜屏障,减少肠道菌群易位引起的感染[5-7]。研究发现,腹部大手术后,小肠吸收功能在术后6~12 h得到恢复,早期给予EN并不会引起严重的消化道症状及肠梗阻[8]。我们一般在术后24 h内经鼻肠管注入生理盐水500 ml,观察病情变化,48 h内如果患者一般情况良好,再给予经加温处理的肠内营养液。另外,早期给予EN,通过对肠道刺激,使肠蠕动恢复及肛门排气时间提前,减轻腹胀程度及减少腹胀时间[6]。本研究显示,EN组的肛门排气时间明显短于PN组。而且,早期的肠功能恢复有利于患者早期通过口腔进食,促进康复。
但EN仍然会有一些并发症:如腹痛、腹胀、腹泻、营养液反流和误吸等。当出现以上并发症时,通过降低营养液输入速度、调整温度及浓度便可有效改善,一般对患者不造成严重影响[9]。在我们治疗的病例中,由于处理得当,EN组所有患者均未出现严重不良反应。
综上所述,EN不仅符合食物消化吸收的生理过程,而且能保护肠道黏膜屏障、防止细菌易位,缩短排气排便时间、促进肠功能恢复、减少术后并发症、缩短住院时间。同时,为下一阶段的治疗(如化疗、放疗等)创造了身体条件,提高了胃癌的整体综合治疗效果。
参考文献:
[1] 陈美华,欧晓静.高龄病人全胃切除术后早期肠内营养的应用[J].肠外与肠内营养,2009,16(4):239-240.
[2] 王明俊,潘裕国,卫智强,等.老年患者术后肠内营养与肠外营养支持的效果比较[J].山东医药,2009,49(45):90-91.
[3] Cerantola Y,Hubner M,Grass F,et al.Immunonutrition in gastrointestinal surgery[J].Br J Surg,2011,98(1):37-48.
[4] 郭明发.食管癌病人术后早期肠内营养的疗效观察[J].肠外与肠内营养,2011,18(4):218-224.
[5] 耿勇,周波.胃癌术后患者早期肠内营养支持的临床价值[J].现代肿瘤医学,2012,20(10):2127-2129.
[6] 王静东,郭倩,王倚三,等.胃癌术后早期瑞素肠内营养对患者机体营养状况的影响[J].武警医学院学报,2011,20(9):716-720.
[7] 潘开云,张文山,戴益智.食管癌术后早期肠内营养与肠外营养的临床对比研究[J].中国肿瘤外科杂志,2013,5(4):252-253.
[8] Heighes PT,Doig GS,Sweetman EA,et al.An overview of evidence from systematic reviews evaluating early enteral nutrition in critically ill patients:more convincing evidence is needed[J].Anaesth Intensive Care,2010,38(1):167-174.
[9] 尚玉龙,刘汝亭.早期肠内营养在胃癌患者快速康复外科治疗中的临床应用[J].中国肿瘤外科杂志,2012,4(4):220-222.
