人TRAIL胞外区原核可溶性表达及活性鉴定
2014-04-06鲍应环程相树刘峰涛
鲍应环,程相树,刘峰涛
(河南大学医学院 细胞与分子免疫学实验室,河南 开封 475004)
人TRAIL胞外区原核可溶性表达及活性鉴定
鲍应环,程相树,刘峰涛*
(河南大学医学院 细胞与分子免疫学实验室,河南 开封 475004)
目的获得具有生物活性的肿瘤坏死因子相关凋亡诱导配体(TRAIL)胞外段蛋白。方法根据大肠杆菌密码子偏爱性要求,设计合成编码TRAIL胞外段的DNA序列,构建成pET30a-TRAIL胞内融合表达质粒,重组质粒转化表达宿主E.coli BL21。在不同温度、不同浓度的IPTG条件下诱导表达TRAIL,SDS-PAGE分析表达产物,MTT法检测产物活性。结果构建的工程菌株表达29KD的可溶性TRAIL融合蛋白,能诱导Jurkat细胞凋亡。结论成功表达了人TRAIL胞外段蛋白,为进一步研究提供基础。
TRAIL;原核表达;Jurkat细胞;凋亡
肿瘤坏死因子相关的凋亡诱导配体(TNF-related apoptosis-inducing ligand,TRAIL)是 TNF 超家族成员,可选择性的诱导肿瘤细胞、病毒感染细胞和转化细胞凋亡而对正常细胞无毒[1-3],因此具有被开发成治疗肿瘤的蛋白质药物的可能性。其分子机制是受体DR4或DR5结合后诱发TRAIL发生三聚化并起始细胞凋亡途径[4]。之前已有多人[5-6]通过不同方式构建TRAIL的原核表达载体,并获得目的蛋白,但目的蛋白多以包涵体的形式表达。我们的实验根据大肠杆菌表达的密码子偏爱性,优化编码TRAIL(114~281氨基酸)的基因,人工合成重组基因,构建在表达质粒pET30a上,直接获得可溶性TRAIL。
1 材料与方法
1.1 实验材料
Jurkat细胞、E.coli top10菌株、E.coli BL21菌株和pET30a载体(实验室保存);2000bp loading DNA marker、蛋白质 marker和T4连接酶(日本Takara公司);HandⅢ 限制性内切酶和BamH Ⅰ限制性内切酶(英国NEB公司);MTT(安徽省合肥市 Biosharp公司);LB培养基(5g/L Yeast Extract,10g/L Tryptone,10g/L NaCl)、1640细胞培养基、胎牛血清(实验室提供);TRAIL基因片段根据氨基酸序列,进行密码子优化 (青兰生物公司合成)。
1.2 方法
1.2.1 基因的合成和酶切位点的设计 按照大肠杆菌表达的偏爱密码子设计并人工合成编码114~281氨基酸的整段DNA序列,并将其克隆入pUC19载体。
1.2.2 TRAIL表达菌株的构建 利用HandⅢ 和BamH Ⅰ限制性内切酶双酶切pUC19-TRAIL质粒、pET30a载体质粒,胶回收TRAIL、载体片段,连接过夜;将连接产物转化入感受态细胞;挑取阳性克隆,测序鉴定。
1.2.3 TRAIL工程菌诱导表达及表达条件优化取测序鉴定正确的pET30a-TRAIL质粒接种3mL LB液体培养基,增菌至OD600为0.4,加入终浓度分别为0、0.1、0.4、0.6、1.0mmol/L的IPTG,30 ℃诱导4h,25℃不加乙醇诱导过夜,25℃加体积分数为5%的乙醇诱导过夜等条件诱导后收集全部菌体超声破碎,分离上清和沉淀,上清和沉淀包涵体分别溶于200μL的PBS和200μL浓度为8mol/L的尿素。120g/L SDS-PAGE电泳分析上清和沉淀(上样量均为20μL)。
1.2.4 TRAIL蛋白纯化及鉴定 His柱纯化上清:500mmol/L咪唑洗脱,纯化产物超滤法置换buffer并浓缩,BCA法测浓度,过滤除菌,30%甘油-20℃保存。
1.2.5 生物活性鉴定 含体积分数为10%胎牛血清的1640培养基配置Jurkat细胞悬液,浓度为1×106/mL,96孔板每孔加0.2mL。细胞铺板后,立刻加入TRAIL,浓度梯度为0、1、2、5、10mg/L,每组设3个复孔。37℃、体积分数为5%CO2培养24h,离心吸出培养液加入50μL浓度为2g/L的MTT,培养4h。2500r/min,离心,吸出多余 MTT,加入150μL DMSO,振荡10min,490nm波长测定各孔的光密度值。
2 结果
2.1 TRAIL蛋白诱导表达及条件优化
结果显示,不同温度和IPTG诱导时,29KD处有蛋白表达,与理论相符,IPTG浓度对目的蛋白表达量影响不大。30℃诱导时目的蛋白大部分以包涵体的形式存在,只有少部分以可溶形式存在;25℃过夜诱导不能明显增加目的蛋白的可溶性表达量;25℃添加体积分数为5%乙醇诱导,目的蛋白的可溶形式表达量明显增加。见图1、图2、图3。
2.2 TRAIL蛋白生物活性检测
MTT结果显示纯化的目的蛋白能够诱导Jurkat细胞凋亡,具有良好的生物活性。见图4。
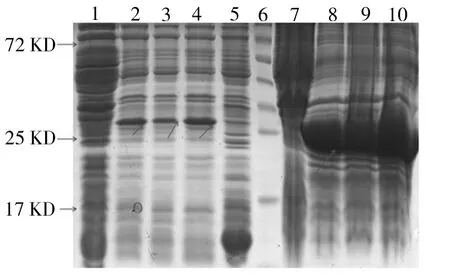
图1 30℃不加乙醇诱导融合蛋白表达分析
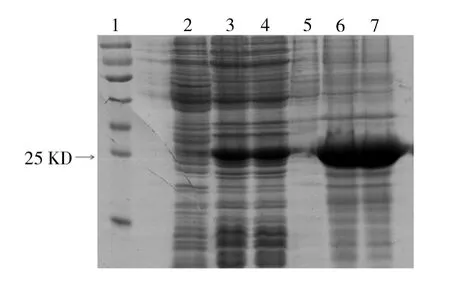
图2 25℃未加乙醇诱导融合蛋白表达
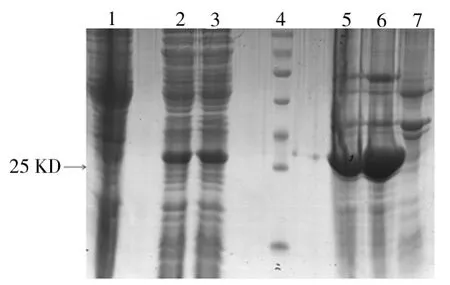
图3 25℃加乙醇诱导融合蛋白表达
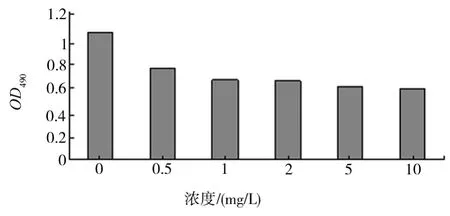
图4 MTT实验结果分析
3 讨论
TRAIL可以诱导许多肿瘤细胞发生凋亡,而对大多数正常细胞没有明显毒性,比TNF-α和Fas-L具有更广的抗癌谱,而且不会像TNF-α和Fas-L那样产生严重的炎症反应[7]。因此,TRAIL在今后治疗人类恶性肿瘤方面具有很广泛的应用前景,TRAIL及其受体的研究也将为肿瘤治疗药物的开发开辟新的路径。
以往克隆目的基因的常用方法是通过提取细胞RNA,反转录获得,随着基因合成技术进步,直接优化密码子合成基因已成为一种新的选择。我们利用基因合成的方法直接合成了TRAIL的胞外段,节省了时间,表达效果也不错,成本与常规方法的相差不大。
TRAIL全长281bp,相对分子量32.5kDa,等电点为7.63,为典型的Ⅱ型跨膜蛋白,C段114~281氨基酸残基形成一个同源三聚体结构,参与特异性受体结合。TRAIL第114~281位氨基酸碱基为胞外片段[4],我们实验表达的该片段具有诱导Jurkat细胞凋亡的活性。
为获得更高比例的可溶性目的蛋白,我们参照唐蓓和杨芳等人发表的文献,进一步探索多种优化表达方法,最终以加入诱导剂同时加入体积分数为5%乙醇的方法获得满意的结果,MTT法检测证明目的蛋白具有生物活性。我们的这次实验与以往实验相比省去包涵体复性的过程,直接获取活性蛋白,减少了工作量,同时也为今后原核表达其他可溶性活性蛋白诱导条件的选择提供了参考。
[1]Gura T.How TRAIL kills cancer cells,but not normal cells[J].Science,1997,277(5327):768.
[2]Griffith T S,Lynch D H.TRAIL:Amolecule with multiple receptors and control mechanisms[J].Curr Opin Immunol,1998,10(5):559-563.
[3]Ashkenazi A,Dixit V M.Apoptosis control by death and decoy receptors[J].Curr Opin Cell Biol,1999,11(2):255-260.
[4]朱梅,王祥喜,李雪梅,等.TRAIL诱导肿瘤细胞凋亡的分子机制及其在肿瘤生物治疗中的应用前景[J].生物物理学报,2012,28(6):448-456.
[5]唐蓓,何凤田,蔡绍皙.人TRAIL分子胞外区的纯化及活性检测[J].中国免疫学杂志,2003,19(8):554-557.
[6]杨芳,刘红岩,徐维明.sTRAIL基因的克隆及其在大肠杆菌中的表达[J].药物生物技术,2003,10(3):129-132.
[7]Shirley S,Morizot1A ,Micheau O.Regulating TRAIL receptor-induced cell death at the membrane:a deadly discussion[J].Recent Patents Anticancer Drug Discovery,2011,6(3):311-323.
[责任编辑 姬 荷]
Expression the tracellular domain of human TRAIL and identification of its activity
BAO Yinghuan,CHENG Xiangshu,LIU Fengtao*(Key Laboratory of Celluar andmolecular Immunology,Institution of immunology,Medical School of Henan University,Kaifeng,Henan 475004,China)
ObjectiveTo obtain the extracellular domain of tumor necrosis factor-related apoptosis-inducing ligand(TRAIL)with activity.MethodsWe designed and synthesized DNA encoding the TRAIL extracellular DNA sequences according to the coding preference of the E.coli and constructed the prokaryotic expression vector:the pET30aTRAIL fusion expression plasmid.The recombinant plasmid was transformed into the expression host E.coli BL21to induce expression under different temperature conditions,different concentrations of IPTG and alcohol.After inducing expression we used the SDS-PAGE method to analysis of expression product and used the MTT method to assay the activity of expression product.ResultsThe constructed engineering bacteria expressed a 29KD soluble TRAIL fusion protein,and this protein can induce Jurkat cell apoptosis.ConclusionWe successful express the extracellular domain of human TRAIL protein with activities.
TRAIL;Prokaryotic expression;Jurkat cells;Apoptosis;apoptosis
Q782
A
1672-7606(2014)02-0117-03
2014-02-12
河南省医学科技攻关计划项目资助(WKJ2007-021)。
鲍应环(1987-),女,河南信阳人,硕士研究生,从事抗体工程研究。
*通讯作者:刘峰涛(1970-),男,河南 开封 人,博士,副教授,从事分子免疫的教学与科研工作。
