海参肠道中高产胞外多糖酵母的筛选及发酵条件
2014-04-03丛丽娜窦赫喆王姝欣
高 鹏, 丛丽娜, 窦赫喆, 王姝欣
(大连工业大学 生物工程学院,辽宁 大连 116034)
0 引 言
酵母胞外多糖(Yeast Exopolysaccharide,YEPS)是酵母生长代谢过程中分泌到细胞壁外、常渗于培养基的一类糖类化合物,具有多糖广泛的药理功能活性,如抑菌抗菌、提高机体免疫力、促进动物生长、抗癌、抗肿瘤、防治疾病等优点。它与其他来源的多糖相比,还具有不受季节、地域和病虫害的限制及易于分离、可连续发酵等优点[1-2]。目前国内对胞外多糖的发酵研究多为大型真菌和细菌,而对酵母多糖的开发与研究很少[3],急需引起学术界的关注。
海洋环境的多样性与独特性造就了海洋微生物具有独到的优越性[4]。从海洋生物中选育产胞外多糖酵母菌,其分泌的多糖可作为免疫增强剂替代抗生素对鱼类进行免疫反应,激活鱼体内的非特异性免疫系统,提高抗病能力,这是确保水产养殖产量和经济效益的一种有效手段[5]。
大量研究发现,胞外多糖产量除与菌株的遗传特性有关外,还与培养基的成分和发酵条件有着密切的关系[6-7]。本研究从海参肠道中分离筛选高产胞外多糖酵母,然后通过不同温度、pH、培养时间、碳源和接菌量等因素对酵母发酵胞外多糖产量的影响进行研究;采用响应面设计法对酵母胞外多糖发酵条件进行优化,以期为今后酵母胞外多糖的工业化发酵生产和水产养殖业的应用提供实验依据。
1 材料与方法
1.1 材 料
1.1.1 试验材料
大连长海县海参及海参养殖圈海水等。
1.1.2 培养基
YEPD培养基:蛋白胨20g,酵母膏10g,葡萄糖20g,琼脂20g,过滤海水1 000mL,pH自然。
富集培养基:葡萄糖20g,马铃薯(切成小块)200g,水煮1h,蒸馏水定容至1 000mL,pH自然。
种子培养基:蛋白胨10g,葡萄糖20g,硫酸铵15g,磷酸二氢钾2.5g,蒸馏水1 000mL。
发酵培养基:同种子培养基。
1.2 方 法
1.2.1 菌种筛选
初筛:取海参肠剪碎,生理盐水浸泡过夜,以液体体积为10%的比例接入含有青霉素的富集培养基,30℃、160r/min振荡培养24h。菌悬液梯度稀释,涂布于YEPD固体培养基,30℃培养48h;挑取颜色、形态不同的菌落分离纯化,显微镜下观察酵母细胞。最终统计得到10株不同的酵母菌。
复筛:筛选菌株于产糖发酵培养基30℃、160r/min发酵培养24h,离心保留上清液,测定总糖和还原糖含量,再进行多糖提取。根据发酵液和菌落形态观察、多糖产量测定等指标将筛选的产胞外多糖酵母菌株进行比较分析[8]。
1.2.2 胞外多糖含量的测定
发酵液中胞外多糖量=总糖量-还原糖量
总糖量:苯酚-硫酸法[9];还原糖量:DNS法(3,5-二硝基水杨酸法)[10]。
1.2.3 单因素筛选
分别以碳源、pH、接菌量、温度及发酵时间作为参数进行单因素优化试验,考察其对产糖量的影响。为确定各种环境因素对酵母菌HS-J9发酵产糖量的影响水平,通过选择最佳的发酵条件来进行下一步的响应面优化。
1.2.4 响应面分析试验
根据单因素结果,选出3组对产糖量影响较显著的因素,以发酵液中的胞外多糖产量为响应值,采用Design Expert 8.0软件对其进行Box-Behnken响应面设计,通过SAS软件对试验结果进行回归分析,并应用3组平行试验对最优结果进行验证,从而获得产糖量较高酵母菌HS-J9发酵产多糖的最佳发酵条件[11]。
2 结果与分析
2.1 筛选与鉴定
通过对菌株的初筛与复筛,得到一株胞外多糖产量较高的酵母菌 HS-J9。在形态上,HS-J9菌落较大、纯白色,表面光滑、有光泽,边缘整齐,易挑取,10×40倍显微镜下观察细胞为椭圆形(如图1)。将菌株进行26SrDNA序列测定,经过分析比对后,初步判断菌株HS-J9为季也蒙假丝酵母(Meyerozyma guilliermondii)。现已将该序列提交至GenBank,检索号为KF668241。

图1 HS-J9菌落形态及显微镜下细胞形态Fig.1 Colonial morphology and microscopic structure of HS-J9strain
2.2 单因素筛选结果
考察不同碳源(葡萄糖、果糖、蔗糖、麦芽糖和乳糖)、pH(3~8)、接菌量(2%~12%)、温度(26~32℃)和发酵时间(12~60h),这5个因素对酵母菌HS-J9产胞外多糖量的影响。结果表明,最佳碳源为葡萄糖,pH为6,接菌量为4%,28℃发酵36h时,胞外多糖产量最高。通过比较发现,pH、接菌量和发酵时间对产糖量的影响较为显著,而设定的不同温度对产糖量影响较小。因此选取上述较显著条件进行响应面优化。
2.3 响应面分析
2.3.1 响应面试验设计与结果
根据单因素试验结果,选择对多糖产量影响较显著的3个因素(pH、接菌量、时间)为优化对象,以发酵液中的胞外多糖含量为响应值来设计中心组合实验。表1为所设计的因数水平及编码,表2为 HS-J9Box-Behnken设计方案和试验结果。
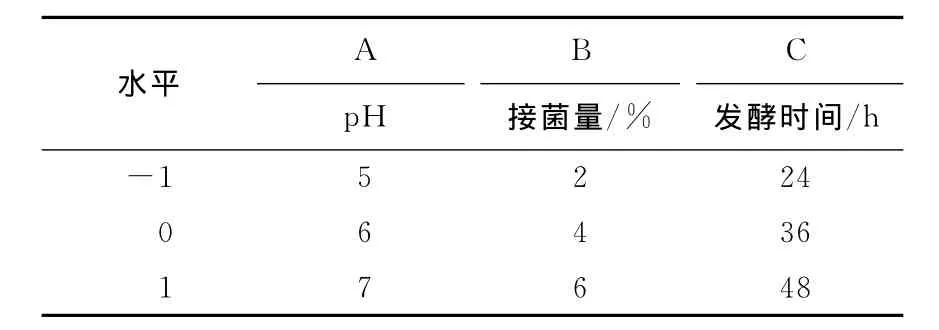
表1 试验因素水平表Tab.1 Factors and levels of the RSM experiment
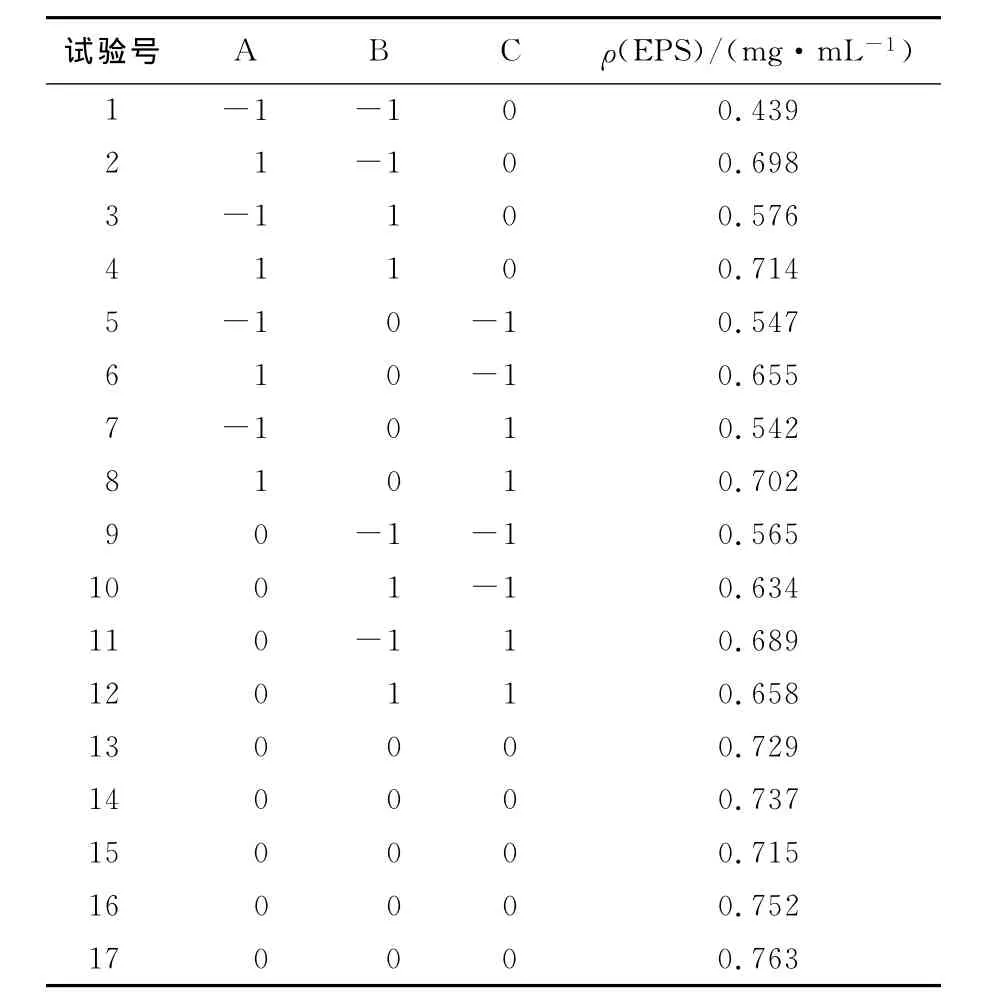
表2 Box-Behnken设计及试验结果Tab.2 Design of Box-Behnken and results of the RSM experiment
2.3.2 二次回归方程拟合及方差分析
利用SAS软件对表2数据进行多元二次回归拟合,得到酵母菌HS-J9回归方程:

回归方程的方差分析和可信度分别见表3。
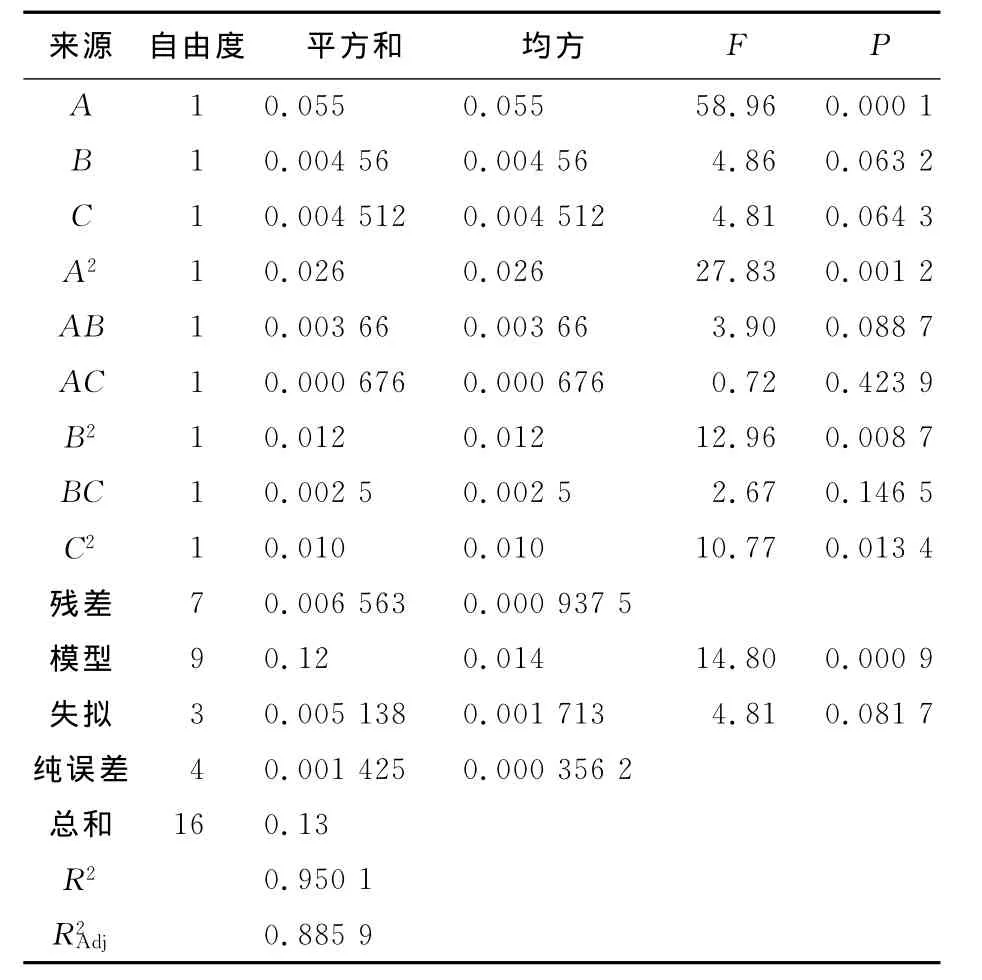
表3 HS-J9回归方程的方差分析Tab.3 NOVA for the secondary response model
通过回归方程的方差分析(表3)可知,HS-J9回归模型F=14.80,P=0.000 9<0.01,表明试验所采用的二次模型是极显著的;失拟项P=0.081 7>0.05不显著,无失拟因素存在,对模型有利,该模型在被研究的整个回归区域拟合程度较好,因此可用该回归方程代替试验真实点对试验结果进行分析。决定系数R2=0.950 1,这表明由这3个因素及其二次项方差能解释响应值(Y)变化的95.01%,说明该模型的相关度较高。矫正决定系数R2Adj=0.885 9,表明88.95%的试验数据的变异性能用此回归模型解释;由此可见,该回归模型具有较好的拟合度,可以用此回归方程对酵母菌HS-J9的胞外产糖量进行分析预测。
2.3.3 响应面分析显著因子水平的优化
利用SAS软件系统地分析二次回归模型,通过回归方程形象地绘制分析图,考察所拟合的相应曲面形状。根据Box-Behnken试验结果绘制pH、接菌量、发酵时间三维响应面,如图2所示。利用Design Expert 8.0软件响应优化器进行放大,最大值处为:pH 6.59,接菌量3.98%,发酵时间41.33h。在此条件下,HS-J9的理论最大产量为0.765mg/mL。
为便于实际操作,采用优化发酵条件(pH为6.6,接菌量4%,发酵时间41.3h)进行3组平行试验,实际测得的HS-J9胞外多糖产量的平均值0.762mg/mL,与预测值相接近,说明用响应面法优化的该发酵条件具有实用价值。
3 讨 论
水产养殖业的健康发展需要以天然健康的新型添加剂代替抗生素来减少水产动物病害。研究发现,某些益生酵母不仅可以自身分泌一类抗菌物质(如胞外免疫多糖),酵母细胞中还含有丰富的蛋白质、B族维生素、脂肪、糖、酶等多种营养成分和某些协调因子,是目前理想的水产饲料添加剂[12]。从海洋生物中选育出的益生菌种更易于定植在海洋生物肠道内,进而抑制其他有害菌株的侵入。
本研究从海参肠道中筛选得到一株高产胞外多糖的益生酵母菌株,经26SrDNA序列分析比对,初步判断为季也蒙假丝酵母(Meyerozyma guilliermondii),并应用响应面法对季也蒙假丝酵母的发酵条件进行优化,最终测得多糖产量为0.762mg/mL。此研究可为今后研发和生产具有免疫功能的天然绿色水产饲料提供资源与依据。
[1]包怡红,刘奇,王薇,等.不同发酵条件对酿酒酵母产胞内胞壁多糖的影响[J].酿酒,2012,39(1):51-56.
[2]顾笑梅,孔健,王富生,等.一株乳酸菌所产胞外多糖对荷瘤小鼠机体免疫功能影响的研究[J].微生物学报,2003,43(2):251-256.
[3]周晓兰,施碧红,吴松刚,等.啤酒酵母胞外多糖发酵条件的研究[J].工业微生物,2003,32(1):34-36.
[4]RAJKUMAR R, KOTHILMOZIAN J, RAMASAMY R.Production and characterization of a novel protease from Bacillus sp RRM1under solid state fermentation[J].Microbiology and Biotechnology,2011,21(6):627-636.
[5]刘洪梅,马志红,晋晶,等.酵母多糖对鲤鱼生长和免疫功能的影响[J].安徽农业科学,2010,38(4):1874-1875.
[6]WELMAN A D,MADDOX I S.Exopolysaccharides from lactic acid bacteria:perspectives and challenges[J].Trends in Biotechnology,2003,21(6):269-274.
[7]RUAS-MADIEDO P,HUGENHOLTZ J,ZOON P.An overview of the functionality of exopolysaccharides produced by lactic bacteria[J].Dairy,2002,12(2):163-167.
[8]张勇,吴周和,周丽明,等.酵母多糖生产菌的筛选和发酵条件的研究[J].中国酿造,2005,17(8):17-19.
[9]张水华.食品分析[M].北京:中国轻工业出版社,2004:289-293.
[10]张惟杰.复合多糖生化研究技术[M].上海:上海科学技术出版社,1987:2-9.
[11]张欢,丛丽娜,侯英敏,等.响应面法优化海洋枯草芽孢杆菌HS-A38增殖发酵培养基[J].大连工业大学学报,2012,31(1):19-23.(ZHANG Huan,CONG Li-na,HOU Ying-min,et al.Medium optimization for spore production of marine Bacillus subtilis HS-A38by response surface methodology[J].Journal of Dalian Polytechnic University,2012,31(1):19-23.)
[12]胡梦红,王有基,熊邦喜,等.一种新型水产饲料添加剂——酵母细胞壁[J].水利渔业,2006,26(3):75-91.
