表皮葡萄球菌serp2169基因敲除突变株的构建及其生长变化
2014-04-02赵艳丰唐小牛谷生丽王少圣李朝品
朱 涛,赵艳丰,唐小牛,谷生丽,王少圣,李朝品
表皮葡萄球菌(Staphylococcusepidermidis, SE)属凝固酶阴性葡萄球菌,为条件致病菌,广泛存在于人皮肤和粘膜表面,其正常情况下很少引起感染。但近年来,随着医用高分子材料(如人工关节、人工心脏瓣膜和中央静脉插管等)在临床上的广泛应用,表皮葡萄球菌日益成为引起院内感染的重要病原体之一。其致病性主要在于能在医用材料表面形成生物膜(biofilm)[1-2]。生物膜的形成受多种环境因素的影响。双组分调控系统(Two-component regulatory system,TCS)是细菌感应外界环境信号,启动胞内一系列相关基因的转录和表达,以增强细菌在不同环境下的适应能力和调控细菌毒力的一类信号转导途径[3-4]。研究表明多个双组分调控系统YycG/F、ArlS/R和SrrB/A参与调控葡萄球菌生物膜的形成[5-7]。
作者在以往的研究中对表皮葡萄球菌双组分信号转导系统LytS/R的生物学功能和调控网络作了初步分析。研究发现lytS/R基因被敲除后,其利用丙酮酸作为碳源的能力显著受损。基因芯片的结果表明参与丙酮酸代谢的相关基因mqo-2和mqo-3的转录水平明显下降。而且邻近mqo-2的serp2169基因的转录水平也下调了60倍,但其功能未知[8]。Petrova等人研究表明丙酮酸以及丙酮酸的发酵是铜绿假单胞菌形成微菌落,进而形成生物被膜所必须的[9]。因此,为了研究serp2169基因的生物学功能以及是否参与丙酮酸代谢和影响生物膜形成,我们拟构建表皮葡萄球菌serp2169基因敲除突变株,并对突变株的表型进行初步检测。
1 材料和方法
1.1 材料
1.1.1菌株和质粒 表皮葡萄球菌1457株为临床株,由本实验室保存;穿梭质粒pMAD-spc、大肠杆菌DH5α和金黄色葡萄球菌RN4220,用于基因敲除。
1.1.2主要试剂和培养基 溶葡萄球菌素(lysostaphin)、Pfu DNA聚合酶、红霉素(Erythromycin)、X-gal、琼脂糖凝胶回收试剂盒购自上海生工生物工程技术服务有限公司;壮观霉素(Spectinomycin)购自Sigma公司;限制性内切酶、DNA连接酶、lkb DNA Marker购自Fermentas公司;质粒抽提试剂盒购自Qiagen公司;引物合成和测序由上海生工生物技术有限公司完成;TSB( Tryptic Soy Broth) 为美国BD公司产品;BM培养基:10 g/L 蛋白胨,5 g/L 酵母提取物,5 g /L氯化钠,1 g/L磷酸氢二钾,1 g/L葡萄糖。
1.2 方法
1.2.1表皮葡萄球菌serp2169基因的生物信息学分析 根据表皮葡萄球菌ATCC35984株全基因组序列(GenBank收录号:CP000029)[10],找到serp2169基因及其编码的蛋白序列。采用BlastP在线软件对其编码蛋白SERP2169的同源性和蛋白功能域进行分析。
1.2.2表皮葡萄球菌serp2169基因敲除突变株的构建 采用质粒同源重组的方法构建表皮葡萄球菌1457serp2169基因敲除突变株(Fig.1)[11]。根据NCBI上公布的表皮葡萄球菌基因组序列,在serp2169基因的上下游各设计1对引物,上游引物为serp2169-UF和serp2169-UR,扩增片段长度1 011 bp,作为上游同源臂;下游引物为serp2169-DF和serp2169-DR,扩增片段长度988 bp,作为下游同源臂;拟用spc基因取代819 bp的serp2169目的基因。所用引物采用Primer Premier 5.0软件设计, 引物序列的下划线为酶切位点(表1)。
提取表皮葡萄球菌1457株基因组DNA,以该基因组DNA为模板扩增上下游同源臂,克隆入pMAD-spc载体,得到同源重组质粒,命名为pMAD-serp2169。通过电转将pMAD-serp2169转入金黄色葡萄球菌RN4220,电转条件:电压2 kV,电容25 μF ,电阻100 Ω。在含有10 mg/L红霉素的BM平板上筛选出转化成功的菌落后,提取金黄色葡萄球菌RN4220中的pMAD-serp2169并鉴定,再把经修饰的pMAD-serp2169电转入表皮葡萄球菌1457株,电转条件同前。
pMAD是温度敏感型质粒,30℃此质粒可以在革兰阳性菌中稳定存在,当温度≥40℃时质粒很易丢失。该质粒携带lacZ基因,编码β半乳糖苷酶,能分解生色底物X-gal 产生蓝色。当同源重组未发生时,质粒保留在细菌内,或者与基因组只发生了单交换,lacZ基因表达,菌落呈蓝色;当同源重组发生后,质粒从细菌丢失,无β半乳糖苷酶表达,菌落呈白色。根据以上原则进行敲除突变株的筛选。取含pMAD-serp2169的表皮葡萄球菌1457株接种含10 mg/L红霉素的BM培养基,30℃培养过夜。取1 mL上述菌液接种新鲜100 mL含50 mg/L 壮观霉素的BM培养基,42℃振荡培养24 h;以下同前,共重复2~3次,每天需换新鲜含50 mg/L壮观霉素的BM培养基。取少量菌液接种至含50 mg/L壮观霉素,20 g/L X-gal的TSB平板;挑取单个白色菌落分别接种至含50 mg/L壮观霉素的和含10 mg/L红霉素的TSB平板,其中壮观霉素平板上生长、红霉素平板上不生长的菌落为初筛重组成功的serp2169基因敲除突变株,命名为SE1457-Δserp2169。
1.1.3表皮葡萄球菌serp2169基因敲除突变株的鉴定 以初筛所得的突变株基因组为模板,以上游同源臂外侧的正义引物(serp2169-IF)和spc基因片段的反义引物(spc-IR),下游同源臂外侧的反义引物(serp2169-IR)和spc基因片段的正义引物(spc-IF),分别采用Pfu DNA聚合酶进行PCR扩增,并以表皮葡萄球菌1457野生株基因组作为阴性对照。所用引物采用Primer Premier 5.0软件设计,具体序列见表1。如若同源重组成功,spc基因取代了目的基因serp2169,则突变株能够扩增出预计大小的片段,反之则不能。将PCR产物行1%琼脂糖凝胶电泳,根据1 kb DNA Marker得出产物大小,并与阴性对照比较。最后对PCR产物进行凝胶回收后测序验证。

表1 各扩增片段的引物序列及限制性内切酶
Note: This table shows primers and restriction endonuleases used in the present study, and underlined sequences represent the restriction sites. Upstream and downstream fragments of theserp2169 gene were amplified byserp2169-UF,serp2169-URserp2169-DF, andserp2169-DR, respectively. Primersserp2169-IF,spc-IR,spc-IF, andserp2169-IR were used to identifySE1457-Δserp2169 by PCR amplification, respectively.
1.2.3serp2169突变株及其野生株生长曲线和培养液pH值的测定 将过夜培养的菌液接种于含100 mL TSB培养基的500 mL锥形瓶中,调节接种量,使得OD600=0.01。将锥形瓶置于37℃气浴恒温振荡器中,220 r/min振荡培养,分别于4、8、12、24 h后取样,以后每隔24 h取样一次,测定OD600值和pH值,共检测168 h。
1.1.4serp2169突变株及其野生株生物膜形成的半定量检测 细菌经过37℃振荡培养过夜,1∶200稀释加入96孔板(200 μL/孔,三复孔),并且用TSB培养基为空白对照,另设表皮葡萄球菌ATCC12228为阴性对照,表皮葡萄球菌ATCC1457为野生株。37 ℃静置培养24 h,丢弃菌液,加入PBS(200 μL/孔),洗去未黏附细菌,重复洗涤3次。然后加入99%甲醇固定15 min,弃甲醇。加入2%结晶紫染色8 min,自来水冲洗板到流水无色,室温干燥片刻后,酶标仪于570 nm处读数[11]。
2 结 果
2.1表皮葡萄球菌serp2169基因的生物信息学分析 BlastP分析表明表皮葡萄球菌serp2169基因的编码氨基酸序列中4-272位为PRK05339结构域。该结构域暂被认为属于磷酸烯醇式丙酮酸合成酶调节蛋白。serp2169的同源基因普遍存在于凝固酶阴性葡萄球菌中,在溶血葡萄球菌中氨基酸序列一致性为87%,在肉葡萄球菌中氨基酸序列一致性为72%,而在金黄色葡萄球菌中未发现氨基酸序列一致性大于50%的同源基因。对serp2169基因的上下游序列进行分析,serp2169上游为mqo-2基因,编码苹果酸:醌氧化还原酶(malate:quinone oxidoreductase);其下游为ppdk基因,编码丙酮酸磷酸双激酶(pyruvate phosphate dikinase)(图1)。
2.2表皮葡萄球菌serp2169基因敲除突变株的构建和鉴定 经PCR扩增和双酶切验证,成功构建了同源重组质粒pMAD-serp2169。转化了pMAD-serp2169的表皮葡萄球菌于42 ℃条件下连续传代,筛选出了对壮观霉素抵抗但对红霉素敏感的白色菌落。以同源臂外侧基因序列和spc基因序列设计的两对引物对筛选出的突变株和野生株分别进行PCR扩增,结果显示筛选出的突变株能够扩增出长度约2 117 bp和1 933 bp的片段,与预计的片段大小相符,且通过测序证实;而野生株不能扩增出相应的片段 (图2)。采用梅里埃API STAPH葡萄球菌鉴定试剂条对筛选出的突变菌株进行菌种鉴定,结果显示为表皮葡萄球菌,证明获得了SE1457-Δserp2169菌株。
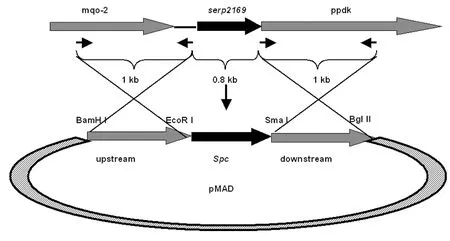
图1serp2169基因同源重组及其上下游序列分析
Fig.1Homologousrecombinationofserp2169geneinS.epidermidis1457genomewithpMAD-serp2169andtheanalysisofitssurroundingregion
The upstream and downstream fragment ofserp2169 gene andspcwere cloned into vector pMAD-spc, named as pMAD-serp2169.
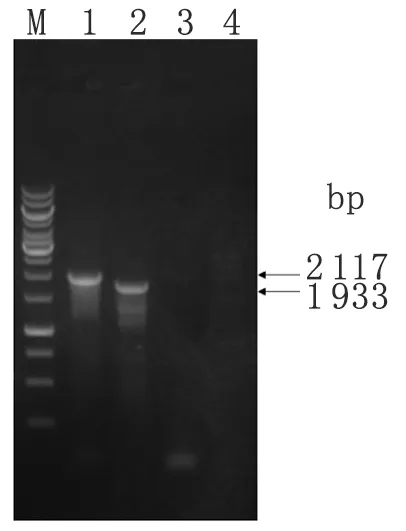
图2表皮葡萄球菌serp2169基因敲除突变株的PCR鉴定
Fig.2Identificationofserp2169geneknockingoutintheS.epidermidisbyPCRamplification
Specific fragments were amplified fromSE1457-Δserp2169;
M: 1 kb DNA marker;
Lane 1:serp2169 upstream fragment plusspcfragment (2 117 bp);
Lane 2:serp2169 downstream fragment plusspcfragment (1 933 bp);
Lane 3 and Lane 4: no fragment was amplified from the wild type strain by using the respective primers.
2.3serp2169突变株生长曲线和培养液pH值的研究 在相同接种量和生长条件下比较野生株和突变株的生长曲线,结果显示两株细菌的生长曲线在96 h以前基本一致,培养24 h后,浊度值达到最高,突变株OD600=2.602,野生株OD600=2.646,随后逐渐下降;两株细菌培养液的pH值也基本一致。而在96 h以后野生株的生长曲线出现反弹,而突变株的生长曲线继续下行,培养120 h后,突变株OD600=0.883,野生株OD600=1.701 (图3),此时两株细菌培养液的pH值也出现了差别,突变株pH=8.35,野生株pH=7.96。
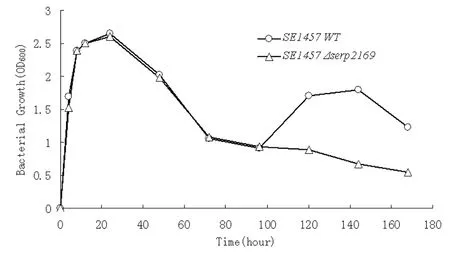
图3表皮葡萄球菌serp2169基因敲除突变株和野生株的生长曲线
Fig.3GrowthcurveofSE1457-Δserp2169andthewildtypestrain
(△):SE1457-Δserp2169;
(○):SE157 wild type strain.
Overnight culture was diluted to OD600=0.01 in 200 mL TSB medium, and incubated at 37 ℃ with shaking.
The value of OD600was detected.
The curves represent one of the three independent experiments.
2.4serp2169突变对表皮葡萄球菌生物膜形成能力的影响 对敲除突变株进行微量板半定量生物膜检测,观察细菌在96孔板上静止生长24 h后生物膜的形成,结果显示突变株的OD570=2.436,而野生株OD570=2.329,P>0.05,与野生株相比,突变株的生物膜形成能力无显著变化 (图4)。
3 讨 论
本研究根据同源重组原理,采用温度敏感型质粒pMAD结合蓝白斑筛选技术,成功获得了表皮葡萄球菌serp2169基因的敲除突变株,为其下一步生物学功能的研究奠定了基础。serp2169基因的生物信息学分析表明其编码产物可能为磷酸烯醇式丙酮酸合成酶调节蛋白。且其上游的mqo-2基因编码苹果酸:醌氧化还原酶,催化苹果酸氧化生成草酰乙酸,参与三羧酸循环和乙醛酸循环[13];而下游的ppdk基因编码丙酮酸磷酸双激酶,主要分布在特定的微生物和植物体内,可逆地催化ATP、磷酸和丙酮酸转化为AMP、焦磷酸和磷酸烯醇式丙酮酸[14-15],均参与丙酮酸的代谢。表皮葡萄球菌lytS/R突变株利用丙酮酸的能力受限,且serp2169基因的转录水平显著降低。因此,serp2169基因可能参与丙酮酸的代谢,并在表皮葡萄球菌利用丙酮酸作为碳源的代谢过程中发挥重要调节作用。但我们观察了serp2169突变株在丙酮酸利用培养基(10 g/L丙酮酸, 10 g/L蛋白胨,5 g/L酵母提取物,5 g/L氯化钠,1 g/L磷酸氢二钾)中的生长情况,发现其与野生株并无差异。
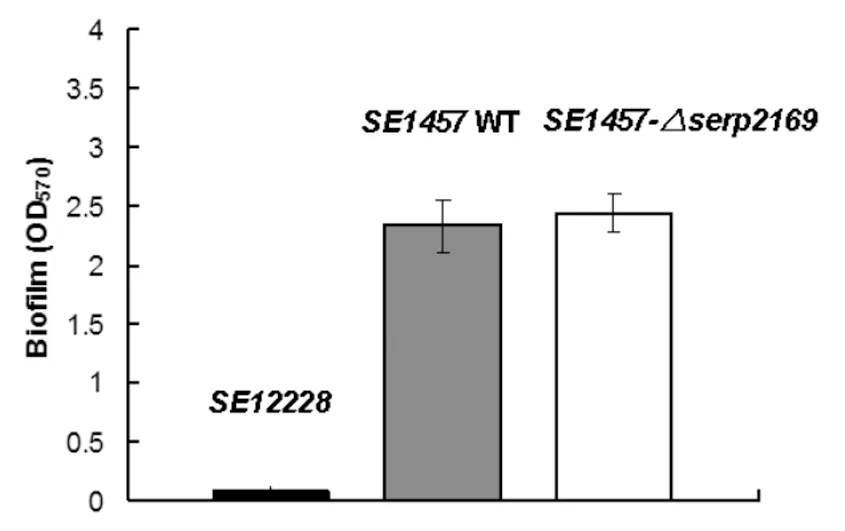
图4serp2169突变对表皮葡萄球菌生物膜形成能力的影响
Fig.4Effectofserp2169geneknockingoutonS.epidermidisbiofilmformation
The biofilm formation ofSE1457-Δserp2169 and its parent strain was detected by semi-quantitative microtiter plate assay.
Briefly, the overnight bacterial were diluted by 1∶200 and cultured in 96-well plate (200 μL/well) at 37 ℃ for 24 h.
The well was washed by PBS for 3 times, fixed by 99% methanol and stained with crystal violet.
Data are means ± SEM of three independent experiments.
进一步,我们对突变株和野生株的生长曲线进行了测定,发现在对数期以及平台期的早期,两株细菌的生长并无差异;而到了平台期的后期(96 h),野生株有一个二次生长的过程,但突变株没有,两株细菌的生长曲线出现了差异,同时培养液的pH值突变株也比野生株偏碱性。金黄色葡萄球菌cidC基因编码丙酮酸激酶,能催化丙酮酸氧化脱羧生成乙酸和二氧化碳。与野生株相比,cidC敲除突变株在平台期有一个二次生长的过程, 作者认为这是由于突变株中乙酸的浓度适合作为碳源进行能量代谢的结果,而野生株中因cidC基因的存在而造成乙酸浓度过高,从而影响了细菌的生存[16]。空肠弯曲菌在平台期也有一个二次生长的过程,形成双峰生长曲线,Martínez-Rodriguez等人也认为这是丙酮酸的代谢产物乙酸在平台期被作为碳源进行代谢的结果[17-18]。综上所述,我们推测在表皮葡萄球菌中也存在利用乙酸或者丙酮酸的其他代谢产物作为碳源进行能量代谢的机制,而serp2169基因可能是参与这一机制的关键基因。
细菌的代谢状态可影响生物膜的形成,抑制三羧酸循环可促进生物膜形成能力增强[19]。因此,我们检测了serp2169突变株的生物膜形成情况,发现与野生株相比无显著变化,表明serp2169基因可能不影响表皮葡萄球菌生物膜的形成。
参考文献:
[1]Otto M.Staphylococcusepidermidis--the 'accidental' pathogen[J]. Nat Rev Microbiol, 2009, 7(8): 555-567. DOI: 10.1038/nrmicro2182
[2]Knobloch JKM, Bartscht K, Sabottke A, et al. Biofilm formation byStaphylococcusepidermidisdepends on functional RsbU, an activator of the sigB operon: differential activation mechanisms due to ethanol and salt stress[J]. J Bacteriol, 2001, 183(8): 2624-2633. DOI: 10.1128/JB.183.8.2624-2633.2001
[3]Mikkelsen H, Sivaneson M, Filloux A. Key two-component regulatory systems that control biofilm formation inPseudomonasaeruginosa[J]. Environ Microbiol, 2011, 13(7): 1666-1681. DOI: 10.1111/j.1462-2920.2011.02495.x
[4]Stock AM, Robinson VL, Goudreau PN. Two-component signal transduction[J]. Annual Rev Biochem, 2000, 69(1): 183-215. DOI: 10.1146/annurev.biochem.69.1.183
[5]Dubrac S, Boneca IG, Poupel O, et al. New insights into the WalK/WalR (YycG/YycF) essential signal transduction pathway reveal a major role in controlling cell wall metabolism and biofilm formation inStaphylococcusaureus[J]. J Bacteriol, 2007, 189(22): 8257-8269. DOI: 10.1128/JB.00645-07
[6]Wu Y, Wang J, Xu T, et al. The two-component signal transduction system ArlRS regulatesStaphylococcusepidermidisbiofilm formation in an ica-dependent manner[J]. PLoS One, 2012, 7(7): e40041. DOI: 10.1371/journal.pone.0040041
[7]Ulrich M, Bastian M, Cramton SE, et al. The staphylococcal respiratory response regulator SrrAB induces ica gene transcription and polysaccharide intercellular adhesin expression, protectingStaphylococcusaureusfrom neutrophil killing under anaerobic growth conditions[J]. Mol Microbiol, 2007, 65(5): 1276-1287. DOI: 10.1111/j.1365-2958.2007.05863.x
[8]Zhu T, Lou Q, Wu Y, et al. Impact of theStaphylococcusepidermidisLytSR two-component regulatory system on murein hydrolase activity, pyruvate utilization and global transcriptional profile[J]. BMC Microbiol, 2010, 10(1): 287. DOI: 10.1186/1471-2180-10-287
[9]Petrova OE, Schurr JR, Schurr MJ, et al. Microcolony formation by the opportunistic pathogenPseudomonasaeruginosarequires pyruvate and pyruvate fermentation[J]. Mol Microbiol, 2012, 86(4): 819-835. DOI: 10.1111/mmi.12018
[10]Gill SR, Fouts DE, Archer GL, et al. Insights on evolution of virulence and resistance from the complete genome analysis of an early methicillin-resistantStaphylococcusaureusstrain and a biofilm-producing methicillin-resistantStaphylococcusepidermidisstrain[J]. J Bacteriol, 2005, 187(7): 2426-2438. DOI: 10.1128/JB.187.7.2426-2438.2005
[11]Arnaud M, Chastanet A, Debarbouille M. New vector for efficient allelic replacement in naturally nontransformable, low-GC-content, gram-positive bacteria[J]. Appl Environ Microbiol, 2004, 70(11): 6887-6891. DOI: 10.1128/AEM.70.11.6887-6891.2004
[12]Vuong C, Gerke C, Somerville GA, et al. Quorum-sensing control of biofilm factors inStaphylococcusepidermidis[J]. J Infect Dis, 2003, 188(5): 706-718. DOI: 10.1086/377239
[13]Kretzschmar U, Ruckert A, Jeoung JH, et al. Malate: quinone oxidoreductase is essential for growth on ethanol or acetate inPseudomonasaeruginosa[J]. Microbiology, 2002, 148(12): 3839-3847.
[14]Nakanishi T, Nakatsu T, Matsuoka M, et al. Crystal structures of pyruvate phosphate dikinase from maize revealed an alternative conformation in the swiveling-domain motion[J]. Biochemistry, 2005, 44(4): 1136-1144. DOI: 10.1021/bi0484522
[15]Pocalyko DJ, Carroll LJ, Martin BM, et al. Analysis of sequence homologies in plant and bacterial pyruvate phosphate dikinase, enzyme I of the bacterial phospoenolpyruvate: sugar phosphotransferase system and other PEP-utilizing enzymes. Identification of potential catalytic and regulatory motifs[J]. Biochemistry, 1990, 29(48): 10757-10765. DOI: 10.1021/bi00500a006
[16]Patton TG, Rice KC, Foster MK, et al. TheStaphylococcusaureuscidC gene encodes a pyruvate oxidase that affects acetate metabolism and cell death in stationary phase[J]. Mol Microbiol, 2005, 56(6): 1664-1674. DOI: 10.1111/j.1365-2958.2005.04653.x
[17]Wright JA, Grant AJ, Hurd D, et al. Metabolite and transcriptome analysis ofCampylobacterjejuniinvitrogrowth reveals a stationary-phase physiological switch[J]. Microbiology, 2009, 155(1): 80-94. DOI: 10.1099/mic.0.021790-0
[18]Martnez-Rodriguez A, Kelly AF, Park SF, et al. Emergence of variants with altered survival properties in stationary phase cultures ofCampylobacterjejuni[J]. Int J Food Microbiol, 2004, 90(3): 321-329. DOI: 10.1016/S0168-1605(03)00325-8
[19]Zhu Y, Xiong YQ, Sadykov MR, et al. Tricarboxylic acid cycle-dependent attenuation ofStaphylococcusaureusinvivovirulence by selective inhibition of amino acid transport[J]. Infect Immun, 2009, 77(10): 4256-4264. DOI:10.1128/IAI.00195-09
