猪带绦虫TSO45W-4B-TSOL18融合基因在长双歧杆菌中的表达
2014-04-02周必英刘美辰杨凤娇
周必英,刘美辰,杨凤娇
猪囊尾蚴病(Cysticercosis cellulosae)又称囊虫病(Cysticercosis),是由猪带绦虫(Taeniasolium)的幼虫囊尾蚴寄生于人或猪等而引起的人畜共患寄生虫病,已成为全球性的公共卫生问题,在我国的感染率为0.14%~3.20%。药物及手术治疗都有其局限性,疫苗防治该病已成为当前研究热点[1-2]。研究表明,猪带绦虫六钩蚴TSO45W-4B和TSOL18基因均具有良好的免疫原性和免疫保护性,是一种理想的疫苗候选抗原[3-6]。双歧杆菌(Bifidobacteria)是人和哺乳动物的肠道益生菌,也是一种基因工程受体菌。本研究拟在成功构建猪带绦虫大肠杆菌-双歧杆菌穿梭表达质粒pGEX-TSO45W-4B-TSOL18的基础上[7],研究猪带绦虫TSO45W-4B-TSOL18融合基因在长双歧杆菌中的表达情况。
1 材料与方法
1.1质粒和菌种 猪带绦虫重组质粒pGEX-TSO45W-4B-TSOL18由本课题组制备保存[7];长双歧杆菌(B.longum)购自美国菌种典藏中心。
1.2主要试剂和仪器 质粒小量抽提试剂盒、DNA纯化试剂盒购自美国Axygen公司;T4DNA连接酶、DNA Marker、BamHI和EcoRI购自日本Takara公司;MRS培养基购自美国Difico公司;兔抗血清由本室制备[8-10],囊虫病猪血清采集自建的囊虫病猪感染模型,囊虫病患者血清由四川省疾病预防控制中心提供;其余试剂均为国产分析纯。核酸电泳装置购自北京六一仪器厂;PCR 仪购自美国 MJ-Research公司;厌氧发生器购自法国梅里埃公司。
1.3重组质粒pGEX-TSO45W-4B-TSOL18电转化长双歧杆菌 将购自的B.longum冻干粉用无菌水充分溶解后,涂布于MRS琼脂平板上,37 ℃厌氧培养24~72 h,使其充分活化;挑取活化的单菌落,接种于4mlMRS液体培养中,37 ℃厌氧培养至菌体OD600nm值为0.5左右;按1∶25比例接种于MRS培养基中,37 ℃厌氧培养24~72 h;冰浴30 min,4 ℃10 000 r/min离心1 min,弃上清,沉淀用预冷的0.5 mol/L蔗糖清洗2次,再用100 μL 0.5 mol/L蔗糖缓冲液重悬。取100 μL与重组质粒pGEX-TSO45W-4B-TSOL18 1 μg混匀,冰浴10~15 min后转移至至1 mm的电击杯中,电击参数设置为:电压1.25 KV、场强12.5 KV/cm、电容25 μF、电阻 200 Ω、转化时间5 ms;电击完毕后立即将混合液转入到900 μL MRS液体培养基的EP管中,37 ℃厌氧培养2 h;将菌液涂布于含100 μg/mL氨苄青霉素的MRS琼脂平板上,37 ℃厌氧培养24~72 h。挑取上述平板中单个菌落至1 mL含100 μg/mL氨苄青霉素的MRS培养基的EP管中,37 ℃厌氧培养24~72 h;将菌液4 ℃10 000 r/min离心5 min,弃上清,沉淀中加入250 μL 25%蔗糖溶液重溶菌体沉淀,37 ℃温浴30 min,期间每隔5 min振荡1次,使其充分反应;抽提质粒,进行酶切、PCR和测序鉴定。筛选阳性的转化菌株作为表达菌株进行诱导表达实验。
1.4TSO45W-4B-TSOL18融合基因在长双歧杆菌中的表达 选取电转化阳性的转化菌,接种于MRS液体培养基,37 ℃厌氧培养至OD值为0.6左右,取未诱导的菌液作对照,余下分别加入终浓度为0.1 mmol/L、0.5 mmol/L、1.0 mmol/L IPTG 37 ℃诱导表达48 h。分别将未诱导与诱导菌液离心收集菌体,重悬于预冷PBS缓冲液中。在冰浴中超声裂解20 min,4 ℃ 6 000 r/min离心15 min,留取诱导上清及诱导沉淀,用12% SDS-PAGE和Western blot鉴定表达的重组蛋白。
2 结 果
2.1B.longum中重组质粒pGEX-TSO45W-4B-TSOL18的酶切鉴定 从具有氨苄青霉素抗性的B.longum中抽提的重组质粒pGEX-TSO45W-4B-TSOL18,经BamHⅠ和EcoRⅠ双酶切,用1%琼脂糖凝胶电泳,得到4 944 bp的pGEX-1λT载体片段和789 bp(351 bp+45 bp+393 bp=789 bp)的TSO45W-4B-TSOL18融合基因片段,与预期结果相符,见图1。
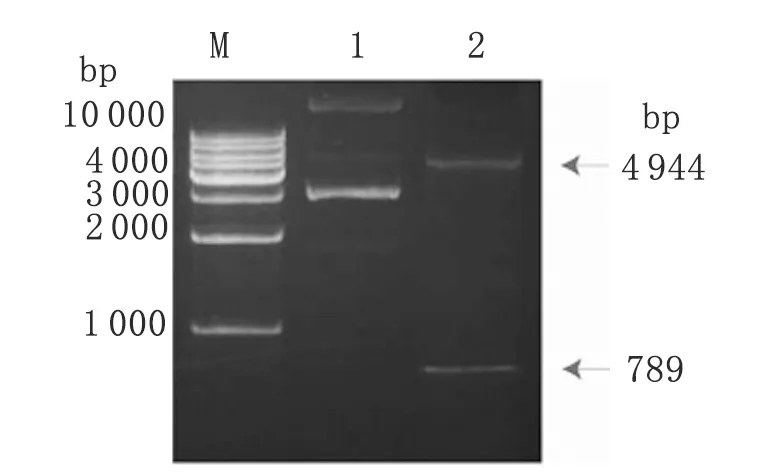
图1B.longum中重组质粒pGEX-TSO45W-4B-TSOL18的双酶切鉴定
Fig.1IdentificationofrestrictionanalysisoftherecombinantplasmidpGEX-TSO45W-4B-TSOL18inB.longum
M: Marker; 1: The recombinant plasmid pGEX-TSO45W-4B-TSOL18; 2: Restriction analysis of the recombinant plasmid pGEX-TSO45W-4B-TSOL18 inB.longumwithBamHⅠ andEcoRⅠ.
2.2B.longum中重组质粒pGEX-TSO45W-4B-TSOL18的PCR鉴定以从具有氨苄青霉素抗性的B.longum中抽提的重组质粒pGEX-TSO45W-4B-TSOL18为模板进行PCR扩增可得到888 bp的基因片段,除去载体序列99 bp,TSO45W-4B-TSOL18融合基因实际的长度为789 bp,与预期结果相符,见图2。测序结果表明,与预期序列100%匹配,提示重组质粒pGEX-TSO45W-4B-TSOL18成功转入长双歧杆菌。
2.3TSO45W-4B-TSOL18融合基因在长双歧杆菌中的表达 转化后的菌株菌体浓度达到OD值0.6左右时,分别经0.1 mmol/L,0.5 mmol/L,1.0 mmol/L 浓度的IPTG诱导,重组蛋白大小理论值为54.82 kD。其中GST标签蛋白26.3 kD,经SDS-PAGE分析显示,在诱导48 h后上清中55 kD处无明显的蛋白条带出现,而在沉淀中诱导前后出现了明显的条带差异,且大小与理论的分子量54.82 kD相吻合,初步判断蛋白成功表达,分布于沉淀中,见图3。

图2B.longum中重组质粒pGEX-TSO45W-4B-TSOL18的PCR鉴定
Fig.2IdentificationofPCRoftherecombinantplasmidpGEX-TSO45W-4B-TSOL18inB.longum
M: Marker; 1-7: PCR product of the recombinant plasmid pGEX-TSO45W-4B-TSOL18 inB.longum.

图337℃IPIG诱导48h表达鉴定
Fig.3IdentificationofexpressionafterinductionwithIPTGat37℃for48h
M: Marker; 1: Supernatant without induction;
2: Supernatant induced with 0.1 mmol/L IPTG for 48 h; 3: Supernatant induced with 0.5 mmol/L IPTG for 48 h; 4: Supernatant induced with 1.0 mmol/L IPTG for 48 h; 5: Precipitation without induction; 6: Precipitation induced with 0.1 mmol/L IPTG for 48 h; 7: Precipitation induced with 0.5 mmol/L IPTG for 48 h; 8: Precipitation induced with 1.0 mmol/L IPTG for 48 h.
2.4Western blot鉴定 分别使用兔抗血清、囊虫病猪血清、囊虫病患者血清与重组蛋白杂交,检测结果如图4所示,重溶后的重组蛋白有特异性的结合,在55 kD处出现明显的反应带,说明重组蛋白在长双歧杆菌中获得了表达,且重组蛋白能被兔抗血清、囊虫病猪血清和囊虫病患者血清所识别,具有特异的抗原性。

图4Westernblot鉴定
Fig.4Westernblotidentification
1: Rabbit antiserum of TSO45W-4B; 2: Rabbit antiserum of TSOL18; 3: Rabbit antiserum of TSO45W-4B-TSOL18; 4: Cysticercosis swine serum; 5: Cysticercosis patients serum; 6: Blank control.
3 讨 论
猪带绦虫疫苗研究已有20多年的历史,大体上经历了虫体疫苗、重组蛋白疫苗、合成肽疫苗、DNA疫苗、重组酵母疫苗、重组家蚕杆状病毒疫苗、重组鼠伤寒沙门氏杆菌疫苗这几个研究阶段,涉及到TSO45W-4B、TSOL18、cC1、AgB等重要抗原分子。其中TSO45W-4B和TSOL18与六钩蚴的入侵密切相关,具有良好的免疫原性和免疫保护性,是理想的疫苗候选抗原[11-12]。由于宿主MHC分子的多样性和猪带绦虫抗原成分的复杂性,宿主将针对抗原的多个表位产生免疫反应,使得单一抗原成分诱导宿主产生的保护性免疫应答效果往往较低,为此,本研究将免疫及保护效果肯定的两种抗原TSO45W-4B、TSOL18编码基因用15个氨基酸的接头连接,表达融合蛋白。
双歧杆菌(Bb)因其具有独特的安全性和益生的作用,随着基因工程技术的发展,以其为宿主菌的基因治疗、功能蛋白表达和疫苗制备等方面的研究受到了国内外学者的极大关注,已在细菌、病毒、肿瘤、寄生虫等领域迅速开展起来[13-16],为传染病、肿瘤和寄生虫病的免疫预防和免疫治疗带来了希望。为了将外源DNA有效引入Bb,需构建大肠杆菌-双歧杆菌穿梭表达载体,本研究采用穿梭表达载体pGEX-1λT,这种穿梭表达载体含有Bb复制起点、大肠杆菌复制起点、一个多克隆位点和一个氨苄青霉素抗性基因,使外源DNA在大肠杆菌中操作,然后转化双歧杆菌,通过自动复制或同源整合与基因组进行基因交换,从而使外源基因在Bb中稳定表达。本研究在大肠杆菌中成功表达猪带绦虫TSO45W-4B-TSOL18融合基因的基础上[8-10],将构建的重组质粒pGEX-TSO45W-4B-TSOL18电穿孔转化B.longum,经IPTG 37 ℃诱导表达48 h,SDS-PAGE结果显示插入的外源融合基因TSO45W-4B-TSOL18在B.longum中成功表达了相对分子质量约为55 kDa的TSO45W-4B-TSOL18/GST融合蛋白,除去载体表达的GST部分约26 kDa,猪带绦虫TSO45W-4B-TSOL18融合基因实际表达的蛋白约为29 kDa,与预期结果相符。Western blot显示,重组融合蛋白能被兔抗TSO45W-4B血清、兔抗TSOL18血清、兔抗TSO45W-4B-TSOL18血清、囊虫病猪血清和囊虫病患者血清所识别。表明TSO45W-4B-TSOL18融合基因在双歧杆菌中也得到了正确表达,表达的重组融合蛋白具有特异的抗原性,且兼具有TSO45W-4B与TSOL18两种单独蛋白的免疫活性,为猪囊尾蚴病疫苗的进一步研究奠定了基础。
参考文献:
[1]Ito A, Urbani C, Jiamin Q, et al. Control of echinococcosis and cysticercosis: a public health challenge to international cooperation in China[J]. Acta Tropica, 2003, 86(1): 3-17.
[2]Zhou BY, Chen YT, Li WG. Research status on DNA vaccine against cysticercus cellulosae infection[J].Chin J Parasitol Parasit Dis, 2010, 28(2): 148-152. (in Chinese)
周必英,陈雅棠,李文桂.猪囊尾蚴病DNA疫苗研究现状[J].中国寄生虫学与寄生虫病杂志,2010, 28(2):148-152.
[3]Wang FM, Luo XN, Jing ZZ, et al. Study on immunogenicity in pigs elicited by recombinant protein 45W-4B vaccine ofTaeniasoliumoncosphere[J]. Chin J Vet Parasitol, 2006, 14(3): 1-5. (in Chinese)
王福梅,骆学农,景志忠,等.猪带绦虫六钩蚴45W-4B重组蛋白的免疫原性研究[J].中国兽医寄生虫病,2006,14(3):1-5.
[4]Luo XN, Zheng YD, Hou JL, et al. Protection against AsiaticTaeniasoliuminduced by a recombinant 45W-4B protein[J]. Clin Vaccine Immunol, 2009, 16(2): 230-232.
[5]Cai XP, Yuan GL, Zheng YD, et al. Effective production and purification of the Glycosylated TSOL18 antigen, which is proactive against pig cysticercosis[J]. Infect Immun, 2008, 76(2): 767-770.
[6]Ding J, Zheng Y, Wang Y, et al. Immune responses to a recombinant attenuatedSalmonellatyphimuriumstrain expressing aTaeniasoliumoncosphere antigen TSOL18[J]. Comp Immunol Microbiol Infect Dis, 2013, 36(1): 17-23.
[7]Zhou BY, Liu MC, He LF. Construction and identification of a recombinant Bb (pGEX-TSO45W-4B-TSOL18) vaccine ofTaeniasolium[J]. Chin J Pathogen Biol, 2014, 9(4): 289-292,298. (in Chinese)
周必英,刘美辰,贺利芳.猪带绦虫重组Bb(pGEX-TSO45W-4B-TSOL18)疫苗的构建及鉴定[J].中国病原生物学杂志,2014,9(4):289-292,298.
[8]Zhou BY, Zhou L, Liu MC, et al. Expression, purification and preparation of rabbit antiserum of the gene TSOL18 ofTaeniasolium[J]. Chin J Zoonoses, 2013, 29(10): 977-980, 985. (in Chinese)
周必英,周泠,刘美辰,等.猪带绦虫TSOL18基因的表达、纯化和兔抗血清的制备[J].中国人兽共患病学报,2013,29(10):977-980,985.
[9]Zhou BY, Zhou L, Liu MC, et al. Cloning, expression of TSO45W-4B gene fromTaeniasoliumand preparation of its polyclonal antibody[J]. Chin J Parasitol Parasit Dis, 2013, 31(5): 372-375. (in Chinese)
周必英,周泠,刘美辰,等.猪带绦虫TSO45W-4B基因的克隆、表达和兔抗血清的制备[J].中国寄生虫学与寄生虫病杂志,2013,31(5):372-375.
[10]Zhou BY, Zhou L, Liu MC, et al. Expression and purification of a fusion gene TSO45W-4B-TSOL18 ofTaeniasoliuminEscherichiacoliArctic Express(DE3)and preparation of rabbit antiserum[J]. Chin J Endemiol, 2013, 32(6): 619-624. (in Chinese)
周必英,周泠,刘美辰,等.猪带绦虫TSO45W-4B-TSOL18融合基因在大肠埃希菌ArcticExpress(DE3)中的表达、纯化和兔抗血清的制备[J].中国地方病学杂志,2013,32(6):619-624.
[11]Li WG, Chen YT. Status of research on a 45W protein vaccine forTaeniasolium[J]. Chin J Pathog Biol, 2012, 7(3): 235-237, 207. (in Chinese)
李文桂,陈雅棠.猪带绦虫45W蛋白疫苗的研制现状[J].中国病原生物学杂志,2012,7(3):235-237,207.
[12]Li WG, Chen YT. The status in the research of TSOL18 vaccine forTaeniasolium[J]. Int J Med Parasit Dis, 2012, 39(2): 116-119. (in Chinese)
李文桂,陈雅棠.猪带绦虫TSOL18疫苗的研制现状[J].国际医学寄生虫病杂志,2012,39(2):116-119.
[13]Wang GF, Gao F, Wu LX. Construction of recombinantBb-hpaA-vacA vaccine ofHelicobacterpylori[J]. Chin J Zoonoses, 2012, 28(2): 131-134. (in Chinese)
王国富,高峰,吴利先.幽门螺杆菌重组Bb-hpaA-vacA疫苗的构建[J].中国人兽共患病学报,2012,28(2):131-134.
[14]Li SB, Li J, He ZL, et al. Construction and identification of prokaryotic shuttle expression plasmid for human rotavirus wholevp4 gene[J]. Chin J Biologicals, 2011, 24(10): 1126-1129. (in Chinese)
李世彬,李江,贺志良,等.人轮状病毒vp4全基因原核穿梭表达质粒的构建及鉴定[J].中国生物制品学杂志,2011,24(10):1126-1129.
[15]An LN, Li ZH, Yue Y, et al. Gene therapy for melanoma byBifidobacteriumInfantis-mediated transfer of CD and UPRT genes with 5-FCinvitro[J]. J Sichuan Univ:Med Sci Edi, 2007, 38(1): 27-30. (in Chinese)
安丽娜,李著华,岳扬,等.婴儿双歧杆菌介导的CD 和UPRT 联合5-FC 基因疗法对黑色素瘤的体外治疗实验研究[J].四川大学学报:医学版,2007,38(1):27-30.
[16]Xing JP, Li WG. Research progress on the recombinantBifidobacteriumbifidumvaccine against parasitic diseases[J]. Int J Med Parasit Dis, 2012, 39(2): 120-123. (in Chinese)
向进平,李文桂.寄生虫重组双歧杆菌疫苗研究进展[J].国际医学寄生虫病杂志,2012,39(2):120-123.
