外源一氧化氮对镉胁迫下长春花质膜过氧化、ATPase及矿质营养吸收的影响
2014-04-01刘柿良潘远智杨容孑丁继军马明东
刘柿良, 潘远智, 杨容孑, 丁继军, 何 杨, 王 力, 马明东
(四川农业大学风景园林学院,成都 611130)

近年来, 东南景天(Sedumalfredii)和龙葵(Solanumnigrum)等镉超富集植物(Hyperaccumulators)在镉污染土壤的修复中已被广泛应用, 但这些植物大部分生长缓慢、 重金属迁移量较小且景观价值不高,仅适合作重金属抗性机理的理论研究,不适宜城市大面积污染土壤的修复[9]。然而园林地被花卉植物具有个体小、 种类多、 生长快等特点,生长一段时间后被整株移出,不会造成土壤二次污染, 而且可以获得景观和生态效应[10-11]。若能从繁多的花卉资源中筛选出修复重金属污染土壤具重要作用的地被植物,将为植物修复开辟新途径。长春花(Catharanthusroseus)是我国广泛栽培的多年生草本花卉植物, 因其体内含有多种具有抗癌活性的生物碱,已成为国际上研究和应用最多的抗癌药源植物[12]。先前研究发现, 长春花对镉胁迫具有较强的耐性, 为城市园林绿化和净化重金属污染土壤提供了可能[9-10]。目前对长春花的研究主要集中在生物半合成[12]和盐胁迫[13]等方面, 而关于外源一氧化氮缓解土壤镉胁迫的研究还尚未见报道。因此,本研究以长春花(C.roseus)为材料,采用盆栽试验研究镉胁迫对长春花质膜过氧化、 ATPase活性及矿质营养元素吸收的影响,探讨外源一氧化氮缓解长春花镉胁迫的机制,以期为Cd 污染的防治提供理论依据。
1 材料与方法
1.1 供试材料
供试土壤采自试验地周边未开垦的自然土壤(不含腐叶根), 采样深度0—20 cm。发酵土由四川省成都市温江区花木交易中心提供;供试植物长春花(C.roseus)幼苗由成都市郫县静菊花木服务有限公司提供;外源NO供体为硝普钠(SNP,购自德国Merck公司)。添加的Cd2+用CdC12·2.5H2O(分析纯)。
1.2 试验设计
2012年4月10日至5月16日,将采集的土壤自然风干、 捣碎、 剔除杂物,研磨,过5 mm筛, 按照1 ∶1比例将发酵土和自然土壤均匀混合成种植土,并用适量多菌灵消毒,堆积静置45 d。种植土有机碳含量38.75 g/kg、 全氮0.73 g/kg、 全磷0.52 g/kg、 全钾3.28 g/kg、 总镉0.475 mg/kg(有效态镉为0.274 mg/kg)、 pH 6.5。试验用盆为带托盘的塑料盆(下口径 20 cm、 上口径30 cm、 深25 cm),每盆装种植土(干土)8 kg,备用。

植物恢复生长后, 于2012年5月25日开始进行预试验。根据国家土壤环境质量标准和四川盆地重金属污染发展概况[1], 预试验以不添加镉作为对照(CK),镉处理水平设为: PT1(preliminary test 1, 5 mg/kg Cd2+);PT2(10 mg/kg Cd2+);PT3(25 mg/kg Cd2+);PT4(50 mg/kg Cd2+);PT5(100 mg/kg Cd2+)。按设计的Cd2+浓度将分析纯 CdCl2·2.5H2O 与蒸馏水配制成500 mL溶液均匀施入相应的盆中(渗出液反复回收浇灌,直到Cd2+与土壤均匀混合)[9-10],每处理4次重复。试验 45 d后,根据幼苗生物量和相对生长速率(RGR)[14-15]筛选出25 mg/kg Cd2+为镉胁迫浓度。
1.2.2 外源一氧化氮试验 2012 年7月7日,按照 1.2.1 的方法进行长春花幼苗移栽。待幼苗恢复生长后(约 7 d),于 2012 年 7 月 16 日进行外源一氧化氮(NO)处理试验。在筛选出的25 mg/kg Cd2+胁迫浓度的基础上,设置不同浓度的 NO 的处理,该试验共设7个处理: 1) CK,不添加 SNP 和 Cd2+;2) Cd,25 mg/kg Cd2+;3)T1,25 mg/kg Cd2++0.45 mg/kg SNP; 4)T2,25 mg/kg Cd2++0.90 mg/kg SNP; 5)T3,25 mg/kg Cd2++1.80 mg/kg SNP; 6)T4, 25 mg/kg Cd2++3.60 mg/kg SNP; 7)T5, 25 mg/kg Cd2++7.20 mg/kg SNP。每处理 4 次重复,一氧化氮供体为硝普钠—Na2[Fe(CN)5NO]·2H2O,加入到25 mg/kg Cd2+胁迫溶液中,将其均匀施入到相应的塑料盆中。试验期间,精细管理,防止病虫害,保证持水量。

1.3 测定项目与方法
1.3.1 生长指标和生物量测定 长春花镉胁迫试验中,于 2012年 5月 29日和6月8日(即植物镉胁迫处理后的第 5 d 和第 15 d)随机选取不同浓度镉处理下的植株测定生长指标,每盆2株。利用 Li-3000C(Li-Cor, Lincoln, Nebraska, USA)便携式叶面积仪依次测定植株叶长和叶宽。用游标卡尺测量根长(主根长)、 株高(顶端到地面的垂直高度)和基径,并计算单株总叶片数。随机选取完整幼苗,整株洗净,在105℃杀青30 min后在 80℃ 烘箱内烘干 48 h 后称量。根据第 5 d 和第 15 d 植株总生物量统计数据,计算相对生长速率(RGR),计算公式为: RGR=(lnW2-lnW1)/(T2-T1)。式中: W1和 W2分别表示前、 后两次收获时的总生物量; (T2-T1) 表示测量间隔时间[16]。

1.3.3 抗氧化酶活性的测定 取植株地上部和根系样品,分别剪碎混合后随机取 0.5 g,放在研钵中加入5.0 mL 0.05 mol/L pH 值7.8 的Na2HPO4-NaH2PO4磷酸缓冲液(PBS,内含1% PVP)及少量石英砂,于冰浴中研磨提取,于15000×g4℃ 下离心 15 min,上清液定容至10 mL,上清液为酶提取液。过氧化氢酶(CAT)活性的测定采用紫外吸收法[20];超氧化物歧化酶(SOD)活性用 NBT(氮蓝四唑)法测定[21];过氧化物酶(POD)活性采用愈创木酚法在 470 nm下测定[22];还原型谷胱甘肽(GSH)含量参照 Nagalakshmi 和 Prasad[23]的方法,采用巯基试剂 DTNB (2-硝基苯甲酸)测定。
1.3.4 质膜 ATP酶和5′-核苷酸酶活性的测定 质膜分离参照Wang和Sze[24]的方法并略作改动。取2.0 g鲜样加入2倍(w/v)体积预冷的磷酸盐缓冲液[Hepes-Tris 25 mmol/L、 pH 7.6、 甘露醇 250 mmol/L、 EGTA 5.0 mmol/L、 乙二胺四乙酸 (EDTA) 5.0 mmol/L、 KCl 10 mmol/L、 苯甲基磺酰氟 (PMSF) 2.0 mmol/L、 1.5% 聚乙烯吡咯烷酮 (PVP)、 0.5%牛血清蛋白 (BSA)、 抗氧化剂 (BHT) 5 μg/L、 K2S2O55.0 mmol/L、 二硫苏糖醇 (DTT) 1.0 mmol/L],冰浴研磨。研磨液经 4 层纱布过滤,滤液于13000×g离心 30 min, 取上清液再于 60000×g离心30 min, 弃上清液, 沉淀悬浮于 1.0 mL的悬浮液 PBS(Hepes-Tris 2.5 mmol/L、 pH 7.6、 甘露醇 250 mmol/L、 EDTA 1 mmol/L、 DTT 1.0 mmol/L)中,置于不连续梯度有蔗糖溶液(45%、 36% 和22%)中,经70000×g离心2 h,36% 和 45% 间带溶液为质膜微囊,取出测定 ATPase 活性。质膜H+-ATPase活性的测定采用 Wang 和 Sze[24]的方法; 质膜Ca2+-ATPase 活性的测定参照缪颖等[25]的方法; 5'-核苷酸酶(5′-AMPase)的提取及其活性按照潘杰等[26]的方法测定。

1.4 数据分析
试验数据均用 SPSS17.0 软件进行单因素方差检验(One-way ANOVA)和最小显著性差异法检验(LSD),显著性水平为α=0.05。
2 结果与分析
2.1 不同浓度镉胁迫对长春花生长的影响
不同浓度镉胁迫显著影响长春花生物量的生产和分配,且随着镉浓度增加先升后降(表1)。与对照(CK)相比, PT1和PT2处理(5和10 mg/kg Cd2+)并未明显促进长春花生物量的增加;总生物量和根、 茎生物量在PT3处理(25 mg/kg Cd2+)下降低显著, 叶生物量则无显著变化。相同镉浓度处理下,叶生物量占总生物量的比例最高, 根系最低。同时,根/茎比(R/S)对镉胁迫差异显著,PT2处理下达到最大值, 而后随着镉浓度的增加而下降。 PT1与PT2处理下相对生长速率(RGR)比CK降低16.16% 和22.82%。PT3处理下RGR比CK降低45.32%, 对植物生长造成了严重抑制, 但此时又能表现出对重金属的抗性。因此,选用25 mg/kg Cd2+(PT2)为镉胁迫的处理浓度。
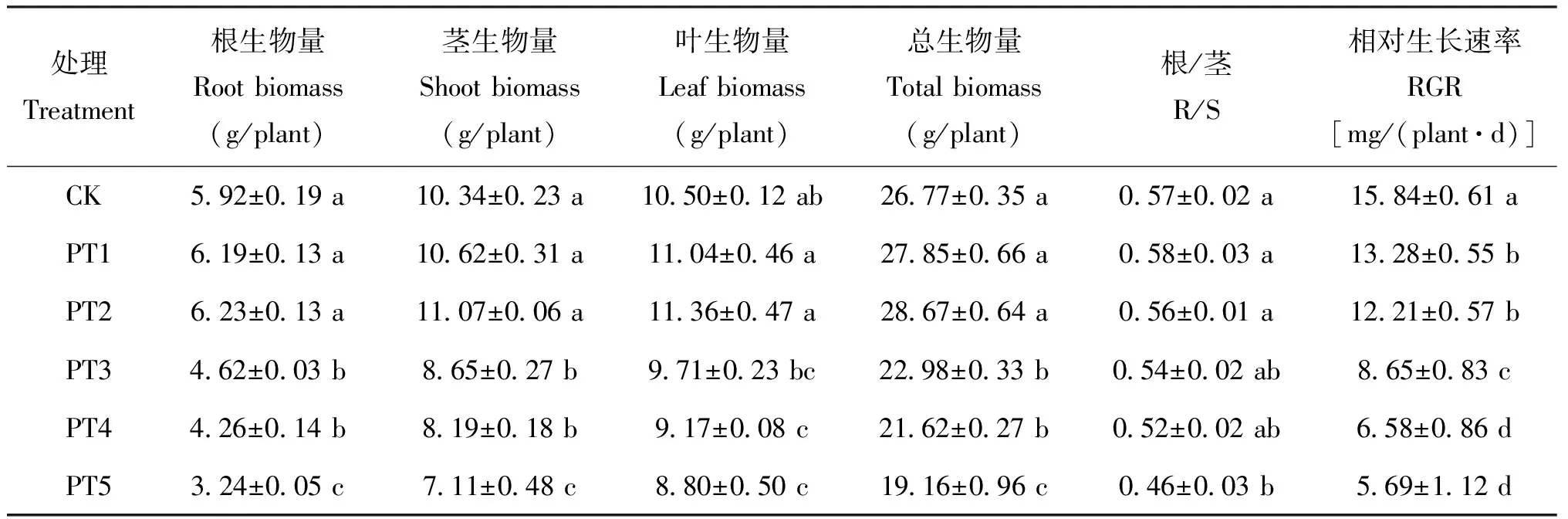
表1 不同镉浓度处理对长春花生物量和相对生长速率的影响Table 1 Effect of biomass and relative growth rate (PGR) of C. roseus under different Cd concentration treatments
注(Note): R/S —Ratio of root to shoot; RGR—Relative growth rate. 同列数据后不同字母表示处理间差异达5%显著水平 Values followed by different letters in a column are significant among treatments at the 5% level.
2.2 镉胁迫下外源一氧化氮(NO)对长春花形态和生物量的影响
表2显示,与CK相比,镉胁迫下叶性状(叶数、 叶长、 叶宽), 根长, 株高和基径显著降低,表明25 mg/kg Cd2+镉胁迫明显抑制了植株生长。当添加0.45 mg/kg (T1)、 0.90 mg/kg(T2)、 1.80 mg/kg(T3)SNP时,生长抑制现象得到了明显缓解,特别是T3处理更为显著。T3处理与Cd相比叶数、 叶长、 叶宽、 根长、 株高和基径分别提高了6.69%、 2.63%、 8.65%、 21.52%、 14.57% 和7.04%。随着SNP处理浓度的升高,T4和T5处理(添加3.60和7.20 mg/kg SNP)的植株形态参数逐渐降低。同时,植株生物量具有与植株形态相似的变化趋势(图1)。

表2 镉胁迫下不同浓度SNP对长春花的叶数、 叶长、 叶宽、 根长、 株高和基径的影响Table 2 Effect of different concentrations of SNP supply on leaf number, leaf length, root length, plant height, leaf width and basal diameter of C. roseus under Cd stress
注(Note): 同列数据后不同字母表示处理间差异达5%显著水平 Values followed by different letters in a column are significant among treatments at the 5% level.
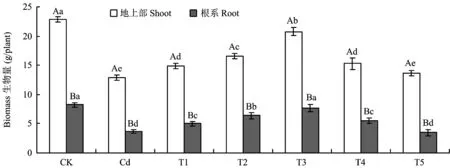
图1 镉胁迫下不同浓度SNP处理对长春花生物量的影响Fig.1 Effects of different concentrations of SNP supply on biomass production of C. roseus under Cd stress[注(Note): 柱上不同小写字母表示相同部位生物量在不同处理间差异达5%显著水平 Different small letters above the bars indicate significant among different treatments for the same tissue at the 5% level; 柱上不同大写字母表示相同处理下地上部和根系生物量间差异达5%显著水平Different capital letters indicate significant in biomass of shoots and roots under the same treatments at the 5% level.]

图2 镉胁迫下不同浓度SNP处理对长春花镉富集量的影响Fig.2 Effects of different concentrations of SNP supply on Cd accumulation of C. roseus under Cd stress[注(Note): 柱上不同小写字母表示相同部位在不同处理间差异达5%显著水平 Different small letters above the bars indicate significant among different treatments for the same tissue at the 5% level; 柱上不同大写字母表示相同处理下地上部和根系间Cd富集量差异达5%显著水平Different capital letters indicate significant in Cd accumulation of shoots and roots under the same treatments at the 5% level.]
2.3 镉胁迫下外源一氧化氮(NO)对长春花镉富集量的影响
地上部和根系镉富集量较CK显著升高(图2)。T3(添加1.80 mg/kg SNP)处理的地上部镉富集量最低,较Cd处理降低56.76%; 根系的镉富集量最高,较Cd处理升高68.67%。表明适当浓度的外源NO能影响对镉的吸收与转运。相同处理下,根系镉含量显著高于地上部,镉趋于富集在植物的根部。

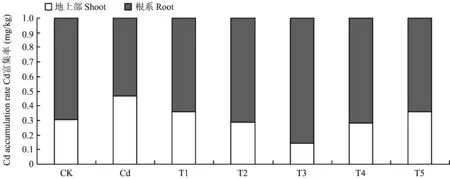
图3 镉胁迫下不同浓度SNP处理对长春花镉富集率的影响Fig.3 Effects of different concentrations of SNP supply on cadmium accumulation rate of C. roseus
2.4 镉胁迫下外源一氧化氮(NO)对长春花矿质营养吸收的影响

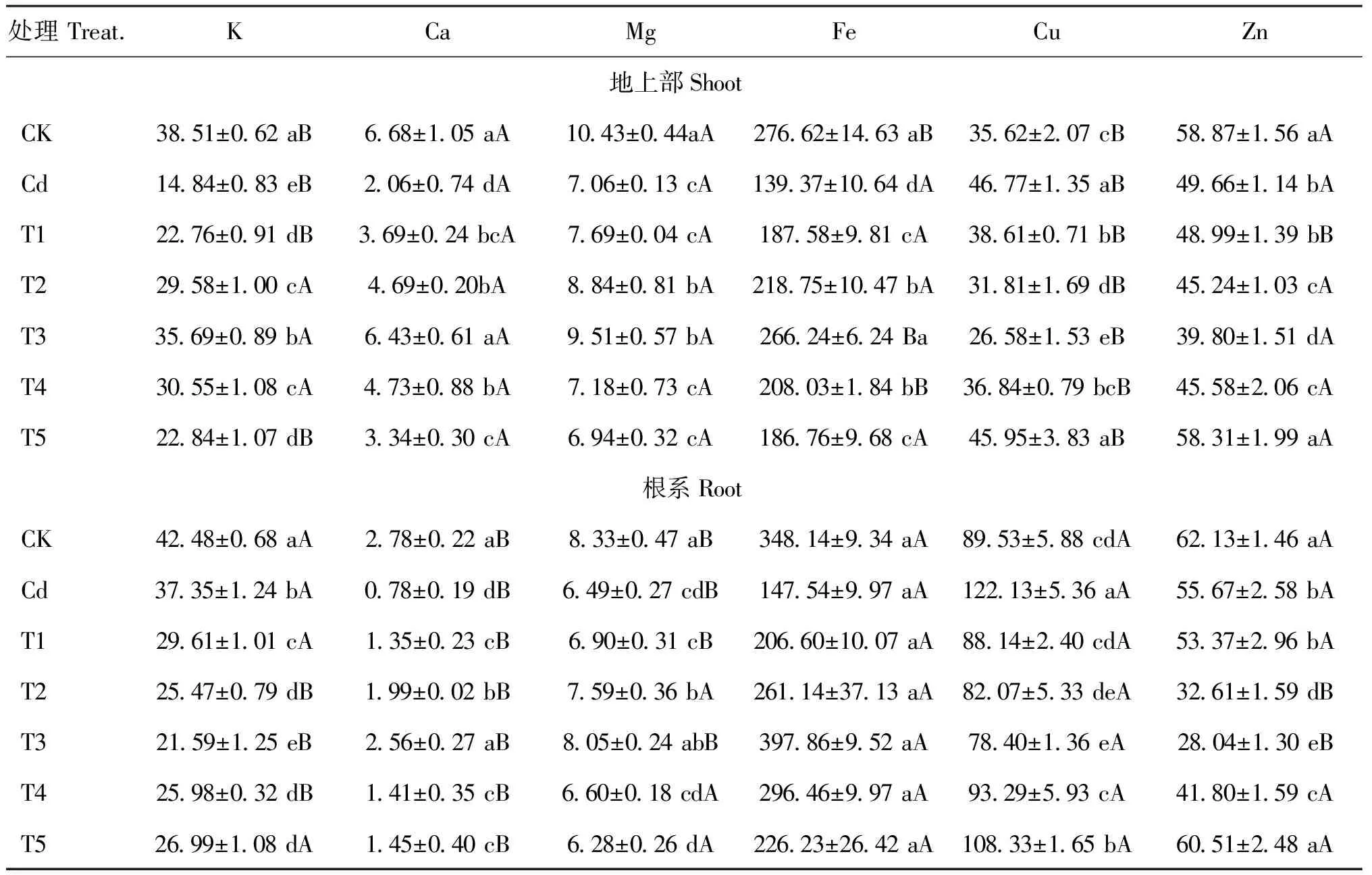
表3 镉胁迫下不同浓度SNP对长春花矿质营养的影响(g/kg)Table 3 Effects of different concentrations of SNP on mineral nutrition in shoots and roots of C. roseus under Cd stress
注(Note): 同列数据后不同小、 大写字母分别表示处理间差异达5%和1%显著水平 Values followed by different small and capital letters in same column mean significant at the 5% and 1% levels, respectively.
2.5 镉胁迫下外源一氧化氮(NO)对长春花丙二醛和活性氧的影响
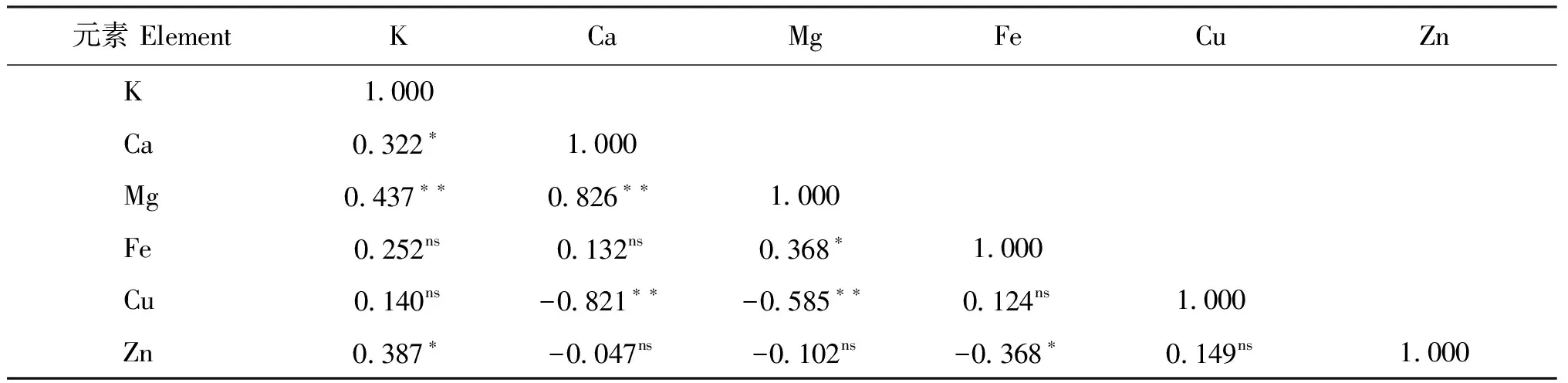
表4 矿质营养元素钾、 钙、 镁、 铁、 铜、 锌之间的相关性(n=42)Table 4 Pearson correlations between mineral nutrient elements K, Ca, Mg, Fe, Cu and Zn in shoots and roots of C. roseus (n=42)
注(Note): 表中结果根据地上部和地下部在7个处理水平的数据计算Results in the table are calculated based on data of seven treatments in shoots and roots. *—P<0.05 (双侧bilateral); **—P<0.01 (双侧bilateral); ns—P> 0.05.
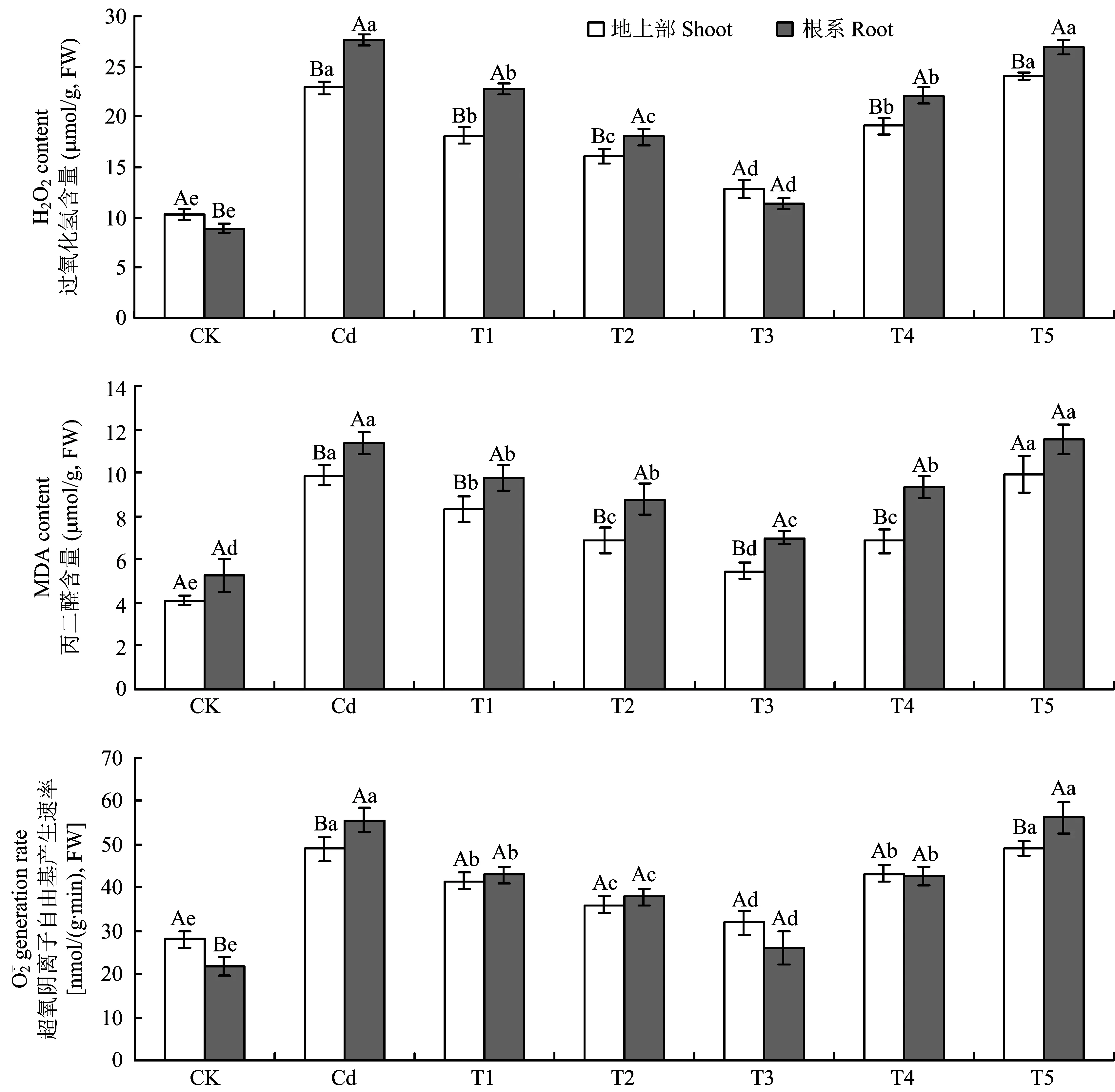
图4 镉胁迫下不同浓度SNP处理对长春花丙二醛和活性氧的影响Fig.4 Effects of different concentrations of SNP supply on malondialdehyde content and reactive oxygen species generation of C. roseus under Cd stress [注(Note): 柱上不同小写字母表示相同部位在不同处理间差异达5%显著水平 Different small letters above the bars indicate significant among different treatments for the same tissue at the 5% level; 不同大写字母表示相同处理下地上部和根系间差异达5%显著水平Different capital letters indicate significant in shoots and roots under the same treatments at the 5% level.]
2.6 镉胁迫下外源一氧化氮(NO)对长春花质膜过氧化的影响

2.7 镉胁迫下外源一氧化氮(NO)对长春花ATP酶活性的影响

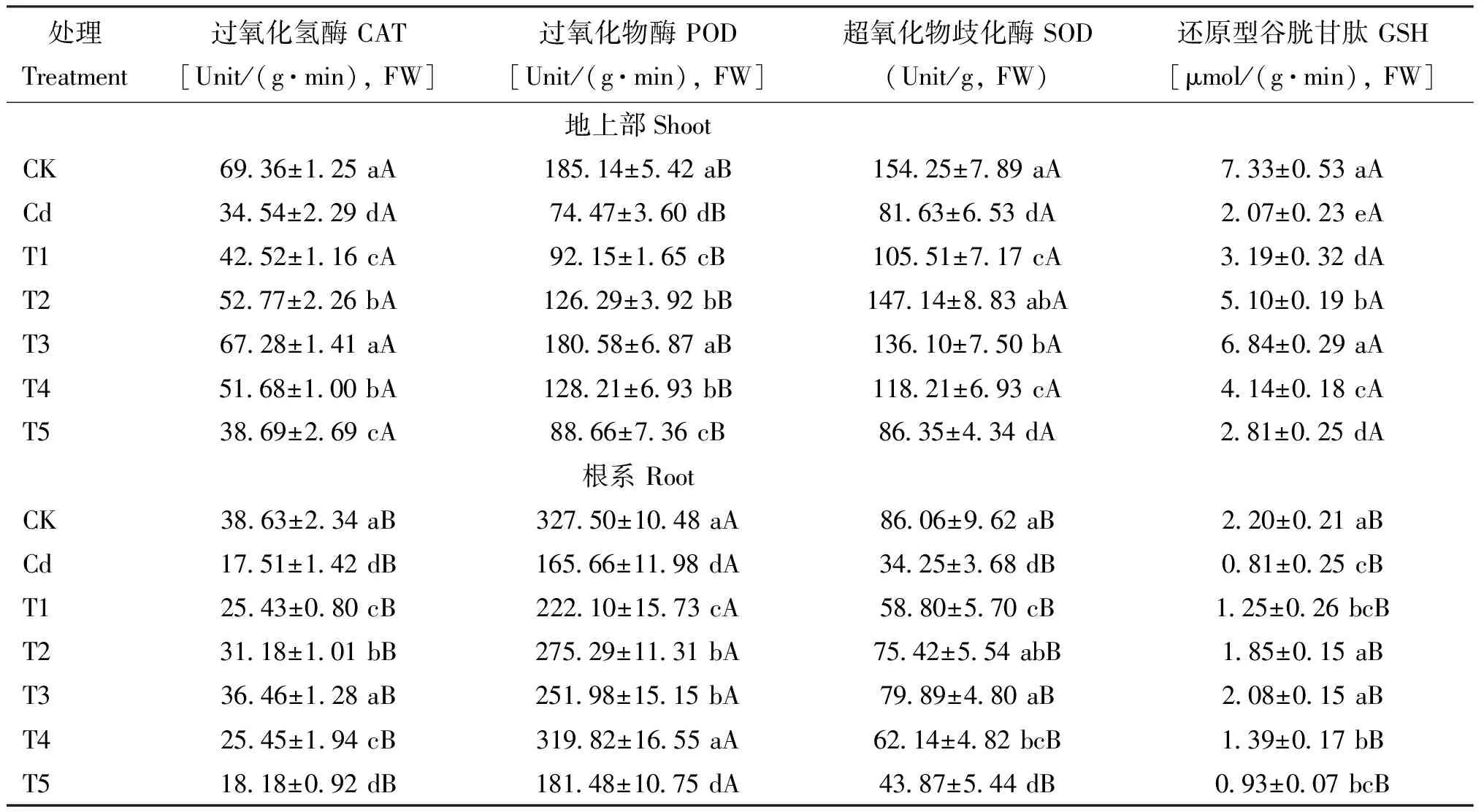
表5 镉胁迫下不同浓度SNP对长春花抗氧化酶(CAT、 POD、 SOD)活性和抗氧化物(GSH)含量的影响Table 5 Effects of different concentrations of SNP on the activities of antioxidant enzymes (CAT, POD, SOD) and antioxidants (GSH) content of C. roseus under Cd stress
注(Note): CAT—Catalase;POD—Peroxidase ; SOD—Superoxide dismutase;GSH—Glutathione. 同列数据后不同字母表示处理间差异达5%显著水平 Values followed by different letters in a column are significant among treatments at the 5% level.

表6 长春花地上部和地下部活性氧 丙二醛(MDA)以及抗氧化物之间的相关性(n=42)Table 6 Pearson correlations between malondialdehyde (MDA), reactive oxygen and antioxidant substance in shoots and roots of C. roseus (n=42)
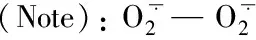
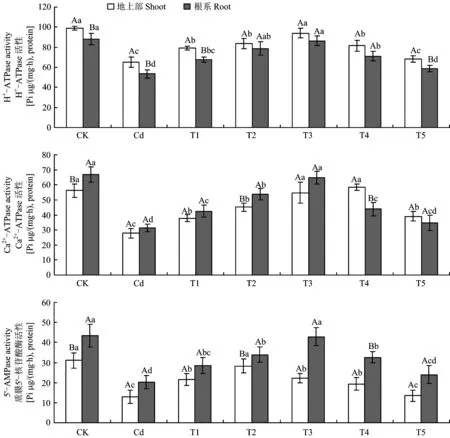
图5 镉胁迫下不同浓度SNP处理对长春花质膜 ATP酶和 5′-AMP酶活性的影响Fig.5 Effects of different concentrations of SNP supply on plasma membrane ATPase and 5′-AMPase activities of C. roseus under Cd stress [注(Note): 柱上不同小写字母表示相同部位在不同处理间差异达5%显著水平 Different small letters above the bars indicate significant among different treatments for the same tissue at the 5% level; 不同大写字母表示相同处理下地上部和根系间差异达5%显著水平Different capital letters indicate significant in shoots and roots under the same treatments at the 5% level.]

表7 不同浓度SNP处理浓度与长春花质膜 ATPase 和 5′-AMPase 活性的回归方程和相关性Table 7 Regression equation and correlations between different concentrations of SNP supply and the activities of the plasma membrane ATPase and 5′-AMPase of C. roseus.
注(Note):x—SNP处理浓度SNP treatment concentration;y—质膜酶Plasma membrane enzyme. *—P<0.05;**—P<0.01.
3 讨论
镉(Cd)可与植物生长过程中关键酶或蛋白活性中心的巯基结合,取代金属硫蛋白反应中心的必需金属元素 钙(Ca)、 铁(Fe)、 锌(Zn)、 镁(Mg) 等,释放自由离子[27],诱导内脂氧合酶和还原性辅酶II(NADPH)氧化酶活性升高[19],导致质膜过氧化和生物大分子损伤,抑制植株的生长。研究表明,25 mg/kg Cd2+镉胁迫下植株叶性状(叶数、 叶长、 叶宽), 根长, 株高和基径均受到抑制,长春花生长发育受到影响,与多数植物受镉胁迫现象一致(表1,表2)。然而,外源一氧化氮(NO)可通过质外体直接作用使细胞壁松弛,提高膜的流动性和离子的选择性[28],增强与外界信息交流和次生代谢产物区域化。试验中添加低浓度SNP (T1、 T2、 T3, 即0.45、 0.90、 1.80 mg/kg SNP,下同)可以缓解镉胁迫对幼苗生长的抑制,生物量逐步恢复到对照水平,而高浓度(T4和T5,即3.60和7.20 mg/kg SNP,下同)的SNP 对植株的缓解效应却不显著,这证实了外源NO 对植物的双相剂量-效应现象,与Wang 等[2]的研究结果一致。
一般而言,大多数带正电的重金属离子易与组织中带负电的化合物结合,产生显著的截留作用而使重金属累积在根系,这已为众多的研究所证实[2,16]。本研究结果也表明,长春花根系吸收并截留了绝大多数的 Cd2+(图2、 图3)。这种将Cd2+富集于根系是植物阻止Cd2+毒害的生存策略,减轻了土壤镉通过植物向生态系统迁移的风险。施用低浓度SNP 能显著增加根系镉含量,降低地上部积累,表明NO 参与了镉胁迫下植物对重金属离子的吸收与转移,通过诱导基因表达,从而减轻对地上部的毒害[29]。由于长春花的根系较为发达,在城市土壤修复中可以收获其地下部分并集中处理,通过连续种植使土壤中镉含量降低到可以接受的水平,这也为城市镉污染土壤的植物修复开辟了新思路。但朱涵毅等[30]对镉胁迫下的粳稻品种ZH11施加外源SNP后发现,地上部镉含量略有升高,根部镉含量却降低。不同的结果表明,外源NO对镉在不同植物体内的转移和分配机制的影响不同,其机理有待进一步研究。Cd2+在植物体内可能与矿质营养元素竞争根部的吸收位点,从而影响植物对养分的吸收[8]。Zn2+(0.83Å) 和Cd2+(1.03Å) 化学性质相似,在根系表面具有类似的吸收位点,易发生拮抗作用而进行竞争性吸收[31]。镉胁迫下根系中Cd2+浓度显著增加,占据了大量吸收位点,从而影响 Zn的吸收(图2、 表3)。同时,Cu与Zn是植物生长所必需的微量元素,但吸收积累过多会造成重金属毒害。本研究中,镉胁迫促进幼苗对Cu的吸收,但抑制了对Zn的吸收,而施加SNP可以减少对Cu的吸收而增加对Zn的吸收(表3)。表明镉胁迫下幼苗可通过吸收Cu2+来促进某些抗氧化酶的合成;而NO可参与活性氧的清除,施加SNP会降低对Cu2+的吸收[32]。Cui等[33]认为,植物在缺Zn 土壤中极易吸收Cd, 而添加 Zn 则会显著降低对Cd的吸收。该结论也说明植物对Cd和Zn 的吸收存在负相关关系,本研究的结果也证实了该观点。镉胁迫导致对大量元素 K、 Ca、 Mg吸收量的降低 (表3),可能是Cd2+破坏细胞膜上的离子通道和载体,降低了矿质元素运输速率; 或是Cd2+抑制参与矿质元素运输的相关蛋白或酶的活性[34],其原因有待进一步研究。本研究中,镉胁迫显著降低质膜H+-ATPase和Ca2+-ATPase活性(图5),使跨膜电化学势梯度和细胞酸度失衡,降低细胞壁酸化能力从而影响跨膜运输[8]。 然而,Wdowikowska等[6]研究却发现,镉胁迫造成胞内Ca2+水平上升,由于胞内Ca调素(CaM)含量下降导致质膜Ca2+-ATPase 活性下降,高浓度Ca2+无法有效泵出细胞,于是通过信号传导降低质膜H+-ATPase mRNA转录水平,导致H+-ATPase活性降低。添加低浓度的SNP 能够增强 K、 Ca和Mg的吸收,NO通过提高质膜ATPase和5′-AMPase活性水解产生大量质子并泵出细胞质,提高溶质的次级跨膜转运速率[7,33]。同时,当植物受到镉胁迫时经常伴随失绿症的出现,而失绿症很可能是由缺Fe引起的。Wang等[2]指出,过量的镉胁迫显著抑制黑麦草对Fe 的吸收,Cd 与 Fe存在拮抗作用。 Graziano等[35]研究发现,外源 NO 对植物叶片中 Fe 向叶绿体分配具有重要作用。本研究表明,外源 SNP 能够增加地上部和根系中 Fe 含量,但长春花是否在增加外源 NO时通过提高叶绿素含量以增加对 Fe 的吸收,还有待进一步研究。
4 结论
本研究表明,25 mg/kg Cd2+镉胁迫抑制长春花生长,诱导质膜过氧化,干扰活性氧代谢,增加质膜透性,影响矿质营养元素的吸收和积累。低浓度外源 NO 能够有效缓解镉胁迫对长春花产生的毒害作用,其可能机理为: 1)通过提高镉胁迫下抗氧化酶(CAT、 SOD、 POD)活性与抗氧化物质(GSH)含量,增强活性氧的清除能力;2)增加对K、 Ca、 Mg、 Fe 的吸收,降低对微量元素 Cu 和 Zn 的吸收,阻碍 Cd2+在地上部和根系间的转运;3)增强质膜 ATPase 和 5′-AMPase 活性,加强离子跨膜运输和 Ca2+信号转导,缓解了镉胁迫对长春花的毒害作用。尽管这些结果并没有完全揭示外源 NO 对镉胁迫下长春花的缓解作用机理,但为深入研究外源 NO 缓解城市土壤镉污染提供了思路。因此,在现代农业生产和城市镉污染土壤的植物修复技术中适当提高植物 一氧化氮(NO )含量或将是缓解土壤镉污染的可行途径。
参考文献:
[1] Wu F Z, Yang W Q, Zhang Jetal. Cadmium accumulation and growth responses of a poplar (Populusdeltoids×Populusnigra) in cadmium contaminated purple soil and alluvial soil[J]. J. Hazard. Mater., 2010, 177: 268-273.
[2] Wang Q H, Liang X, Dong Y Jetal. Effects of exogenous nitric oxide on cadmium toxicity, element contents and antioxidative system in perennial ryegrass[J]. Plant Growth Regul., 2013, 69: 11-20.
[3] Prasad K V S K, Saradhi P P, Sharmila P. Concerted action of antioxidant enzymes and curtailed growth under zinc toxicity in Brassica juncea[J]. Environ. Exp. Bot., 1999, 42: 1-10.
[4] Janicka-Russak M, Kabala K, Burzyński M. Different effect of cadmium and copper on H+-ATPase activity in plasma membrane vesicles fromCucumissativusroots[J]. J. Exp. Bot., 2012, 63, 4133-4142.
[5] Nocito F F, Lancilli C, Dendena Betal. Cadmium retention in rice roots is influenced by cadmium availability, chelation and translocation[J]. Plant Cell Environ., 2011, 34: 994-1008.
[6] Wdowikowska A, Klobus G. Plant P-type ATPases[J]. Postepy Biochem., 2011, 57: 85-91.
[7] Sgherri C L M, Maffei M, Navari-Izzo F. Antioxidative enzymes in wheat subjected to increasing water deficit and rewatering[J]. J. Plant Physiol., 2000, 157: 273-279.
[8] Hsu Y T, Kao C H. Toxicity in leaves of rice exposed to cadmium is due to hydrogen peroxide accumulation[J]. Plant Soil, 2007, 298: 231-241.
[9] 刘柿良, 石新生, 潘远智, 等. 镉胁迫对长春花生长, 生物量及养分积累与分配的影响[J]. 草业学报, 2013, 22(3): 112-120.
Liu S L, Shi X S, Pan Y Zetal. Effects of cadmium stress on growth, accumulation and distribution of biomass and nutrient inCatharanthusroseus[J]. Acta Pratac. Sin., 2013(3), 22: 112-120.
[10] 刘柿良, 杨容孑, 潘远智, 等. 镉胁迫对长春花质膜过氧化、 ATP酶及5'-核苷酸酶活性的影响[J]. 农业环境科学学报, 2013, 32(5): 916-914.
Liu S L, Yang R J, Pan Y Zetal. Effects of cadmium on lipid peroxidation, ATPase and 5′-AMPase activity of plasma membrane inCatharanthusroseustissues[J]. J. Agro-Environ. Sci., 2013, 32(5): 916-914.
[11] 赵杨迪, 潘远智, 刘碧英. 玉竹对土壤Cd Pb的吸收和耐性研究[J]. 农业环境科学学报, 2012, 29(11): 2087-2093.
Zhao Y D, Pan Y Z, Liu B Y. Absorption and tolerance ofPolygonatumodoratumto Cd and Pb in soil[J]. J. Agro-Environ. Sci., 2012, 29(11): 2087-2093.
[12] Mujib A, Ilah A, Aslam Jetal.Catharanthusroseusalkaloids: application of biotechnology for improving yield[J]. Plant Growth Regul., 2012, 68: 111-127.
[13] Olivia G, Audrey O, Gégory Getal. A type-B response regulator drives the expression of thehydroxymethylbutenyldiphosphate synthase gene in periwinkle[J]. J. Plant Physiol., 2012, 169: 1571-1574.
[14] Xu J, Wang W Y, Yin H Xetal. Exogenous nitric oxide improves antioxidative capacity and reduces auxin degradation in roots ofMedicagotruncatulaseedlings under cadmium stress[J]. Plant Soil, 2010, 326: 321-330.
[15] 刘柿良, 杨容孑, 潘远智, 等. 外源NO对镉胁迫下长春花质膜过氧化、 ATP酶及广和特性的影响[J]. 农业环境科学学报, 2013, 32(12): 2360-2368.
Liu S L, Yang R J, Pan Y Zetal. Effects of exogenous nitric oxide on lipid peroxidation and ATPase activity in plasma membrane and photosynthetic characteristics ofCatharanthusroseusunder cadmium stress[J]. J. Agro-Environ. Sci., 2013, 32(12): 2360-2368.
[16] 刘柿良, 马明东, 潘远智, 等. 不同光强对两种桤木幼苗光合特性和抗氧化系统的影响[J]. 植物生态学报, 2012, 36(10): 1062-1074.
Liu S L, Ma M D, Pan Y Zetal. Effects of light regimes on photosynthetic characteristics and antioxidant system in seedlings of two alder species[J]. J. Plant Ecol., 2012, 36(10): 1062-1074.
[17] Patterson B D, MacRae E A, Ferguson I B. Estimation of hydrogen peroxide in plant extracts using titanium (IV)[J]. Anal. Biochem., 1984, 139: 487-492.
[18] Elstner E F, Heupel A. Inhibition of nitrite formation from hydroxyl ammonium-chloride: a simple assay for superoxide dismutase[J]. Anal. Biochem., 1976, 70: 616-620.
[19] Cakmak I, Marschner H. Magnesium deficiency and high light intensity enhance activities of superoxide dismutase, ascorbate peroxidase, and glutathione reductase in bean leaves[J]. Plant Physiol., 1992, 98: 1222-1227.
[20] Jablonski P P, Anderson J W. Light-dependent reduction of dehydroascorbate by ruptured pea chloroplasts[J]. Plant Physiol., 1981, 67: 1239-1244.
[21] Giannopolitis C N, Ries S K. Superoxide dismutases: I. Occurrence in higher plants[J]. Plant Physiol., 1977, 59: 309-314.
[22] Nickel R S, Cunningham B A. Improved peroxidase assay method using leuco 2, 3, 6-trichlcroindophenol and application to comparative measurements of peroxidase catalysis[J]. Anal. Biochem., 1969, 27: 292-299.
[23] Nagalakshmi N, Prasad M N V. Responses of glutathione cycle enzymes and glutathione metabolism to copper stress inScenedesmusbijugatus[J]. Plant Sci., 2001, 160: 291-299.
[24] Wang Y, Sze H. Similarities and differences between the tonoplast-type and the mitochondrial H+-ATPase of oat roots[J]. J. Biol. Chem., 1985, 260: 10434-10443.
[25] 缪颖, 曹家树, 将有条, 等. 大白菜干烧心病发生过程中Ca2+-ATPase 活性的变化[J]. 园艺学报, 1998, 25(1): 51-55.
Miao Y, Cao J S, Jiang Y Tetal. Changes of Ca2+-ATPase activity in Inner leaves during the development of tipburn in Chinese cabbage[J]. Acta Horticult. Sin., 1998, 25(1): 51-55.
[26] 潘杰, 孙龙华, 简令成. 不同抗冷水稻质5′-核苷酸酶活性的生化及细胞化学研究[J]. 科学通报, 1992, 77(7): 653-656.
Pan J, Sun L H, Jian L C. Research on different cold rice plasma membrane 5'-nucleotidase activity of biochemical and cell chemical[J]. Chin. Sci. Bul., 1992, 77(7): 653-656.
[27] Dinakar N, Nagajyothi P C, Suresh Setal. Cadimum induced changes on proline, antioxidant enzymes, nitrate and nitrite reductases inArachishypogaeaL.[J]. J. Environ. Biol., 2009, 30: 289-294.
[28] Leshem Y Y, Hamaraty E. Plant aging: The emission of NO and ethylene and effect of NO-releasing compoundson growth of pea(Pisumsativum)foliage[J]. Plant Physiol., 1996, 148: 258-263.
[29] Besson-Bard A, Gravot A, Richaud Petal. Nitric oxide contributes to cadmium toxicity inArabidopsisby promoting cadmium accumulation in roots and by up-regulating genes related to iron uptake[J]. Plant Physiol., 2009, 149: 1302-1315.
[30] 朱涵毅, 陈益军, 劳佳丽, 等. 外源 NO 对镉胁迫下水稻幼苗抗氧化系统和微量元素积累的影响[J]. 生态学报, 2013, 33(2): 603-609.
Zhu H Y, Chen Y J, Lao J Letal. The effect of exogenous nitric oxide on activities of antioxidant enzymes and microelements accumulation of two rice genotypes seedlings under cadmium stress[J]. Acta Ecol. Sin., 2013, 33(2): 603-609.
[31] Hassan S A, Hayat S, Ali B A. 28-homobrassinolide protection garbanzo beans (Cicerarietinum) from cadmium toxic by stimulating antioxidants[J]. Environ. Poll., 2008, 151: 60-66.
[32] Lamattina L, Garcia-Mata C, Graziano Metal. Nitric oxide: the versatility of an extensive signal molecule[J]. Annu. Rev. Plant Biol., 2003, 54: 109-136.
[33] Cui X M, Zhang Y K, Wu X Betal. The investigation of the alleviated effect of copper toxicity by exogenous nitric oxide in tomato plants[J]. Plant Soil Environ., 2010, 56: 274-281.
[34] Arasimowicz-Jelonek M, Floryszak-Wieczorek J, Deckert Jetal. Nitric oxide implication in cadmium-induced programmed cell death in roots and signaling response of yellow lupine plants[J]. Plant Physiol. Biochem., 2012, 58: 124-134.
[35] Graziano M, Beligni M V, Lamattina L. Nitric oxide improves internal iron availability in plants[J]. Plant Physiol., 2002, 130: 1852-1859.
[36] Shi G R, Cai Q S, Liu C Fetal. Silicon alleviates cadmium toxicity in peanut plants in relation to cadmium distribution and stimulation of antioxidative enzymes[J]. Plant Growth Regul., 2010, 61: 45-52.
[37] Mishra S, Srivastava S, Tripathi R Detal. Phytochelatin synthesis and response of antioxidants during cadmium stress inBacopamonnieriL.[J]. Plant Physiol. Biochem., 2006, 44: 25-37.
