大孔吸附树脂制备尾叶香茶菜总二萜的工艺研究
2014-04-01马瑞丽徐秀泉王云丽陈海生
马瑞丽, 李 敏, 徐秀泉, 王云丽, 汤 建*, 陈海生
(1.江苏大学药学院, 江苏 镇江 212013; 2.上海第二军医大学药学院, 上海 200433)
尾叶香茶菜Rabdosiaexcisa(Maxim.)Hara,又名龟叶草、狗日草、野苏子,为唇形科香茶菜属植物,多产于我国东北及朝鲜的山区。性凉味甘,民间用于治疗胃炎,膀胱胀痛,癌症,感冒发热等[1-2]。尾叶香茶菜二萜类成分具有良好的抗癌、抑制酪氨酸酶、抗氧化等活性[3-5],其中主要成分尾叶香茶菜丙素(kamebakaurin, KA) 因其显著的抗炎免疫、神经保护和抗肿瘤活性而备受关注[6-8]。但目前尾叶香茶菜丙素及结构类似物主要通过植物提取方法制得,且药材中二萜类化合物种类多而含有量不高[4, 9],因此,选取一条高效制备总二萜的工艺对于尾叶香茶菜丙素等二萜化合物的结构改造、活性筛选以及作用机制等深入研究至关重要。
大孔吸附树脂是上世纪60年代发展起来的分离技术,因其理化性质稳定,分离纯化有效成分性能优异,在中药生产过程中使用广泛[10-11]。目前已有利用AB-8、D101等大孔吸附树脂富集、纯化二萜类成分的报道[5, 12],但在前期研究中发现,以尾叶香茶菜地上部分为原料制备总二萜,提取物中杂质较多,含有大量的色素,影响到总二萜的活性评价和化合物的分离纯化。本实验考察不同大孔树脂、不同吸附、解析条件等工艺参数,优化制备尾叶香茶菜总二萜的流程,以期建立规模化制备尾叶香茶菜总二萜的生产工艺。
1 仪器与材料
R-21旋转蒸发仪(BUCHI),LC-20A高效液相色谱仪(SHIMADZU);ZF-300超声波清洗机;Sartorius电子天平;PCS型紫外-可见分光光度计;液相用色谱纯甲醇,双纯水;树脂柱洗脱用去离子水和90%乙醇。HPD400和HPD826(沧州宝恩),AB-8和D101树脂(天津南开),HP 20(日本三菱),XAD16N和XAD7HP (上海陶氏化学)。
药材采自吉林长白山区,经本院欧阳臻教授鉴定为尾叶香茶菜Rabdosiaexcisa(Maxim.)Hara。尾叶香茶菜丙素(KA)对照品由本室自制,经面积归一化法检测纯度98.6%,满足实验要求。
2 方法与结果
2.1 分析方法
2.1.1 HPLC测定尾叶香茶菜丙素 精密称取干燥的尾叶香茶菜丙素10.02 mg置于50 mL量瓶,用95%乙醇溶解并定容,制成质量浓度为0.2 mg/mL的对照品溶液。将原液依次稀释成100、50、25、12.5、6.25、3.125 μg/mL的梯度浓度溶液,分别取上述对照品溶液20 μL进行测定。以对照品进样量(X,μg)为横坐标,峰面积(Y)为纵坐标,绘制标准曲线,得回归方程Y=14 079X+4 938.3,r2=0.999 9,在3.125~100.0 μg/mL间呈良好线性关系[13]。
Inertsil ODS-SP柱(4.6 mm×250 mm,5 μm);柱温25 ℃;流动相为甲醇-水(等度洗脱,50∶50);体积流量0.8 mL/min;检测波长235 nm。对照品及样品依上述条件检测,HPLC图如图1。

图1 尾叶香茶菜丙素(KA)对照品(A)(0.05 mg/mL)和样品(B)(1.0 mg/mL)HPLC图
2.1.2 UV法测定总二萜的量 分别精密吸取对照品溶液(0.5 mg/mL) 0.1、0.2、0.3、0.4、0.5、0.6 mL至量瓶中,定容至10 mL,在最大吸收波长235 nm处测吸光度,绘制标准曲线,得回归方程Y=44.039X-0.698 7,r=0.999 7,在5.0~30.0 μg/mL范围内线性关系良好。
2.2 药材吸附液的制备 尾叶香茶菜75%甲醇提取物浸膏,先用少量乙醇溶解,再加热水,配置所需浓度的吸附溶液。
2.3 树脂的筛选
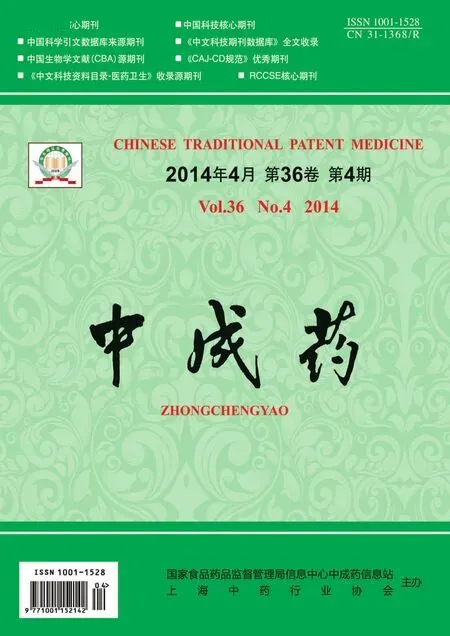
2.3.1 静态吸附试验 精密称取预处理过的大孔树脂1.0 g,分别加入20 mL吸附液,摇床振摇24 h,使充分吸附。紫外和HPLC两种检测方法,计算各种树脂吸附量。7种树脂的吸附量如表1。
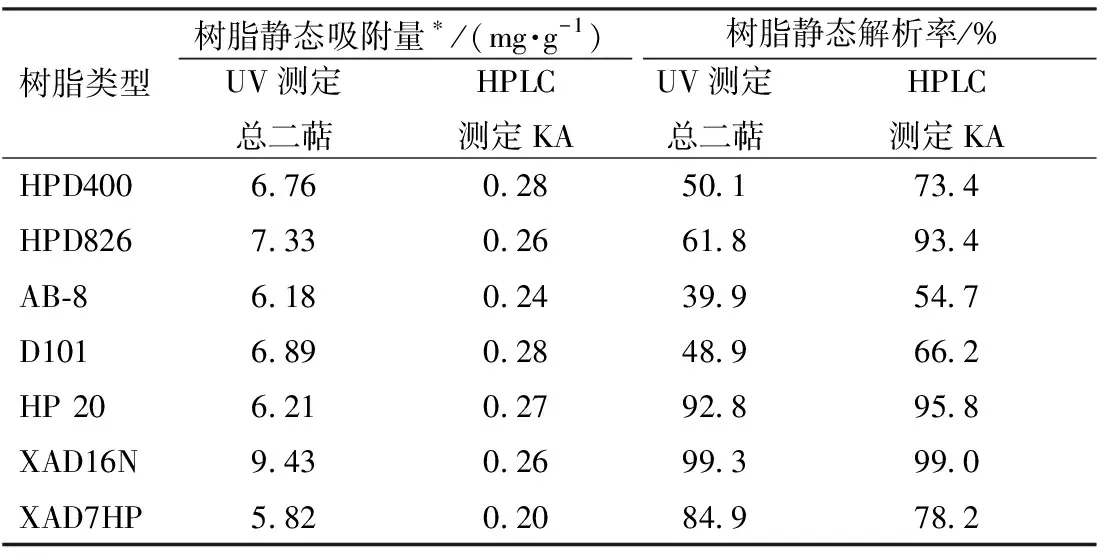
表1 不同树脂对总二萜和尾叶香茶菜丙素的静态吸附量及解析率(n=3)
2.3.2 静态解析试验 D101、HP20和XAD16N 3种树脂各3份(1.0 g)至于锥形瓶中,加入20 mL 1.0 mg/mL提取液使其振荡24 h,充分吸收后将液体抽滤,向其中各加入20 mL 70%、80%、90%、95% 乙醇,振摇24 h,使其充分解析。发现3种树脂都是95%乙醇解析率最高。故选用95%的乙醇考察7种树脂的静态解析率。上述7种树脂充分吸收样品后将液体抽滤,树脂分别加入20 mL 95%乙醇,振摇24 h,使其充分解吸。7种树脂的解析率见表1。
根据表1可知,XAD16N、HP20和HPD826树脂具有较高的吸附率,但HPD826树脂对总二萜的解析率较低,对尾叶香茶菜丙素的解析率也低于XAD16N和HP20树脂。综合考虑,选用XAD16N和HP20树脂进行动态吸附剂解析试验。
2.3.3 动态吸附及解析试验 XAD16N和HP20树脂各取25 g(约50 mL),置于玻璃柱中(Φ 20 mm)。取50 mL质量浓度为10 mg/mL吸附液 (为提高其浓度,加热至60 ℃) 加于柱顶,流出液再上柱重新吸附,静置12 h后用水洗脱3 BV,再改用95%乙醇洗至无二萜类化合物流出。XAD16N树脂和HP 20树脂对总二萜和尾叶香茶菜丙素的动态吸附量和解析率见表2。考虑技术及经济因素,选用XAD16N树脂经行尾叶香茶菜总二萜制备的工艺研究。

表2 两种树脂对总二萜和尾叶香茶菜丙素的动态吸附量及解析率(n=3)
2.4 XAD16N树脂纯化总二萜的工艺优化
2.4.1 吸附液质量浓度的考察 将质量浓度为25 mg/mL(70 ℃)的提取液分别在60 ℃下稀释至10、5、2.5、1.25 mg/mL。5种质量浓度的吸附液以2 BV/h的体积流量进行动态吸附,用5 BV水以同样体积流量洗脱,再以95%乙醇以2 BV/h的体积流量洗脱,收集洗脱液,测定吸光度,实验重复3次,计算吸附率(图2)。

图2 吸附液质量浓度对动态吸附率的影响
从图2可以看出,若质量浓度较低,目标成分吸附较慢,部分化合物随液体流出;若吸附质量液浓度太大总二萜吸附率也不高,可能是因为质量浓度偏高而化合物传输受阻,且局部过载,部分化合物随洗脱液流出。因此,吸附液质量浓度选择10 mg/mL。
2.4.2 动态吸附泄漏曲线 XAD16N树脂25 g(约50 mL),置于玻璃柱中(Φ 20 mm)。取100 mL质量浓度为10 mg/mL(60 ℃)吸附液加于柱顶,以2 BV/h的体积流量进行动态吸附,流出液每10 mL收集一次,测其紫外吸光度和尾叶香茶菜丙素量,以收集液体积为横坐标,流出液中未吸附化合物比率为纵坐标绘制泄漏曲线(图3)。XAD16N树脂的总二萜和尾叶香茶菜丙素泄漏曲线趋势相似,尾叶香茶菜丙素在50 mL以前吸附率略高于总二萜类化合物,50 mL后吸附率略低于总二萜类成分,且70 mL后基本不再吸附,而总二萜类组分是80 mL后达到吸附饱和状态。
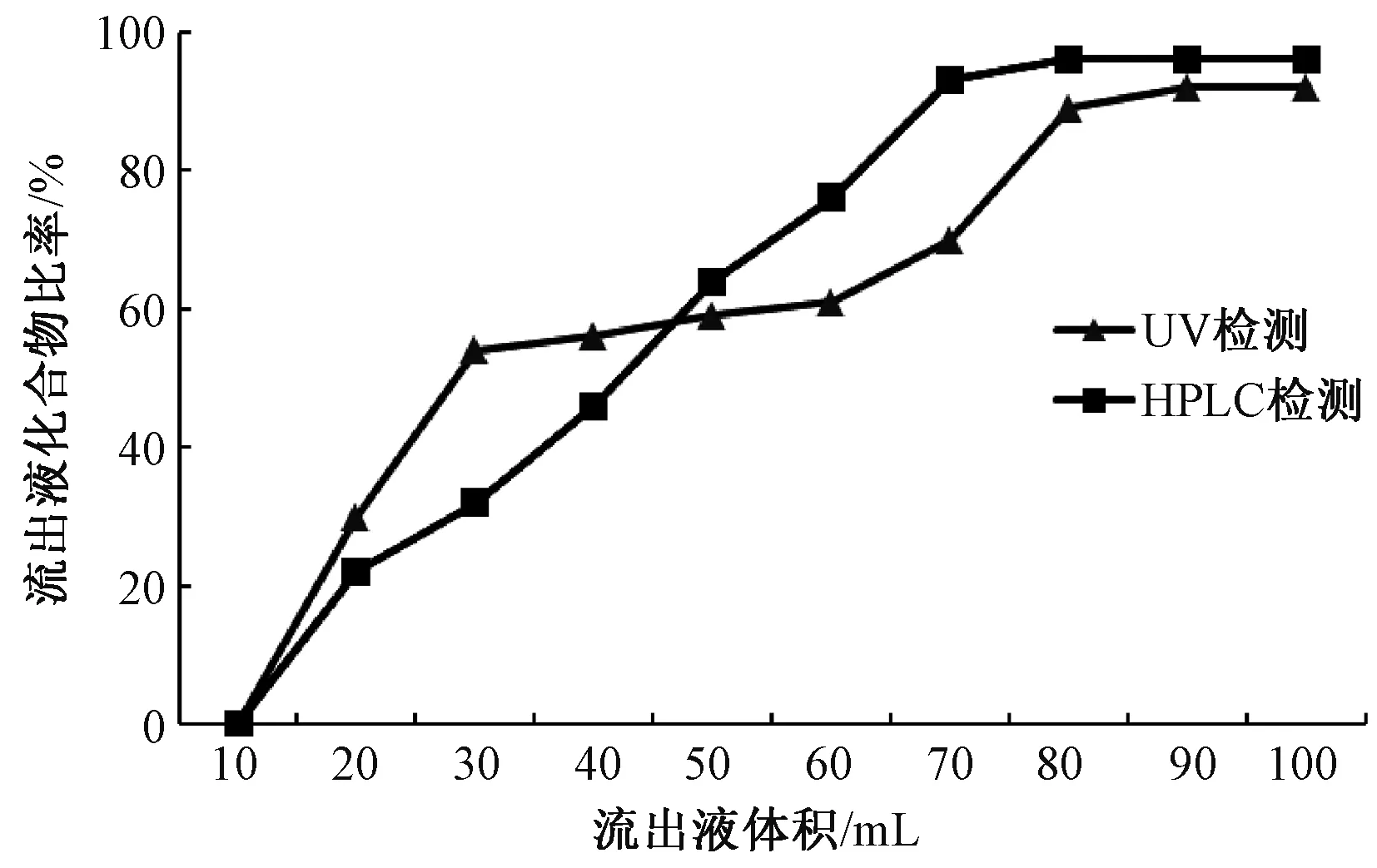
图3 XAD16N树脂的泄漏曲线
2.4.3 吸附体积流量的考察 3份XAD16N树脂25 g(约50 mL),分别置于玻璃柱中(Φ 20 mm)。以不同的体积流量加入10 mg/mL吸附液(60 ℃)50 mL:1、2、4 BV/h。其总二萜吸附量分别是 7.9、7.6和6.6 mg/g,KA吸附量分别是2.2、2.2和2.0 mg/g。综合考虑吸附率和时间成本,选用2 BV/h流量。
2.4.4 洗脱用水pH的考察[14]吸附液上样到XAD16N树脂,其完全吸附后分别用pH为7、8、9、10的NaOH水溶液及pH为9的10%的乙醇进行洗脱,除去色素。洗至无色后用95%乙醇洗下目标组分,浓缩后配置成原来体积,在250 nm测其A值,实验重复3次。根据公式:脱色率(%)=(A前-A后)/A前计算脱色率,A前为脱色前溶液在最大吸收波长330 nm处的A值,A后为脱色后溶液在最大吸收波长250 nm处A值。pH对脱色率的影响见图4。虽然pH为9的15%乙醇脱色率高于pH 9的水溶液,但易洗脱出二萜化合物,故选择pH 9的碱水脱色。
图4 洗脱剂pH对解析率的影响
2.4.5 洗脱剂体积流量考察 取“2.4.3”项中的3份样品,先以pH 9的NaOH水溶液洗至洗脱液颜色不再变浅,再用2 BV 95%乙醇分别在2、4、6 BV/h流量下洗脱。解析度分别为98% (KA: 99%)、95% (KA: 96%)和86%(KA: 88%)。综合考虑洗脱时间、试剂和解析率,选用4 BV/h体积流量考察动态解析曲线。
2.4.6 动态解析曲线考察 最优动态吸附条件上柱,充分吸收后用pH 9的NaOH水溶液洗至洗脱液颜色不再变浅,再用95%乙醇分别在4 BV/h流量下洗脱。每10 mL收集一次洗脱液,测定吸光度,绘制树脂的动态解吸曲线。见图5。洗脱液用量为4 BV时,能够基本解析全部总二萜类成分。

图5 动态解析曲线
2.5 工艺稳定性验证试验 实验表明XAD16N树脂制备尾叶香茶菜总二萜的最优工艺条件是吸附溶液质量浓度为10 mg/mL(60 ℃),吸附液与树脂的比例2∶1(V/m),吸附流量2 BV/h,脱色时水pH 9,95%乙醇解析体积流量4 BV/h,用量4 BV。采用最优工艺条件进行平行实验3次。
所得结果见表3,XAD16N树脂制备尾叶香茶菜二萜具有良好的稳定性。所得样品经参照“2.1.2”项条件HPLC分析,与图1相比,尾叶香茶菜丙素明显得到富集,见图6。
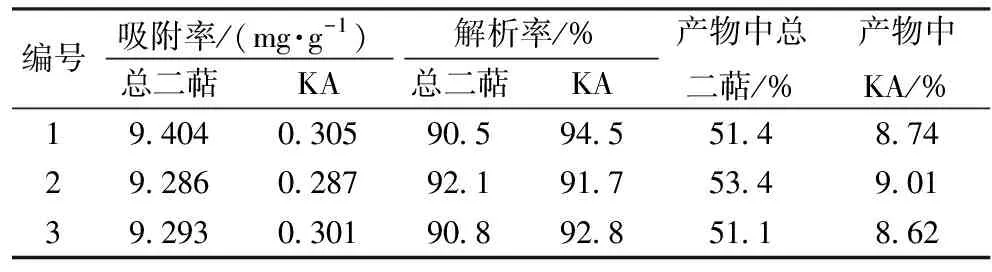
表3 工艺稳定性实验结果
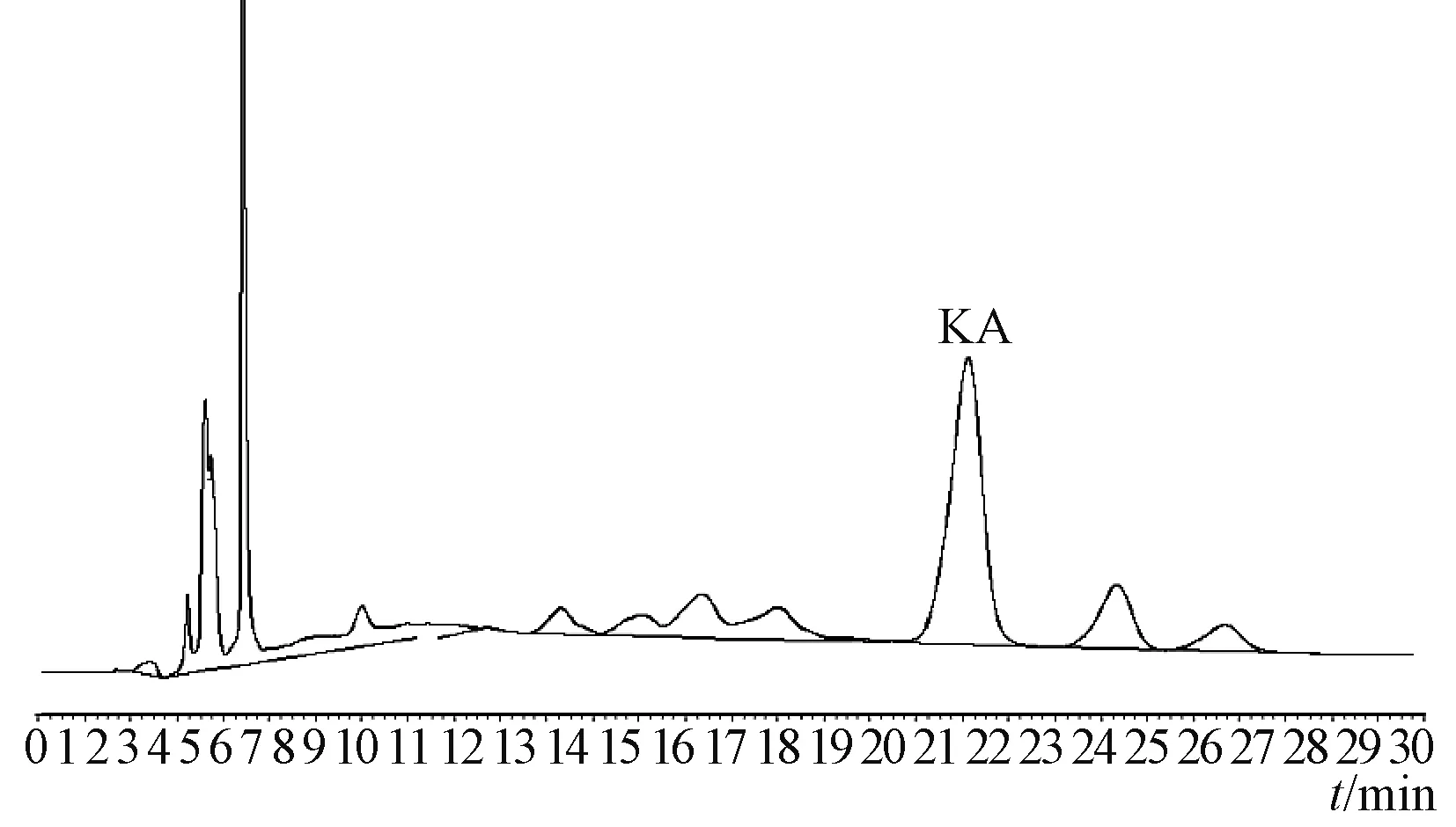
图6 产品中尾叶香茶菜丙素(KA)HPLC图谱
3 讨论
本实验对7种不同大孔吸附树脂纯化尾叶香茶菜总二萜的性能进行了研究,综合考虑技术及经济因素,选择XAD16N树脂用于制备尾叶香茶菜总二萜的工艺研究。针对XAD16N大孔吸附树脂进行了吸附、解析以及脱色工艺条件的优化,在优选条件下,通过XAD16N树脂制得的产品中二萜类成分的量为52%,其中尾叶香茶菜丙素(KA)的量为8.8%,约为药材中的100倍。该工艺简单稳定,纯化效果好,成本较低,具有规模化应用价值,为后续制备较高纯度尾叶香茶菜总二萜和精制尾叶香茶菜丙素打下了重要基础。
参考文献:
[1] 中国科学院中国植物志编委会. 中国植物志[M]. 北京: 科学出版社, 1977, 65: 490.
[2] 严仲铠, 李万林. 中国长白山药用植物彩色图志[M]. 北京: 人民卫生出版社, 1996, 551.
[3] 朴 艳. 长白山区尾叶香茶菜活性成分的化学研究[D]. 延吉: 延边大学, 2011.
[4] 吴月霞. 尾叶香茶菜花和果实化学成分的研究[D]. 郑州: 郑州大学, 2012.
[5] 桂明玉, 金永日, 李绪文. 一种新的天然药物有效部位-尾叶香茶菜总二萜: 中国, 03145532.8[P]. 2007-10-31.
[6] Lee J H, Choi J K, Noh M S,etal. Anti-inflammatory effect of kamebakaurin ininvivoanimal models[J].PlantaMed, 2004, 70(6): 526-530.
[7] Paris D, Patel N, Quadros A,etal. Inhibition of Aβ production by NF-κB inhibitors[J].NeurosciLett, 2007, 415(1): 11-16.
[8] Gui M Y, Aoyagi Y, Jin Y R,etal. Excisanin H, a novel cytotoxic 14, 20-epoxy-ent-kaurene diterpenoid, and three new ent-kaurene diterpenoids fromRabdosiaexcisa[J].JNatProd, 2004, 67(3): 373-376.
[9] 桂明玉, 李绪文, 王宝珍, 等. RP-HPLC法测定不同生长期尾叶香茶菜中二萜类成分的含量[J]. 吉林大学学报:理学版, 2007, 45(1): 125-127.
[10] 雷 雪, 刘富岗, 杨 云. 大孔吸附树脂纯化贯叶连翘提取物的工艺[J]. 中成药, 2012, 34(9): 1696-1699.
[11] 陈随清, 陈磊磊, 魏雅磊, 等. 大孔吸附树脂纯化山橿总黄酮的工艺研究[J]. 中成药, 2013, 35(2): 272-277.
[12] 张崇禧. 尾叶香茶菜中萼西香茶菜甲素的制备新工艺: 中国, 200810100251.1[P]. 2010-06-09.
[13] 汤 建, 陈 微, 刘书芳, 等. 尾叶香茶菜各部位中kamebakaurin含量测定[J]. 时珍国医国药, 2012, 23(5): 1181-1182.
[14] 赵全成, 赫玉芳, 南敏伦, 等. 尾叶香茶菜总二萜的制备新方法:中国, 201010262110.7[P]. 2010-08-25.