PPARγ激动剂通过Akt信号转导通路抑制HIV-1 Tat诱导的血管炎性反应
2014-03-30罗文静黄文莫雪安吴李硕
罗文静 黄文 莫雪安 吴李硕
艾滋病(acquired immune deficiency syndrome, AIDS)是严重威胁人类健康的重要感染性疾病,其引起的神经系统并发症十分常见。人类免疫缺陷病毒-1型反式转录激活因子(HIV-1 transactivator of transcription,HIV-1 Tat)作为AIDS感染过程中的关键蛋白,可导致脑血管内皮细胞通透性增加,炎性介质表达,炎性细胞迁移,紧密连接蛋白降解,血-脑脊液屏障功能失调,从而引起神经系统功能障碍[1-2]。过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor gamma,PPARγ)可下调氧化应激敏感性和炎性反应信号通路[3-4],明显抑制炎性反应而发挥对HIV介导的脑内皮细胞功能障碍的保护作用[1,3]。在所有炎性介质中,细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)、血管细胞黏附分子-1(vascular cell adhesion molecule-1,VCAM-1)在感染的炎性细胞牢固黏附和迁移进入中枢神经系统(central nervous system,CNS)释放HIV病毒起到关键的作用[5]。本研究观察PPARγ激动剂罗格列酮对HIV-1 Tat诱导的黏附分子ICAM-1、VCAM-1及蛋白激酶B(Akt)表达的影响,旨在探讨PPARγ对HIV-1 Tat诱导的脑血管内皮细胞中黏附分子作用及其可能的信号转导机制,为HIV-1引起的神经系统功能损害的防治提供新的思路和科学依据。
1 材料和方法
1.1主要材料及试剂人脑微血管内皮细胞系(human cerebral microvascular endothelial cells,hCMEC/D3)由法国巴黎第五大学P-O Couraud教授惠赠,内皮细胞基础培养基(endothelial cell basal medium-2,EBM-2)购自Lonza公司,鼠胶原蛋白购自Trevigen公司,重组HIV-1 Tat clade-B 购自ProSpec公司,ICAM-1一抗、VCAM-1一抗、Akt1/2/3 (H-136)、辣根过氧化物酶标记的二抗购自Santa Cruz 公司,磷酸化Akt(Ser473;D9E)购自Cell Signaling公司,PPARγ激动剂罗格列酮、PPARγ拮抗剂GW9662购自Alexis Biochemicals公司,Akt信号转导通路抑制剂KP3721购自Echelon Biosciences Incorporated公司,RNA提取试剂盒购自Qiagen公司。
1.2方法
1.2.1主要试剂配制:将HIV-1 Tat完全溶解于EBM-2培养基,配成200 μg/mL储存液,分装后保存于-80℃备用。由于HIV-1 Tat易与血清结合,实验所有干预均在无血清培养基中细胞80%~90%融合后进行。将罗格列酮完全溶解于二甲亚砜(dimethyl sulfoxide,DMSO)溶剂中,配成1 mmol/L储存液,分装后保存于-20℃备用,使用时稀释为10 μmol/L工作浓度。
1.2.2细胞培养:将人脑微血管内皮细胞种植于预先以鼠胶原蛋白涂层的60mm培养皿中,采用EBM-2培养基,添加碱性成纤维细胞生长因子、氢化可的松、抗坏血酸、羟乙基哌嗪乙硫磺酸、青/链双抗以及5%(体积分数)胎牛血清培养于37℃,5%(体积分数)CO2培养箱,根据培养基颜色及细胞生长情况,1~2天换液1次,当细胞融合80%以上即传代。
1.2.3细胞处理 将处于对数生长期80%~90%融合的hCMEC/D3分组。(1)采用蛋白免疫印迹法检测hCMEC/D3黏附分子ICAM-1、VCAM-1蛋白表达(处理12 h)以及Akt蛋白表达(处理1 h),分为如下4组:对照组(加入相同量的溶媒DMSO)、1 μg/mL HIV-1 Tat组、10 μmol/L罗格列酮组、1 μg/mL HIV-1 Tat+10 μmol/L罗格列酮组。(2)以Real-time RT-PCR法检测ICAM-1、VCAM-1的mRNA表达(处理6 h),具体分为如下8组:1~4组处理同上,另4组为10 μmol/L罗格列酮+1 μmol/L GW9662组、1 μg/mL HIV-1 Tat+10 μmol/L罗格列酮+1 μmol/L GW9662组、10 μmol/L罗格列酮+120 nmol/L KP3721组、1 μg/mL HIV-1 Tat+10 μmol/L罗格列酮+120 nmol/L KP3721组。实验时DMSO在培养液中的浓度控制在0.1%(体积分数)以内。罗格列酮、GW9662及KP3721均提前2 h加入培养基预处理细胞后再加入HIV-1 Tat。
1.2.4蛋白免疫印迹:细胞经 1×磷酸盐缓冲液(PBS) 洗涤 3 次,用RIPA裂解液提取细胞总蛋白,4℃ 12 000 r/min离心15 min(离心半径为8 cm),收集上清液,BCA蛋白浓度测定试剂盒测定总蛋白浓度。每道加样30 μg蛋白,10%(质量浓度)SDS-聚丙烯酰胺凝胶电泳分离,转移至PVDF膜,用含5%(质量浓度)脱脂牛奶的三羟甲基氨基甲烷缓冲液(tris buffered saline with tween, TBST)封闭1 h,分别加入ICAM-1一抗(1∶1000)、VCAM-1一抗(1∶1000),β-actin(1∶8000),Akt1/2/3(1∶500),磷酸化Akt(1∶2000),4℃孵育过夜,1×TBST 洗 3 次(5 min/次),加入辣根过氧化物酶标记的二抗(1∶5000)室温孵育1 h,1×TBST 洗 3 次(5 min/次),化学发光试剂盒显影,扫描图像并用Image J 软件 (NIH,USA)分析电泳条带的密度。
1.2.5Real-time RT-PCR:按照RNA提取试剂盒说明书提取细胞总RNA,以提取的总RNA为模板反转录为cDNA。应用ABI Prism 7000序列检测系统(Applied Biosystems)测定mRNA的相对水平。运用TaqMan Universal PCR Master Mix 和商品化探针及引物(Applied Biosystems)进行聚合酶链反应扩增,扩增程序为:以95℃ 10 min作为初始的热变性步骤,然后扩增循环95℃ 15 s,60℃ 60 s,共进行24~33个循环。以相对CT法计算分析mRNA表达。每个样品通过管家基因18S rRNA 作为内参使目标基因标准化。
1.3统计学处理采用SPSS 16.0统计软件进行统计学分析,数据用均数±标准差表示。多组样本均数比较采用单因素方差分析,若方差齐性,采用LSD-t法进行多重比较;若方差不齐则进行Welch检验,采用Tambane’s T2法进行多重比较。以P<0.05为差异有统计学意义。
2 结果
2.1蛋白免疫印迹法检测黏附分子的蛋白表达将对照组标准化为1。HIV-1 Tat组ICAM-1和VCAM-1的蛋白水平较对照组显著增加(P<0.05,P<0.01)。与HIV-1 Tat组相比,PPARγ激动剂罗格列酮可显著地减少HIV-1 Tat 诱导的ICAM-1的表达(P<0.05),然而罗格列酮对HIV-1 Tat 诱导的hCMEC/D3中VCAM-1的表达与HIV-1 Tat组相比差异无统计学意义(P>0.05)。具体结果见图1。
2.2Real-timeRT-PCR法检测黏附分子的mRNA表达将对照组标准化为1。与对照组相比,HIV-1 Tat可显著增加hCMEC/D3中ICAM-1 mRNA和VCAM-1 mRNA水平(均P<0.01);与HIV-1 Tat组相比,PPARγ激动剂罗格列酮可显著地抑制HIV-1 Tat诱导的ICAM-1和VCAM-1的mRNA表达(均P<0.01),而这种抑制作用可以被PPARγ拮抗剂GW9662和Akt信号转导通路抑制剂KP3721(均P<0.01)逆转。具体结果见图2。
2.3蛋白免疫印迹法检测Akt蛋白表达将对照组标准化为1。HIV-1 Tat组hCMEC/D3中p-Akt水平较对照组显著上调(P<0.01),而此效应可被PPARγ激动剂罗格列酮抑制(P<0.01)。具体结果见图3。
3 讨论
HIV-1 Tat是HIV-1转录必不可少的蛋白,研究表明其可显著提高多种炎性介质的表达从而诱导HIV感染的单核细胞浸润进入CNS,增加内皮细胞通透性并诱导内皮细胞氧化应激和炎性反应[1,6-7],是HIV进入脑部的关键因素。ICAM-1、VCAM-1属于免疫球蛋白超家族,参与炎性反应、免疫应答等。在正常情况下细胞表面黏附分子ICAM-1、VCAM-1呈现低表达或不表达,而HIV转基因老鼠或HIV感染患者的血浆或组织中ICAM-1和VCAM-l水平较高[8-9],在某些病理因素刺激下,如HIV-1 Tat作用可引起ICAM-1和VCAM-1的表达升高[5]。本研究结果显示,HIV-1 Tat明显上调hCMEC/D3中黏附分子ICAM-l、VCAM-l的表达,可能在促进HIV感染进程中起到重要的作用。
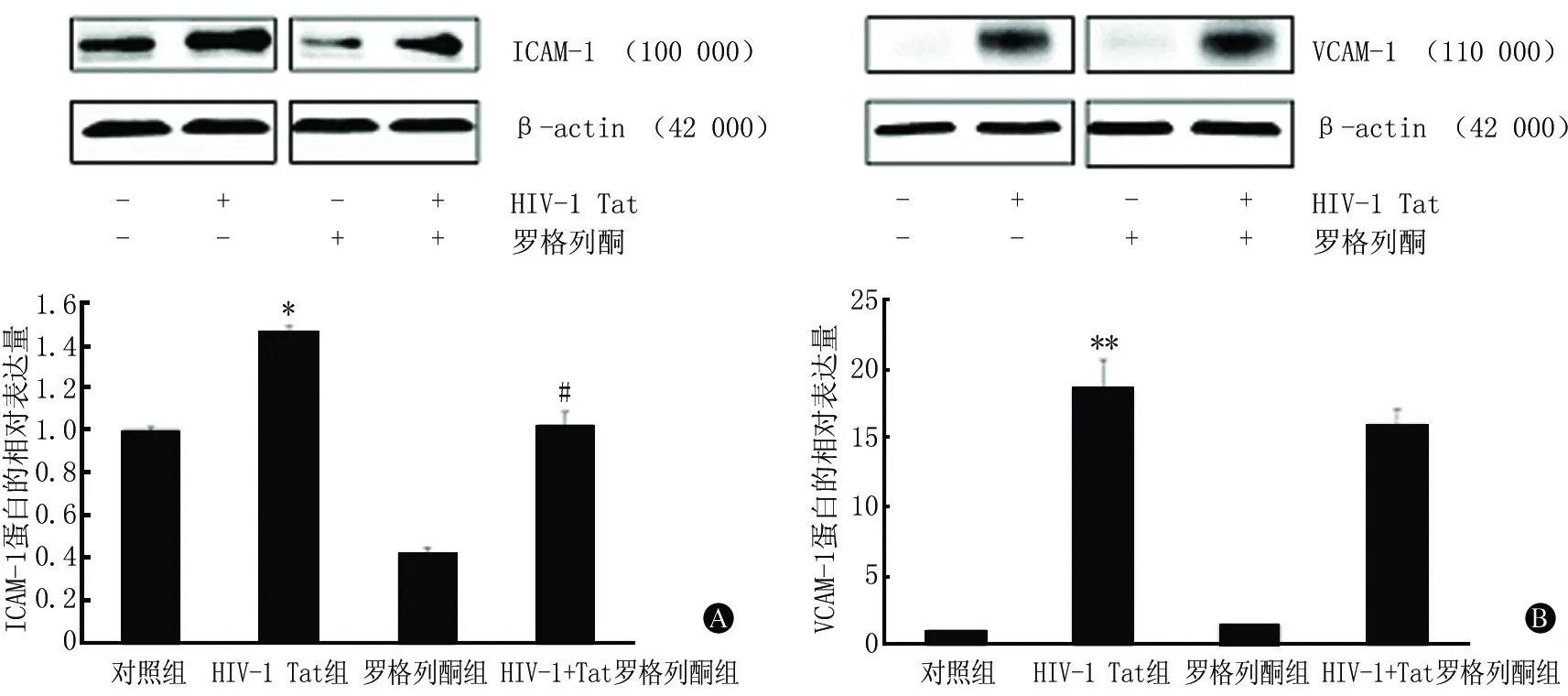
括号内为相对分子质量;与对照组相比,*P<0.05,**P<0.01;与HIV-1 Tat组相比,#P<0.05
图1蛋白免疫印迹法检测PPARγ激动剂罗格列酮对HIV-1 Tat诱导的ICAM-1(A)和VCAM-1(B)蛋白表达的影响(n=3)
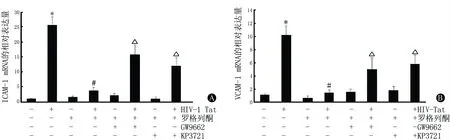
与对照组相比,*P<0.01;与HIV-1 Tat组相比,#P<0.01;与HIV-1 Tat+罗格列酮组相比,△P<0.01
图2Real-time RT-PCR法检测PPARγ激动剂罗格列酮对HIV-1 Tat诱导的ICAM-1 (A)和VCAM-1(B)mRNA表达的影响(n=5)
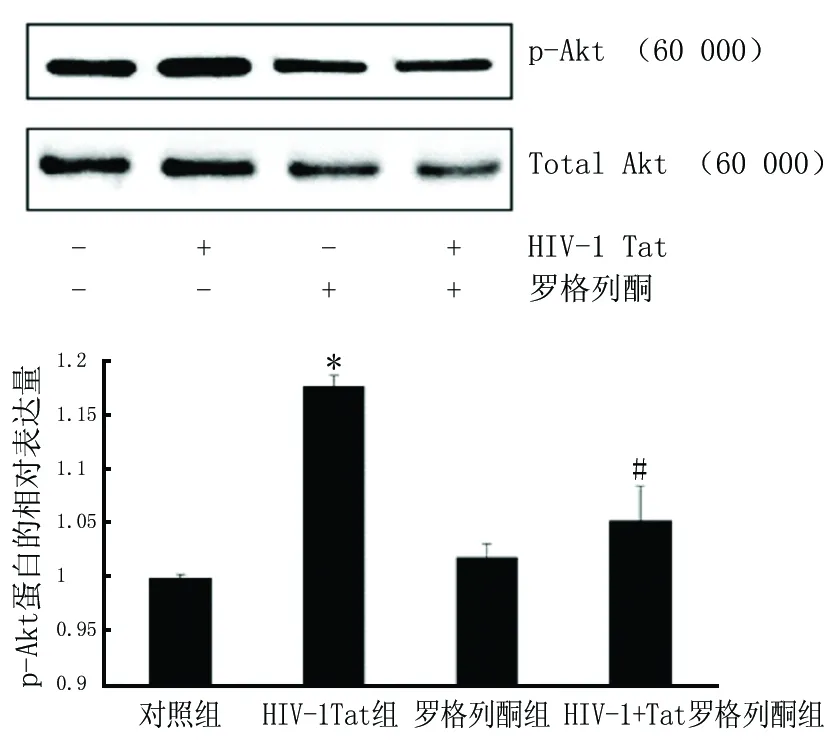
括号内为相对分子质量;与对照组比较,*P<0.01;与HIV-1 Tat组比较,#P<0.01
图3蛋白免疫印迹法检测PPARγ激动剂罗格列酮对HIV-1 Tat诱导的Akt蛋白表达的影响(n=3)
PPAR是一类抗炎核受体,包括PPARα、PPARβ/δ和PPARγ 3种表型。提高PPARγ活性可减弱HIV-1 Tat诱导的炎性介质在脑血管内皮细胞的表达[1]。PPARγ通过ERK和Akt信号转导通路减弱细胞内氧化应激和下调Caveolae相关的氧化还原信号抑制HIV-1诱导的基质金属蛋白酶-9过度表达而发挥血管保护作用[4]。PPARγ还可抑制黏附分子ICAM-l、VCAM-l的表达[10-11]。然而,PPARγ对HIV-1 Tat在人脑血管内皮中介导的黏附分子反应所起的作用仍未明了。因此,本研究着眼于PPARγ对黏附分子ICAM-1和VCAM-1的作用,结果发现PPARγ激动剂罗格列酮显著下调HIV-1 Tat所诱导的hCMEC/D3中ICAM-l的蛋白表达,而对VCAM-1蛋白表达下调作用则较弱;同时,罗格列酮明显抑制HIV-1 Tat诱导的ICAM-1和VCAM-1的mRNA表达,表明其抑制HIV-1 Tat诱导的黏附分子反应;另外,罗格列酮对HIV-1 Tat诱导的ICAM-1和VCAM-1表达的抑制作用可被PPARγ拮抗剂GW9662部分逆转,提示罗格列酮作为PPARγ的高选择性、强效激动剂,通过激活PPARγ发挥有效的抗炎作用,一旦PPARγ的活性受到抑制,则影响罗格列酮发挥相应的生物学功能。
PI3K/Akt信号转导通路广泛存在于各种神经细胞中,研究认为PI3K/Akt通路介导了多种干预的神经保护功能[4,12-13]。Akt是一种丝氨酸/苏氨酸激酶,在PI3K/Akt信号转导通路中处于核心地位,是PI3K信号转导途径中一个重要的下游靶激酶。本研究中HIV-1 Tat、罗格列酮和Akt抑制剂KP3721共处理的细胞中罗格列酮对HIV-1 Tat诱导的ICAM-1和VCAM-1 mRNA表达下调作用被削弱,推测PPARγ通过Akt信号转导通路抑制HIV-1 Tat诱导的黏附分子促炎反应。另外,本文研究结果显示HIV-1 Tat诱导hCMEC/D3中p-Akt水平上调,而这一效应可被PPARγ激动剂罗格列酮抑制,可见罗格列酮激活PPARγ后,能够阻遏HIV-1 Tat诱导的Akt磷酸化反应。这与既往研究结果一致[14]。目前,PPARγ在信号转导方面的作用机制仍未完全阐明,国内也尚未有报道PPARγ对HIV-1 Tat诱导脑微血管炎性反应影响及其机制的研究。
总而言之,PPARγ激动剂罗格列酮能够抑制HIV-1 Tat诱导的黏附分子ICAM-1和VCAM-1表达上调,同时罗格列酮可抑制Akt的磷酸化,通过Akt信号转导通路抑制HIV-1 Tat诱导的黏附分子促炎反应。这将为PPARγ引入治疗HIV介导的炎性反应提供了依据,对HIV感染所致的神经系统功能障碍疾病的临床预防和治疗具有重要的现实意义。
志谢:感谢法国巴黎第五大学P-O Gouraud教授为本研究惠赠人脑微血管内皮细胞系。
[1]Huang W, Rha GB, Han MJ, et al. PPARalpha and PPARgamma effectively protect against HIV-induced inflammatory responses in brain endothelial cells[J].J Neurochem,2008,107(2):497-509.
[2]Huang W, Eum SY, András IE, et al. PPARalpha and PPARgamma attenuate HIV-induced dysregulation of tight junction proteins by modulations of matrix metalloproteinase and proteasome activities[J].FASEB J,2009,23(5):1596-1606.
[3]Ramirez SH, Heilman D, Morsey B, et al. Activation of peroxisome proliferator-activated receptor gamma (PPARgamma) suppresses Rho GTPases in human brain microvascular endothelial cells and inhibits adhesion and transendothelial migration of HIV-1 infected monocytes[J].J Immunol, 2008,180(3):1854-1865.
[4]Huang W, Andras IE, Rha GB, et al. PPARalpha and PPARgamma protect against HIV-1-induced MMP-9 overexpression via caveolae-associated ERK and Akt signaling[J]. FASEB J,2011,25(11):3979-3988.
[5]Song HY, Ryu J, Ju SM, et al.Extracellular HIV-1 Tat enhances monocyte adhesion by up-regulation of ICAM-1 and VCAM-1 gene expression via ROS-dependent NF-kappaB activation in astrocytes[J].Exp Mol Med,2007,39(1):27-37.
[6]Toborek M, Lee YW, Pu H,et al. HIV-Tat protein induces oxidative and inflammatory pathways in brain endothelium[J]. J Neurochem,2003,84(1):169-179.
[7]Pu H,Tian J,Flora G,et al.HIV-1 Tat protein upregulates inflammatory mediators and induces monocyte invasion into the brain[J].Mol Cell Neurosci,2003,24(1):224-237.
[8]Melendez MM, McNurlan MA, Mynarcik DC, et al.Endothelial adhesion molecules are associated with inflammation in subjects with HIV disease[J].Clin Infect Dis,2008,46(5):775-780.
[9]Hag AM, Kristoffersen US, Pedersen SF, et al.Regional gene expression of LOX-1, VCAM-1, and ICAM-1 in aorta of HIV-1 transgenic rats[J].PLoS One,2009,4(12):e8170.
[10]Yu MK,Lee JC,Kim JH,et al.Anti-inflammatory effect of peroxisome proliferator activated receptor gamma on human dental pulp cells[J].J Endod,2009,35(4):524-528.
[11]Lee S,Kim W,Kang KP,et al.Agonist of peroxisome proliferator-activated receptor-gamma, rosiglitazone, reduces renal injury and dysfunction in a murine sepsis model[J].Nephrol Dial Transplant,2005,20(6):1057-1065.
[12]Wang HY,Wang GL,Yu YH,et al.The role of phosphoinositide-3-kinase/Akt pathway in propofol-induced postconditioning against focal cerebral ischemia-reperfusion injury in rats[J].Brain Res,2009,1297:177-184.
[13]Xue Y,Xie N,Lin Y,et al.Role of PI3K/Akt in diazoxide preconditioning against rat hippocampal neuronal death in pilocarpine-induced seizures[J].Brain Res,2011,1383:135-140.
[14]Jang JH, Yang ES, Min KJ, et al.Inhibitory effect of butein on tumor necrosis factor-alpha-induced expression of cell adhesion molecules in human lung epithelial cells via inhibition of reactive oxygen species generation, NF-kappaB activation and Akt phosphorylation[J]. Int J Mol Med, 2012,30(6):1357-1364.
