重症肌无力与IL-17、RORγt水平的关系
2014-03-30金迪付锦李颖
金迪 付锦 李颖
既往研究发现,Th17细胞是机体内一种CD4+效应T细胞,该细胞特异性地产生白细胞介素17(IL-17)。维甲酸相关孤儿受体γ(retinoid-related orphan receptors-γt,RORγt)为Th17细胞的特异性转录因子[1]。现已证实,Th17细胞及其分泌的细胞因子,在多种自身免疫性疾病(如类风湿性关节炎、多发性硬化)和炎性疾病中发挥重要调节作用。既往关于重症肌无力(myasthenia gravis,MG)和Th17细胞关系的研究,主要是关于MG动物模型实验性自身免疫性重症肌无力(experimental autoimmune myasthenia gravis,EAMG)和Th17细胞相关性的研究,关于MG与Th17细胞相关性的研究还很少。本实验通过检测MG患者外周血中IL-17水平,分析其与MG严重程度相关性,并检测Th17细胞特异性转录因子RORγt mRNA表达量,探讨Th17细胞在MG中的可能作用及机制。
1 对象和方法
1.1观察对象选取作者医院住院的MG确诊患者80例,男42例、女38例,年龄18~82岁,平均年龄(43.45±19.24)岁。患者均为发病2周内,并根据MG诊断标准[2]诊断,包括反复发生的骨骼肌耐力下降,疲劳试验(+),新斯的明试验(+),肌电图低频重复神经电刺激波幅递减和胆碱酯酶抑制剂有效等进行诊断,并排除并发心脑血管疾病、糖尿病,甲状腺功能亢进、严重肝肾功能不全、肿瘤患者,类风湿性关节炎、系统性红斑狼疮等自身免疫性疾病患者,感染性疾病患者,以及入院前3个月内应用炎性抑制剂、免疫抑制剂及糖皮质激素的患者。患者均行增强胸腺CT检查明确有无胸腺瘤。根据Osserman分型将MG患者分为4组:眼肌型组20例,男8例、女12例,年龄18~56岁,平均年龄(32.10±11.99)岁;轻度全身型组24例,男、女各12例,年龄21~72岁,平均年龄(41.04±17.35)岁;中度全身型组20例,男12例、女8例,年龄23~80岁,平均年龄(48.05±20.93)岁;急性重症型组16例,男10例、女6例,年龄30~82岁,平均年龄(56.13±19.07)岁。
健康对照(对照组)30名,男16名、女14名,年龄18~79岁,平均年龄(47.90±18.61)岁,均为作者医院体检中心健康体检者,既往无自身免疫性疾病和高血压、糖尿病等慢性疾病,并且采血前1个月内未患感冒、腹泻等感染性疾病。
1.2方法所有MG患者均于入院次日晨、健康对照于体检当日晨取空腹时肘静脉血,其中4 mL(无抗凝剂)血清用于细胞因子IL-17的ELISA检测,6 mL(以K2EDTA抗凝)用于逆转录聚合酶链式反应(RT-PCR)检测。
1.2.1血清IL-17水平检测:用ELISA法检测血清IL-17(ELISA试剂盒购自上海西唐生物科技有限公司)。实验中设置空白对照和阴性对照,操作过程按产品说明分别进行,蛋白包被、孵育一抗和二抗后加入显色剂, 30 min内用酶标仪在450 nm波长依序测量各孔的吸光度〔D(λ)〕值。结果判读使用CurveExpert1.3软件,根据标准品浓度D(λ)值绘制标准曲线,然后根据待测样品的D(λ)值在该曲线上计算出相应的IL-17含量。
1.2.2MG患者病情严重程度评分:采用重症肌无力临床绝对评分法[3]评分,双侧分别评分。
1.2.3IL-17水平与MG病情严重程度相关性:分析IL-17水平与MG肌无力程度评分的相关性。
1.2.4各组RORγt mRNA检测:(1)血浆总RNA提取:在试管中加入适量体积淋巴细胞分离液,将抗凝血6 mL与Hank’s液按体积1∶1充分混匀后叠加于分层液面上,以1500 r/min水平离心(离心半径15 cm)15 min,离心管由上至下分为4层,第1层为血浆,第2层为环状乳白色淋巴细胞层,第3层为透明分离液层,第4层为红细胞层。用直头吸管插到第2层,吸取收集淋巴细胞置入另一试管中,加入5倍以上体积的Hank’s液以1500 r/min(离心半径15 cm)离心10 min,弃上清,加入小牛血清终浓度为10%(体积浓度)的RPMI1640重悬细胞,经细胞计数板计数后,吸取l×106个细胞,按照逆转录PCR试剂盒(TaKaRa宝生物工程有限公司)说明步骤提取总RNA,于55~60℃下孵育10 min。从提取的总RNA中取部分样品用紫外分光光度仪分别测定260 nm和280 nm的D(λ)值,计算RNA样品纯度R值〔R=D(λ)260 nm/D(λ)280 nm〕,R值在1.8~2.0之间,说明提取的RNA纯度较好,杂质污染少,可以进行后续的实验。剩余样品-80℃保存备用。(2)引物设计:RORγt上游引物为5′-ACCTCACGAGGCCATTCAG-3′,下游引物为5′-TAGGCC CGGCACATCCTAAC-3′,预扩增片段长度169 bp;参照基因GAPDH上游引物为5′-GCACCGTCAAGGCTGAGAAC-3′,下游引物为5′-ATGGTGGTGAAGACGCCAGT-3′,预扩增片段长度210 bp。(3)RT-PCR检测:取备用总RNA 1 μg,依据试剂盒(购自Takara公司 RR041A)说明步骤进行。反应条件:30℃10 min、45℃30 min、99℃5 min、5℃5 min,42℃逆转录60 min,95℃变性5 min,70℃10 min终止反应,置于冰上,所得cDNA 1 μL用于PCR扩增,其余于-20℃保存。以cDNA为模板进行扩增,RORγt反应条件为94℃ 3 min,94℃ 45 s,48℃ 45 s,72℃ 75 s,共进行30个循;72℃延伸10 min,于4℃终止反应,扩增产物置-20℃冻存备用。(4)检测RT-PCR反应产物:扩增产物在2%(质量浓度)琼脂糖凝胶中以5 V/cm稳压电泳20 min, Maker相对分子质量为2000,紫外灯下观察结果并摄影。采用MGIAS-1000型图像分析系统测定每组标本RORγt以及GAPDH扩增产物的D(λ)值,计算RORγt与GAPDH的D(λ)比值,作为RORγt mRNA相对表达水平。
1.3统计学处理采用SPSS13.0软件进行分析。数据以均数±标准差表示。多组间均数比较采用方差分析,组间两两比较采用Dunnett检验,相关性分析采用Spearman相关分析方法。以P<0.05为差异有统计学意义。
2 结果
2.1各组血清IL-17水平眼肌型组、轻度全身型组、中度全身型组及急性重症型组患者血清IL-17水平均高于对照组(P<0.05),MG各组间比较差异有统计学意义(F=96.12,P<0.05),轻度全身型组高于眼肌型组,中度全身型组高于轻度全身型组和眼肌型组,急性重症型组高于轻度全身型组和眼肌型组(均P<0.05),中度全身型组与急性重症型组比较差异无统计学意义(P>0.05)(表1)。
2.2血清IL-17表达水平及其与MG严重程度相关性分析MG各组患者肌无力程度评分见表1。MG患者血清IL-17水平与重症肌无力疾病严重程度呈正相关(r=0.867,P<0.05)。
2.3各组RORγtmRNA相对表达各实验组RORγt mRNA相对表达量见表1和图1。除眼肌型组外,MG各组RORγt mRNA相对表达量均高于对照组(P<0.05);MG各组间比较差异有统计学意义(F=109.82,P<0.05);轻度全身型组高于眼肌型组,中度全身型组高于轻度全身型组和眼肌型组,急性重症型组高于中度全身型组、轻度全身型组和眼肌型组(均P<0.05)。
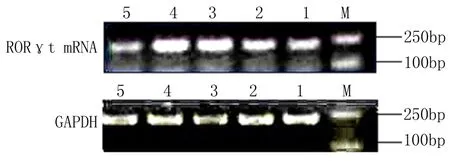
1:眼肌型组2:轻度全身型组3:中度全身型组4:急性重症型组 5:对照组;M:Maker 2000
图1各组RORγt mRNA相对表达的RT-PCR电泳图
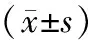
表 1 各实验组肌无力评分、血清IL-17水平和RORγt mRNA相对表达的比较
注:与对照组比较,*P<0.05;与眼肌型组比较,△P<0.05;与轻度全身型组比较,﹟P<0.05;与中度全身型组比较,▲P<0.05
3 讨论
MG发病机制涉及遗传因素、自身抗体作用、细胞免疫和细胞因子作用、补体作用以及胸腺异常等多方面因素[4]。MG的细胞免疫是由Th1细胞及其产生的细胞因子主导的,MG发病过程中Th1细胞产生的细胞因子主要为干扰素γ(IFN-γ),IFN-γ能提呈肌肉乙酰胆碱受体(acetylcholine receptor,AChR)表位,促进B细胞成熟并辅助产生乙酰胆碱受体抗体(AChR-Ab)[5],进一步增强针对AChR的免疫损伤。Mu等[6]关于雌性路易鼠EAMG的研究中于EAMG晚期检测到脾组织中IFN-γ和IL-17增加,同时发现Th1细胞和Th17细胞比例的增加,而且随着Th17细胞的数量增多,高水平IL-17使EAMG加重。此研究提示在MG发生发展过程,Th17细胞可能在高水平IL-17情况下起到了关键的作用。另有一项究发现,IL-17可以通过与IL-17受体(IL-17R)结合,活化有丝分裂原活化蛋白激酶(MAP)和核因子(NF-κB),并在多种细胞因子、炎性趋化因子、协同刺激信号等参与下,由AChR α亚基97-116肽段(R97-116肽)诱导,增强T细胞的启动活化与增殖,上调T细胞应答水平来调节细胞免疫,从而参与MG的病理过程[7]。目前研究已知MG的病理过程与EAMG晚期时非常相似,提示在人类MG病理过程中IL-17可能也存在这种变化。目前关于MG患者与Th17细胞关系的研究极少。本研究结果显示MG患者外周血IL-17水平明显高于对照组,这与上述关于EAMG晚期研究的结果相一致,提示在人类MG病理过程中,IL-17可能通过上调T细胞应答,参与MG的发病过程,并在高水平IL-17形成后导致MG发病。
B细胞活化因子(BAFF)是有效的B细胞存活因子,其在维持B细胞稳态及成熟方面发挥了重要作用[8],并随着AChR水平增加而增多。Barbosa等[9]的研究表明IL-17可能通过BAFF合作协调来增加人类B细胞存活率及维持其成熟。在本实验中IL-17水平与MG疾病严重程度成正相关,也提示L-17可能通过与BAFF协同参与MG的病理过程。Barbosa等[9]的研究结果还显示IL-17可能通过诱导AChR特异性B细胞的增殖,并在生发中心导致原始的B细胞积累,进一步促进AChR及其抗体的产生。既往研究表明, IL-17诱导B细胞增殖这一过程是接合体分子激活剂1(Act1)通过成纤维细胞生长因子白细胞介素17-成纤维细胞生长因子白细胞介素17受体结构域(SEFI-SEFIR)之间的相互作用,募集IL-17受体并激活B细胞增殖分化的NF-κB和磷脂酰肌醇3激酶/蛋白质丝氨酸苏氨酸激酶(PI3K/Akt)这两条途径实现的[10],而IL-17介导的T细胞活化也涉及NF-κB途径,也支持IL-17可能通过介导T细胞活化及B细胞增殖参与MG发生发展过程。
RORγt是Th17特异性转录因子[11]。Ruan等[12]的研究发现,Th17细胞的免疫作用是由c-Rel蛋白-维甲酸相关孤儿受体γ-维甲酸相关孤儿受体γt(Rel-RORγ-RORγt)轴控制的。抗原提呈细胞(APCs)在IL-1、IL-6、IL-23和转化生长因子-β(TGF-β)存在的条件下,结合T细胞抗原受体(TCR)、CD28、IL-1或IL-23受体导致蛋白激酶Iκκβ活化,并磷酸化抑制蛋白IκBα,释放c-Rel- p65结合蛋白(c-Rel和p65均为Rel/NF-κB家族成员)二聚体移行至细胞核,结合单基因RORγ和RORγt启动子而启动Th17分化,在细胞因子作用下生成IL-17[13]。本实验中,MG各组患者RORγt mRNA表达量均高于对照组,且MG各组间RORγt mRNA表达量差异有统计学意义,再一次从转录水平表明,RORγt作为Th17细胞特异性转录因子,启动Th17分化,生成IL-17,在MG的发生发展中发挥作用,本研究还推测RORγt mRNA可能在间接形成IL-17后参与MG分型及疾病严重程度高低。由于RORγt存在异构体RORγ,而RORγ也同样介导Th17细胞的分化,因此是否MG发病过程中主要涉及RORγt或二者兼有,以及二者作用的大小均需要进一步明确。
本研究结果显示,MG患者外周血IL-17水平和RORγt mRNA表达水平高于对照组,且外周血IL-17水平与MG严重程度呈正相关,推测RORγt mRNA可能也是人类MG的特异性转录因子,并推测高水平IL-17形成后可能导致MG发病,但是否在人类Th17细胞中存在其他转录因子及RORγt 在人类MG中的转录调节机制、IL-17参与MG发病的分子生物学机制等都需进一步研究。
[1]Weaver CT. Th17:The ascent of a new effector T-cell subset[J]. Eur J Immunol, 2009, 39 (3):634-675.
[2]吴江.神经病学[M]. 北京:人民卫生出版社,2010,381-386.
[3]王秀云,许贤豪,孙宏,等.重症肌无力病人的临床绝对评分法和相对评分法[J].中华神经科杂志, 1997, 30(2): 87-90.
[4]Jindrich S, Xiao BW. Complement regulatory protein Crry deficiency contributes to the antigen specific recall response in experimental autoimmune myasthenia gravis[J]. Inflammation, 2012, 9: 20.
[5]Yang H, Zhang Y, Wu M, et al. Suppression of ongoing experimental autoimmune myasthenia gravis by transfer of RelB-silenced bone marrow dentritic cells is associated with a change from a T helper Th17/Th1 to a Th2 and FoxP3+regulatory T-cell profile[J].Inflamm Res, 2010, 59(3):197-205.
[6]Mu L, Sun B, Kong Q, et al. Disequilibrium of T helper type 1, 2 and 17 cells and regulatory T cells during the development of experimental autoimmune myasthenia gravis[J]. Immunology, 2009, 128: e826-836.
[7]Aricha R, Mizrachi K, Fuchs S, et al. Blocking of IL-6 suppresses experimental autoimmune myasthenia gravis[J]. J Autoimmun, 2011, 36(1):65-75.
[8]Ragheb S, Lisak RP. B-cell-activating factor and autoimmune myasthenia gravis[J]. Autoimmune Dis, 2011,939520.
[9]Barbosa RR, Silva SP, Silva SL, et al. Primary B-cell deficiencies reveal a link between human IL-17-producing CD4 T-cell homeostasis and B-cell differentiation[J]. PLoS One, 2011,6(8):e22848.
[10]Jayam TA, Dabi A, Solieman N, et al. Myasthenia gravis: a review[J]. Autoimmune Dis, 2012,874680.
[11]Hwang ES. Transcriptional regulation of T helper 17 cell differentiation[J]. Yonsei Med J, 2010, 51(4):484-491.
[12]Ruan Q, Kameswaran V, Zhang Y,et al. The Th17 immune response is controlled by the Rel-RORγ-RORγ T transcriptional axis[J]. J Exp Med, 2011, 208(11):2321-2333.
[13]Lazarevic V, Chen X, Shim JH, et al. T-bet represses T(H)17 differentiation by preventing runx1-mediated activation of the gene encoding RORγt[J]. Nat Immunol, 2011, 12(1):96-104.
