鲫Dmrt3基因的克隆和表达分析
2014-03-29王佳罗琛
王 佳 罗 琛
(浙江大学生命科学学院, 杭州 310058)
鲫Dmrt3基因的克隆和表达分析
王 佳 罗 琛
(浙江大学生命科学学院, 杭州 310058)
DMRT家族是一个与性别决定相关的转录因子家族。为了研究家族成员之一的Dmrt3在我国重要养殖鱼类鲫胚胎发育、性别分化中的功能以及在育种中的作用, 我们克隆了鲫 Dmrt3基因的 cDNA全长, 并对Dmrt3基因在发育早期和不同组织中的表达进行了分析。结果显示: 鲫Dmrt3基因cDNA全长为2182 bp, 其中5′端非编码区408 bp, 3′端非编码区427 bp, 开放阅读框1347 bp, 编码448个氨基酸。蛋白结构预测显示DMRT3除了正常的DM结构域外, 还有DMA结构域, 在进化上与DMRT4和DMRT5的亲缘关系更近。巢式RT-PCR分析结果表明Dmrt3直到尾芽期才开始有微量表达, 表达量在15体节期有明显增加但仍然处在一个较低的水平; 在成体组织中只在精巢中检测到表达。这种表达时空模式提示Dmrt3可能在早期器官发生和雄性性腺发育调控中起作用。对Dmrt3启动子CpG岛的甲基化分析表明所检测的组织和配子中并不发生甲基化, 说明这种雌雄特异性和组织特异性差异表达并不是通过对该基因启动子的差异甲基化修饰来调控的。此外, 我们还发现了鲫 Dmrt3的一个由逆转录产物形成的假基因 pDmrt3。这些结果为进一步研究鲫Dmrt3在性别分化中的作用和评估其在鲫性别控制育种中的价值, 以及分析 DMRT家族的进化关系提供了基础资料。
鲫; Dmrt3; 基因克隆; 基因表达
DMRT(Doublesex and Mab-3 related transcription factor)家族是一个与性别决定相关的转录因子家族。该家族成员编码的蛋白质都具有一个富含半胱氨酸的 DNA结合结构域(DNA-binding motif, DM)[1]。该结构域为螯合两个Zn原子的锌指结构[2,3],在不同的脊椎动物之间存在着高度的保守性[4]。但不同的 Dmrt家族基因在表达上存在差异并在功能上出现了明显的分化。在小鼠中, Dmrt1于性别决定早期在生殖嵴中表达, Dmrt1缺失的小鼠精巢分化受到严重的影响[5]。在已检测过的鱼类中 Dmrt1也只在性腺中表达, 在其他组织中几乎不表达, 而且在雄性性腺中表达量显著高于雌性, 表明该基因在性别决定和性腺发育中具有重要作用[6—10]。在斜带石斑鱼中的研究表明Dmrt1只在精巢的生精细胞中表达而不在支持细胞中表达, 提示其可能的功能是调控精原细胞向精母细胞发育[11]。 鳉在青 胚胎发育期, Dmrt2主要在体节中胚层中表达[12]。在斑马鱼中, Dmrt2有两个在基因加倍后形成的不同拷贝Dmrt2a和Dmrt2b[13], 二者也主要在前体节中胚层和发育中的体节中表达, 但通过不同方式调节体节形成[14,15]。Dmrt3在日本河豚[16]和斑马鱼[17]性腺中的表达情况与 Dmrt1类似, 提示其可能参与了性别分化调控和雄性性腺的发育调控, 但 Dmrt3也还在器官发育阶段的河豚[16]和斑马鱼神经系统中[17], 以及在热带爪蟾的神经系统中表达[18]。在小鼠中, Dmrt3在脊髓的DI6区神经元中表达, 参与神经元在该区特化[19]。Dmrt4在小鼠胚胎期和出生后的发育时期都广泛性表达, 在精巢和卵巢中表达水平相当[20], 并参与调控嗅觉系统的神经形成[21]。在小鼠中, Dmrt5/Dmrta2主要在脑中表达, 在其他组织中也有微量表达, 但在卵巢中的表达水平高于在精巢中的表达水平。最近的研究表明斑马鱼 Dmrt5/Dmrta2基因除了在发育中的胚胎脑中表达外, 还在成体斑马鱼精巢中表达和调控精子发生[22]。Dmrt6只在脑中检测到表达[23]。Dmrt7只在性腺中检测到表达, 但在卵巢中的表达量大于在精巢中的表达量, 可能在雌性生育中起重要作用[24]。
已有的研究表明, 在人类以及小鼠、斑马鱼、青 鳉等模式动物中, Dmrt1、Dmrt2和Dmrt3都具有保守的同线性关系[25], 说明这三个基因可能是通过基因扩增后进化而来的紧密同源基因。Dmrt3既在精巢中表达又在脊髓的神经元中表达, 与 Dmrt4、Dmrt5在神经系统中表达类似, 提示其与这些基因在进化上也有密切的关系。因此, 克隆不同脊椎动物的 Dmrt3基因, 并分析其表达时空模式, 以确定不同脊椎动物Dmrt3基因在基因序列、表达时空模式方面有无共同特征, 进而比较其与脊椎动物其他Dmrt基因在序列上的异同, 对揭示 Dmrt基因家族成员间的进化关系具有关键的作用, 对深入研究基因扩增后同源基因的功能分化也具有重要意义。
鲫是我国广泛养殖的重要食用和观赏鱼类, 并且具有两性生殖的二倍体亚种和天然雌核发育的多倍体亚种, 是研究鱼类生殖控制和基因组进化的独特材料[26,27]。因此, 克隆鲫的 Dmrt3基因, 并对其在早期发育过程中和不同组织中的表达进行分析,既可为研究其进化提供新的资料, 又可为研究Dmrt3基因在鲫这一我国重要经济鱼类中的功能和在性别控制育种中的价值提供基础。
1 材料与方法
1.1 材料
实验所用鲫(Carassius auratus)为两性生殖的二倍体鲫。雌、雄鲫均于繁殖季节购自杭州市鱼类养殖场。雌、雄亲本在本实验室水族箱中分别养殖。在繁殖季节采用人工授精的方法获取鲫的胚胎, 置于22℃±1℃的环境发育。卵巢、精巢、心脏、肝脏、脾、肾、脑这些成体组织取自活体解剖的鲫。取得这些材料后, 迅速投入液氮冷冻, 并存于-80℃冰箱备用。
1.2 试剂
ExTaq酶、逆转录试剂盒和pMD18-T克隆载体试剂盒购自Takara公司, SMARTerTMRACE试剂盒、Genome Walker试剂盒购自 ClonTech公司, CpGenome DNA修饰试剂盒购自Chemicon公司, 胶回收试剂盒购自 Axygen公司, 其余试剂均为国产分析纯, PCR引物的合成及核苷酸序列的测定均由上海生工生物工程技术服务有限公司完成。
1.3 总RNA的提取和cDNA第一链的获得
使用总RNA提取试剂盒SV Total RNA Isolation System(Promega)提取鲫发育早期和成体不同组织的总RNA。将溶于无核酸酶水中的RNA置于–80℃冰箱中备用。以提取的总 RNA为模板, 使用 ClonTech公司的 SMARTer RACE试剂盒分别合成 5′和 3′RACE-Ready cDNA, 构建cDNA文库。具体操作按照试剂盒说明书进行。
1.4 鲫Dmrt3 cDNA的克隆
从 GeneBank中比较多种鱼类和其他脊椎类的Dmrt3 cDNA的序列, 从中得到一段140 bp左右的比较保守的区域, 根据保守区域序列设计简并引物A1和A2(表1)扩增。PCR的反应体系为10 μL, 反应条件为: 预变性94℃, 5min, 变性94℃, 30s, 退火63.5℃, 30s, 延伸 72℃, 30s, 32个循环, 然后延伸7min结束反应。于1.2%琼脂糖胶上电泳, 确认目的片段之后大体系胶回收, 并克隆到pMD18-T载体上测序。测序结果经过比对确认其的确为Dmrt3的同源片段。然后在得到的测序结果的基础上设计RGSP1和RGSP2(表1), 按照SMARTer RACE试剂盒的说明进行5′和3′RACE扩增。对所得到的5′端和 3′端的片段进行拼接, 获得鲫的 Dmrt3基因cDNA全长, 设计 5′端上游正向引物和 3′端下游反向引物DS和DAS(表1), 进行连锁分析确保片段的正确性。
1.5 氨基酸序列分析和多重比对
根据 Dmrt3核苷酸的序列推测出其氨基酸序列。利用ClustalX软件, 并结合NCBI的在线蛋白多序列比对工具COBALT进行序列的比对和分析。所需的不同物种DMRT序列在GeneBank上的登录号见表2。
1.6 半定量和嵌套式RT-PCR分析
反应体系为20 μL, 测定所得RNA的浓度, 定量所有的RNA为1000 ng。以鲫18S rRNA为内参。取逆转录cDNA各1 μL, 以引物18S rRNA-F和18S rRNA-R(表1)进行PCR扩增。反应体系为10 μL: 10× ExTaq buffer 1 μL, dNTP 0.8 μL, 18S rRNA-R 0.5 μL, 18S rRNA-F 0.5 μL, ExTaq 0.1 μL, cDNA 1 μL, 水6.1 μL。预变性94℃, 5min, 接着94℃, 30s, 61℃,30s, 72℃, 30s, 28个循环, 然后延伸7min结束反应。反应结束各取5 μL产物经过1.2%琼脂糖凝胶电泳, UVP凝胶成像系统拍照, 以产物含量最多的模板为参照, 均一化各个模板的量, 重新确定cDNA的量。确定好内参之后, 以Dmrt3特异性引物B1和B2(表1)确定鲫Dmrt3在成体组织中的表达情况。使用嵌套引物C1和C2(表1), 其位于引物B1和B2引物的内侧, 来确定基因在早期胚胎中的表达情况。

表1 克隆鲫Dmrt3 cDNA全长、表达分析和甲基化分析所用的引物Tab. 1 Primers used for cloning, expression and methylation analysis of goldfish Dmrt3
1.7 Dmrt3上游启动子区的获得和甲基化分析
按照Genome Walker试剂盒的要求将鲫的基因组 DNA进行酶切消化, 每个样品和阳性对照各取5 μL进行电泳检测酶切是否完全。对酶切产物进行纯化后连接Genome Walker接头, 得到鲫的基因组酶切文库。根据已经得到的Dmrt3的mRNA序列设计三条反向的引物, AP为接头序列。最后选用GSP3AS和AP1进行首轮PCR: 94℃预变性5min; 94℃, 25s, 72℃, 3min, 7个循环; 94℃, 25s, 67℃, 3min, 32个循环; 67℃, 最后延伸7min, 所得到的PCR产物稀释20倍, 然后以GSP1AS和AP2进行二轮的巢式PCR: 94℃预变性5min; 94℃, 25s, 72℃, 3min, 5个循环; 94℃, 25s, 67℃, 3min, 20个循环; 67℃, 延伸7min, 扩增得到Dmrt3的上游启动子序列。
利用网上公开的CpG岛预测和甲基化PCR引物设计软件 MethPrimer, 通过该软件对启动子区CpG 岛设计亚硫酸氢盐 PCR引物 Meth-S和Meth-AS(表1)。根据常规的苯酚氯仿有机溶剂抽提DNA的方法提取鲫DNA, 并根据CpGenome DNA修饰试剂盒说明书对基因组 DNA进行亚硫酸氢钠修饰处理, 之后进行甲基化特异性扩增。
2 结果
2.1 鲫Dmrt3 cDNA的克隆
用 SMARTer RACE试剂盒进行 3′RACE和5'RACE获得了鲫Dmrt3的cDNA的完整序列。该序列全长为 2182 bp, 其中 5′端非编码区(5′-UTR) 408 bp, 3′端非编码区(3′-UTR)427 bp, 开放阅读框(ORF)1347 bp, 编码 448个氨基酸。序列已提交至GenBank(登录号: KC733765)。

表2 本文所引用的不同物种Dmrt在GeneBank中的登录号Tab. 2 Cited GeneBank accession numbers of various Dmrts
此外, 我们在进行 Dmrt3基因组分析时还在鲫基因组中发现了一个只有部分编码序列的Dmrt3基因拷贝。该拷贝全长625 bp, 包含起始密码ATG和polyA加尾信号序列, 在编码区域有多个终止的密码。这些特征说明其是一个从mRNA经逆转录而来,并已缺失了大部分编码序列的加工假基因。该假基因已经命名为pDmrt3并也已提交至GenBank(登录号: KC733764)。
2.2 鲫 DMRT3蛋白结构的预测及进化分析 Dmrt基因家族进化树的构建
使用Jellyfish软件, 利用所获得的Dmrt3核苷酸序列推测出Dmrt3的氨基酸序列如图1a所示。氨基酸序列同源性分析表明, 鲫 Dmrt3编码的氨基酸序列和斑马鱼(Danio rerio)的序列同源性为 90.8%,和爪蟾(Xenopus laevis)序列同源性为 64.9%, 和小鼠(Mus musculus)序列同源性为62.3%。利用SMART在线分子结构预测工具(http://smart.embl.de/)对鲫DMRT3的蛋白结构进行预测分析, 结果发现除了DM结构域外, 还有DMA结构域(图1b)。
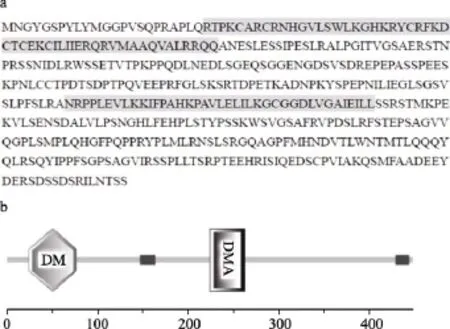
图1 推测的鲫DMRT3氨基酸序列及蛋白质结构示意图Fig. 1 The putative amino acid sequence and the diagram of the putative conserved domains of goldfish DMRT3
对GenBank数据库上能搜索到的不同脊椎动物Dmrt家族成员氨基酸序列及得到的鲫Dmrt3推测出来的氨基酸序列进行比对, 将比对的结果导入NCBI, 采用Neighbor Joining方法并利用COBALT工具辅助构了 Dmrt基因家族建进化树(图 2)。因DMRT6只有小鼠一个物种的序列信息, 并且其DMRT8序列(ABC48237.1)与Dmrt家族的其他序列存在大于 85%的差异, 在建立进化树时将它们排除。从构建的进化树中可以看到鲫的 DMRT3与斑马鱼DMRT3最为接近, 红鳍东方 鲀和黄鳝聚为同一亚族, 再和斑马鱼-鲫这一支聚为一个大支, 爪蟾和小鼠聚为一支, 再和上述大支聚合, 这与其分类地位是一致的。还可以看出DMRT3、DMRT4、DMRT5在进化上是很接近的, 分为一个大支, DMRT2和DMRT7在进化上亲缘关系比较近, DMRT1形成单独的一支。
2.3 鲫 Dmrt3在早期各个发育时期和各个组织中的表达情况
半定量 RT-PCR分析表明在鲫早期胚胎发育过程中, Dmrt3在尾芽期以前检测不到表达, 在尾芽期经嵌套式PCR才检测到微量表达, 到 15体节期其表达量明显增加但仍然难以经一轮 RT-PCR检测到(图3)。在鲫成体组织中, 半定量RT-PCR只在精巢中检测到 Dmrt3表达, 在卵巢、心脏、肝脏、脾、肾和脑等组织中都未检测出表达(图 4)。其中, +RT表示cDNA合成时加入了逆转录酶, -RT表示cDNA合成时没有加入逆转录酶。
2.4 鲫Dmrt3启动区的甲基化分析
鲫Dmrt3只在成体精巢中被检测到表达, 在卵巢和其他成体组织中都没有检测到表达。为了解这种两性特异性和组织特异性差异表达是否与差异甲基化有关, 我们用在线工具 MethPrimer对鲫的Dmrt3启动区1207 bp进行分析。分析结果表明在该基因起始密码子上游启动子的–215至–71 bp区域内的GC含量大于50%, 符合CpG岛的标准。为此, 我们对该 CpG岛在鲫的不同组织和配子中的甲基化状况进行了亚硫酸氢盐转换测序分析。结果表明在所有被检测的鲫组织和配子中, 除极少数克隆中的部分位点发生不稳定的甲基化外, 总体上Dmrt3启动子区的CpG岛不发生甲基化(图5)。这一结果说明 Dmrt3的性别特异性和组织特异性表达并不是通过对该基因启动子 CpG岛的差异甲基化修饰来调控的。
3 讨论
3.1 DMRT3与其他DMRT家族成员的进化关系
氨基酸序列的保守性分析表明鲫DMRT3与其他脊椎动物的DMRT3一样, 除了具有DMRT家族蛋白所都具有的DM结构域外, 还有DMA结构域。根据序列保守性所进行的不同脊椎动物DMRT3的进化分析表明鲫的DMRT3与斑马鱼DMRT3最为接近,红鳍东方 鲀和黄鳝聚为同一亚族,再和斑马鱼-鲫这一支聚为一个大支, 爪蟾和小鼠聚为一支, 再和上述大支聚合。这与用传统方法所进行的物种亲缘关系分类结果一致。
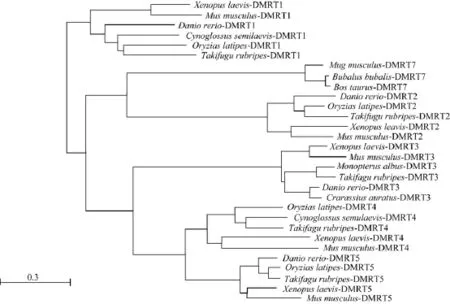
图2 采用Neighbor Joining方法构建的不同物种DMRT家族系统进化树Fig. 2 Phylogenetic tree of DMRT family generated with Neighbor Joining method

图3 鲫胚胎发育早期Dmrt3的表达Fig. 3 Dmrt3 expression during early embryogenesis in goldfish

图4 鲫成体组织中Dmrt3的表达RT-PCR检测Fig. 4 RT-PCR examination of Dmrt3 expression in various adult tissues of goldfish
在Dmrt基因家族中, Dmrt1、Dmrt2、Dmrt3位于同一个连锁群上,提示我们这三个基因很可能是通过基因扩增进化而来的紧密同源的基因。但DMRT1、DMRT2中只有DM结构域, 而DMRT3与DMRT4、DMRT5一样既有DM又有DMA结构域, 而且都在神经系统中检测到了表达[17,20,23], 提示其与DMRT4、DMRT5在进化上可能存在更为直接的关系。进化树表明 DMRT3、DMRT4与DMRT5在进化上的亲缘关系的确更近(图2)。由于DMA结构域被认为是更古老的结构域[28],因此DMRT3可能是比DMRT1和DMRT2更原始的基因。在脊椎动物基因扩增和整个基因组加倍后冗余基因的进化过程中, 一般只有原始的多功能基因通过冗余基因拷贝以互补的方式分享其原始基因的功能而产生新的基因[29,30]。因而Dmrt3可能是Dmrt基因家族中原始的多功能基因。Dmrt1和Dmrt2、Dmrt3的连锁关系提示Dmrt1和Dmrt2可能是Dmrt3基因扩增后功能分化产生的新基因。位于不同染色体上的 Dmrt3、Dmrt4和 Dmrt5基因所编码的蛋白都具有 DM 和DMA两个结构域, 提示这些基因是经历基因组加倍后分化而产生的新基因。
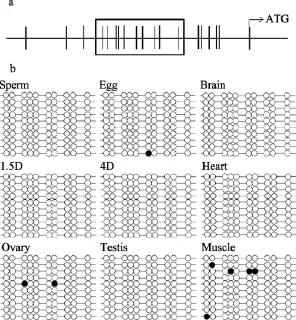
图5 Dmrt3启动子CpG岛在胚胎和不同成体组织中的甲基化状态Fig. 5 Methylation state of Dmrt3 promoter CpG island in embryo and various adult tissues
3.2 鲫Dmrt3的表达与在发育过程中的可能功能
鲫Dmrt3在早期胚胎发育阶段没有检测到表达,尾芽期开始检测到微量表达, 在此之后其表达水平逐步提高, 到 15体节期可以检测到较高水平的表达。这种表达时间模式与斑马鱼中类似, 但在鲫中该基因在胚胎发育阶段的表达水平显然比在同期斑马鱼胚胎中要低, 即使到15体节期也需要用嵌套式PCR才能检测到。因此, 我们没有做进一步的组织特异性表达原位杂交分析。由于已有的研究表明在DMRT家族中, 具有DMA结构域的DMRT3、DMRT4、DMRT5能在神经系统的相关器官中表达[16,17], 提示鲫的 DMRT3也可能在器官发生阶段在神经系统的发育调控中起作用。
在鲫成体组织中, 所检测7种组织中Dmrt3只在精巢中表达(图4)。这与日本河豚鱼Dmrt3在精巢中表达[16]相同, 但与斑马鱼Dmrt3在精巢和卵巢中都有表达[17]存在差异。这些观察结果提示Dmrt3的功能在鲫和日本河豚中可能比在斑马鱼中有了进一步的限定, 在成体阶段只保留了调控雄性性腺发育的功能。因此, 在深入了解鲫 Dmrt3基因在雄性性腺发育调控中的功能和机制后, 可用于鲫雄性控制育种。
对Dmrt3启动子CpG岛的甲基化分析表明所检测的组织和配子中并不发生甲基化, 说明鲫中Dmrt3雌雄特异性和组织特异性差异表达并不是通过对该基因启动子的差异甲基化修饰来调控的。由于Dmrt1、Dmrt2、Dmrt3位于同一个连锁群上, 这些基因的表达是否有共同的调控元件和调控机制还不清楚, 因此, 不能排除其他 Dmrt基因如果发生差异甲基化对Dmrt3雌雄特异性差异表达的可能影响。
[1] Raymond C S, Shamu C E, Shen M M, et al. Evidence for evolutionary conservati-on of sex-determining genes [J]. Nature, 1998, 391(6668): 691—695
[2] Burtis K C, Baker B S. Drosophila doublesex gene controls somatic sexual differen-tiation by producing alternatively spliced mRNAs encoding related sex-specific poly-peptides [J]. Cell, 1989, 56(6): 997—1010
[3] Erdman S E, Burtis K C. The Drosophila doublesex proteins share a novel zinc finger related DNA binding domain [J]. The EMBO Journal, 1993, 12(2): 527—535
[4] Smith C A, McClive P J, Western P S, et al. Evolution: Conservation of a sex-deterining gene [J]. Nature, 1999, 402(6762): 601—602
[5] Raymond C S, Kettlewell J R, Hirsch B, et al. Expression of Dmrt1 in the genital ridge of mouse and chicken embryos suggests a role in vertebrate sexual developme[J]. Developmental Biology, 1999, 215(2): 208—220
[6] Alam M A, Kobayashi Y, Horiguchi R, et al. Molecular cloning and quantitative expression of sexually dimorphic markers Dmrt1 and Foxl2 during female-to-male sex change in Epinephelus merra [J]. General and Comparative Endocrinology, 2008, 157(1): 75—85
[7] Wen A Y, You F, Sun P, et al. Cloning of dmrt1 gene and its tissue expression analyses compared with that of P450arom gene in olive flounder (Paralichthys olivaceus) [J]. Marine Sciences, 2010, 34(11): 97—102 [文爱韵, 尤锋, 孙鹏, 等.牙鲆dmrt1基因的克隆及其与P450arom基因的组织表达分析. 海洋科学, 2010, 34(11): 97—102]
[8] Deng S P, Chen S L. Molecular cloning, characterization and RT-PCR expression analysis of Dmrt1α from half-smooth tongue-sole, Cynoglossus semilaevis [J]. Journal of Fishery Sciences of China, 2008, 15(4): 577—584 [邓思平, 陈松林.半滑舌鳎Dmrt1α基因的cDNA克隆及其表达. 中国水产科学, 2008, 15(4): 577—584]
[9] Deng S P, Wang J J, Wu T L, et al. cDNA cloning and expression analysis of Dmrt1 in Clarias fuscus [J]. Acta Hydrobiologica Sinica, 2012, 36(4): 610—617 [邓思平, 王静杰, 吴天利, 等. 胡子鲇Dmrt1基因全长cDNA克隆及其表达分析. 水生生物学报, 2012, 36(4): 610—617]
[10] Cao M, Duan J, Cheng N, et al. Sexually dimorphic and ontogenetic expression of dmrt1, cyp19a1a and cyp19a1b in Gobiocypris rarus [J]. Comparative Biochemistry and Physiology-Part A: Molecular & Integrative Physiology, 2012, 162(4): 303—309
[11] Xia W, Zhou L, Yao B, et al. Differential and spermatogenic cell-specific expressionof DMRT1 during sex reversal in protogynous hermaphroditic groupers [J]. Molecular and Cellular Endocrinology, 2007, 263(1): 156—172
[12] Winkler C, Hornung U, Kondo M, et al. Developmentally regulated and non-sex-specific expression of autosomal dmrt genes in embryos of the Medaka fish (Oryzias latipes) [J]. Mechanisms of Development, 2004, 121(7): 997—1005
[13] Zhou X, Li Q, Lu H, et al. Fish specific duplication of Dmrt2: Characterization of zebrafish Dmrt2b [J]. Biochimie, 2008, 90(6): 878—887
[14] Meng A, Moore B, Tang H, et al. A Drosophila doublesex-related gene, terra, is involved in somitogenesis in vertebrates [J]. Development, 1999, 126(6): 1259—1268
[15] Liu S, Li Z, Gui J F. Fish-specific duplicated Dmrt2b contributes to a divergent fun-ction through Hedgehog pathway and maintains left-right asymmetry establishment f-unction [J]. PLoS One, 2009, 4(9): e7261
[16] Yamaguchi A, Lee K H, Fujimoto H, et al. Expression of the DMRT gene and its roles in early gonadal development of the Japanese pufferfish Takifugu rubripes [J]. Comparative Biochemistry and Physiology Part D: Genomics and Proteomics, 2006, 1(1): 59—68
[17] Li Q, Zhou X, Guo Y, et al. Nuclear localization, DNA binding and restricted expression in neural and germ cells of zebrafish Dmrt3 [J]. Biology of the Cell, 2008, 100(8): 453—463
[18] Lu Y, Li Z, Zhu X L, et al, Molecular cloning and characterization of Dmrt3 during xenopus tropicalis embryogenesis [J]. Journal of Zhejiang University (Science Edition), 2012, 39(5): 564—570 [陆怡, 李政, 朱晓龙, 等.热带爪蟾Dmrt3基因的克隆及在早期胚胎发育中的表达.浙江大学学报 (理学版), 2012, 39(5): 564—570]
[19] Andersson L S, Larhammar M, Memic F, et al. Mutations in DMRT3 affect locomotion in horses and spinal circuit function in mice [J]. Nature, 2012, 488(7413): 642—646
[20] Balciuniene J, Bardwell V J, Zarkower D. Mice mutant in the DM domain gene Dmrt4 are viable and fertile but have polyovular follicles [J]. Molecular and Cellular Biology, 2006, 26(23): 8984—8991
[21] Huang X, Hong C S, O'Donnell M, et al. The doublesex-related gene, XDmrt4, is required for neurogenesis in the olfactory system [J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(32): 11349—11354
[22] Xu S, Xia W, Zohar Y, et al. Zebrafish dmrta2 regulates the expression of cdkn2c in spermatogenesis in the adult testis [J]. Biology of Reproduction, 2013, 88(1): 1—12
[23] Kim S, Kettlewell J R, Anderson R C, et al. Sexually dimorphic expression of multiple doublesex-related genes in the embryonic mouse gonad [J]. Gene Expression Patterns, 2003, 3(1): 77—82
[24] Matsushita Y, Oshima Y, Nakamura M. Expression of DMRT genes in the gonads of Rana rugosa during sex determination [J]. Zoological Science, 2007, 24(1): 95—99
[25] Brunner B, Hornung U, Shan Z, et al. Genomic organization and expression of the doublesex-related gene cluster in vertebrates and detection of putative regulatory regions for DMRT1 [J]. Genomics, 2001, 77(1): 8—17
[26] Gui J F, Zhou L. Genetic basis and breeding application of clonal diversity and dual reproduction modes in polyploid Carassius auratus gibelio [J]. Science China Life Sciences, 2010, 53(4): 409—415
[27] Ge W, Jiang Y G. The natural gynogenesis of fish [J]. Acta Hydrobiologica Sinica, 1989, 13(3): 274—286 [葛伟, 蒋一珪. 鱼类的天然雌核发育. 水生生物学报, 1989, 13(3): 274—286]
[28] Volff J N, Zarkower D, Bardwell V J, et al. Evolutionary dynamics of the DM domain gene family in metazoans [J]. Journal of Molecular Evolution, 2003, 57(1): S241—S249
[29] Force A, Lynch M, Pickett F B, et al. Preservation of duplicate genes by complementary, degenerative mutations [J]. Genetics, 1999, 151(4): 1531—1545
[30] Kleinjan D A, Bancewicz R M, Gautier P, et al. Subfunctionalization of duplicated zebrafish pax6 genes by cis-regulatory divergence [J]. PLoS Genetics, 2008, 4(2): e29
MOLECULAR CLONING AND EXPRESSION ANALYSIS OF DMRT3 IN GOLDFISH, CARASSIUS AURATUS
WANG Jia and LUO Chen
(Collage of Life Sciences, Zhejiang University, Hangzhou 310058, China)
The DMRT family of transcription factors play a pivotal role in sex determination. In order to investigate the function of Dmrt3, a member of the DMRT family, in the embryogenesis and sex differentiation, as well as its potential implication in breeding of goldfish, we cloned the full length cDNA of Dmrt3 and analyzed its expression during the early embryogenesis and in various adult tissues in goldfish, Carassius auratus. The entire goldfish Dmrt3 cDNA is 2182 bp long, including a 408 bp 5′-UTR, a 427 bp 3′-UTR and a 1347 bp open reading frame (ORF); the latter encoded a protein with 448 amino acids. Protein structural prediction based on the putative amino acid sequence of DMRT3 revealed that goldfish DMRT3 contained a common DM domain and a DMA domain, suggesting that it was more phylogenetically related to DMRT4 and DMRT5. Nested PCR examination indicated that the expression of Dmrt3 was undetectable until bud stage, and its expression obviously increased but still at a low level at 15-somite stage. In adult tissues, DMRT3 was expressed exclusively in the testes. This expression pattern suggested that Dmrt3 might regulate organogenesis and gonad development of male. No methylation of the Dmrt3 promoter CpG-island in gametes and in various tissues was observed using bisulfite sequencing analysis, suggesting that DNA methylation did not regulate the sex-specific and tissue-specific expression of Dmrt3. Moreover, we identified a pseudogene, named pDmrt3, from the reverse transcript of Dmrt3. These results provide essential materials for studying the function of Dmrt3 in the sex differentiation and potential application in breeding of goldfish, as well as the evolutionary relationship of Dmrt genes.
Goldfish; Dmrt3; Gene cloning; Gene expression
Q781
A
1000-3207(2014)03-0548-08
10.7541/2014.77
2013-05-09;
2013-12-20
国家973项目(编号: 2010CB126301); 浙江省科技重大专项(2012C12907-9)资助
王佳(1989—), 男, 陕西渭南人; 硕士; 主要从事发育生物学研究。E-mail: wangjia1019@163.com
罗琛; E-mail: luoc@zju.edu.cn
