上市前限喂对池塘养殖异育银鲫生长及品质的影响
2014-03-29李海燕朱晓鸣韩冬杨云霞金俊琰解绶启
李海燕朱晓鸣韩 冬杨云霞金俊琰解绶启
(1. 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049; 3. 淡水水产健康养殖湖北省协同创新中心, 武汉 430070)
上市前限喂对池塘养殖异育银鲫生长及品质的影响
李海燕1,2朱晓鸣1韩 冬1,3杨云霞1金俊琰1解绶启1
(1. 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049; 3. 淡水水产健康养殖湖北省协同创新中心, 武汉 430070)
实验采用5种投喂水平: 饱食(R100)、80%饱食(R80)、60%饱食(R60)、40%饱食(R40)、饥饿(R0), 旨在探究上市前一个月的池塘养殖中, 采用不同程度限喂的投喂策略对异育银鲫生长和品质的影响。结果表明,当投喂水平小于 60%, 特定生长率(SGR)显著下降, 而屠宰率则表现出相反趋势。饥饿组实验鱼呈现出较瘦体形和较硬的肌肉质地。对可能影响肌肉质地的脂肪含量和胶原蛋白总量分析发现, 随着投喂水平的降低肌肉脂肪含量显著减少但胶原蛋白总量无显著差异。投喂水平的降低导致鱼体各组织脂肪含量的降低, 尤其是内脏脂肪的显著减少。通过SGR与脂肪含量的线性模型, SGR分别解释背肌、腹肌、内脏脂肪含量总变化的56%、66%、71%。在各投喂水平条件下肌肉的粗蛋白含量和必需氨基酸与非必需氨基酸之比维持相对稳定,表明在上市前一个月的池塘养殖中, 限喂的方式并未对肌肉的蛋白营养价值造成不良影响。
异育银鲫; 投喂策略; 限喂; 生长; 品质
随着消费者消费观念由数量型向质量型的转变, 人们对于鱼产品的品质要求越来越高。而投喂策略作为改善调控肉制品品质的有力手段, 在生产实践中得以积极而广泛的应用[1]。在国外某些养殖地区中, 上市屠宰前, 通常对养殖鱼进行禁食处理, 以使其清空肠道并获得更高新鲜度的鱼产品[2]。另一方面, 国内一些渔民通过采取将养成规格的鱼转移至天然水体中, 并停止投喂一段时期(1至 2个月)再将其上市售卖的养殖方法, 从而创立“瘦身鱼”品牌(亦称“吊水鱼”), 并以其优质的品质赢得消费者青睐。
上市前养殖鱼产品品质的调控研究多集中于禁食和降低饲料中脂肪含量的摄入, 通过减少鱼体脂肪的积累从而缓解因脂肪过高而伴随的一些不良品质问题, 如出肉率降低, 质地松软[3,4], 货架寿命减短[5], 腥臭味加重等[6,7]。此外, 通过限喂, 还可减少捕捞时的应激反应, 而应激反应也会对鱼产品品质产生一些负面影响[8,9]。但另一方面, 限喂同时会带来总产量的损失, Einen, et al.发现, 在饥饿后, 大西洋鲑的屠宰率增加, 但增重严重下降[10,11]。
鲫是我国主要淡水养殖品种之一, 近年来年产量高达2百万吨(中国渔业年鉴, 2010)。目前为止, 关于屠宰前限喂对异育银鲫品质的影响国内尚未有报道, 本实验旨在探究上市前一个月不同投喂水平对异育银鲫生长、体型、质地及营养品质的影响, 从而为养殖实践中鱼产品品质的调控提供一定的参考。
1 材料与方法
1.1 实验鱼和养殖系统
实验鱼购自江苏淮安市绿原农业发展有限公司渔场, 运输至实验进行地—湖北石首老河四大家鱼原种场后, 暂养在池塘网箱中(约100尾/每个网箱),暂养持续3周, 每天饱食投喂。
在实验开始前, 实验鱼饥饿24h。从暂养网箱中随机选取表观健康, 大小均匀的异育银鲫, 称重后分配于池塘的另外15个网箱中, 每网箱30尾, 平均初重(174.6±0.5) g。实验期间采用5种投喂水平, 分别为饱食投喂(R100)、饱食投喂水平的80%(R80)、60%(R60)、40%(R40)和完全不投喂(R0), 每处理 3个重复, 饱食组按鱼体体重的 3%—4%进行投喂,并根据天气变化、具体摄食情况调整投喂量。在暂养和实验期间, 除R0组实验期间不投喂, 其余各组每天分别于9:00、15:00和18:00各投喂一次。实验饲料为商品饲料(武汉高龙饲料有限公司, K861),粗蛋白、粗脂肪和灰分干物质含量分别为32.88%、5.32% 和15.07%。每个网箱中均安置有食台以观察实验鱼摄食情况。
网箱规格为2 m×2 m×2 m, 浸入池水的实际高度为1.8 m, 池塘实际水深为2 m, 每2—3天从长江故河—老河引水补充池塘蒸发水量, 以维持池塘水位。池塘中增氧泵每天开启时间为12:00—15:00和24:00—06:00。实验在自然光照下进行(2011.8.30—2011.9.28), 期间平均水温(1 m 水深处)为 22.3℃(17—26.5 ), ℃ 氨氮浓度小于0.5 mg/L, pH 7.2—7.5。
1.2 屠宰和取样
在实验结束后, 实验鱼饥饿 2d, 从每网箱中随机取9尾鱼, 用钝物猛击头部致死, 称重, 量体长后剥去鱼皮。其中 6尾鱼解剖后取肝称重, 并取该 6条鱼的背肌、腹肌及内脏团, 分别保存于–18℃待分析。另3尾鱼, 从每尾鱼左侧肌肉取两块背肌(肉块规格1 cm×1 cm×1 cm)立即用于质构分析, 右侧肌肉相对应部位取肌肉样于–80℃条件下保存用于总胶原蛋白分析。
1.3 分析方法
质构分析 背肌取样部位见图1。所用质构仪型号为TA1XT2i/25(Stable Micro System, Surrey, UK), 选择测压元件为30 kg压力, 直径36 mm的平底圆柱形探头。测量方法参考柳明等[13]。测量采用两次下压的TPA模式, 探头以1 mm/s速度下压至60%鱼肉高度, 达到最大压力。在测量过程中, 待测样品置于冰上保存。

图1 质构仪分析背肌取样部分部位Fig. 1 Sites for the sampling of dorsal muscle texture analyses
生化组成分析 鱼体组成成分的相关分析采用AOAC的方法[14]: 干物质于105℃烘干至恒重后失重法测定; 粗蛋白(N×6.25)采用 FOSS定氮仪(2003, Kjeltec Analyzer Unit, Sweden)测定; 粗脂肪采用索氏抽提仪(Soxtec system HT6, Tecator, Hoganas, Sweden)乙醚抽提测定; 灰分于马福炉中550℃焚烧12h后测定。胶原蛋白参考Palka.的测定方法[15],羟脯氨酸换算成总胶原蛋白含量的系数为 11.42[16],并表达为每克肌肉中胶原蛋白的含量。
氨基酸的测定在湖北省农业科学院进行。样品于6 mol/L 盐酸中110℃水解24h后采用日立L-8900自动分析仪(Hitachi High-Technologies, Japan)进行分析。
1.4 数据处理及统计分析
实验数据采用SPSS 13.0 统计软件进行统计分析。数据经一元方差分析(One-way ANOVA)后进行多重比较(Duncan’s multiple range test), 各处理组间的差异显著性水平为0.05 (P<0.05)。采用一元线性回归模型及相关性(Pearson Correlation)分析实验结果间的关系。
2 结果
2.1 生长、饲料利用和生物学参数
由表 1可知, 特定生长率随投喂水平的下降呈下降趋势(P<0.05), 但60%以上的投喂水平, 各组间并无显著差异。不投喂组由于摄食池塘中天然饵料也表现出轻微的生长。SGR与投喂水平呈正相关关系(r=0.872; P<0.000)。相反, 饲料效率则表现出明显增加趋势, 且与投喂水平显著负相关(r= –0.957; P< 0.000)。投喂水平对各处理组鱼体叉尾长无显著影响(P>0.05), 鱼体空壳产量随投喂水平降低而增加(P< 0.05),而肥满度和肝体比均呈显著下降趋势(P<0.05)。
2.2 脂肪分布
从图2可看出, 各处理中脂肪含量均为内脏>腹肌>背肌, 且鱼体背肌、腹肌、内脏团中脂肪均随投喂水平的下降而显著降低(P<0.05)。不投喂组鱼体各组织的脂肪含量均显著低于其他四组。
2.3 生化组成和质构结果
由表 2可知, 当投喂水平下降时, 除脂肪含量显著降低(P<0.05), 蛋白、灰分、干物质均无显著差异(P>0.05), 且各组胶原蛋白总量无显著差异(P> 0.05)。不投喂组鱼体背肌硬度显著高于其他各组(P<0.05), 投喂水平对背肌弹性无显著影响(P>0.05)。

表1 不同投喂水平对异育银鲫生长、饲料利用及生物学参数的影响(平均值±标准误)Tab. 1 Growth, feed utilization and body biometric parameters in gibel carp under different feeding level (mean±SE)

图2 脂肪(% ww)在鱼体不同部位的分布(n=6, 平均值±标准误) Fig. 2 Lipid deposition (% ww) in different body parts of gibel carp at different ration size (n=6, mean±SE)
由表 3可知, 投喂水平对氨基酸总量(Total amino-acid, TAA)、必需氨基酸(Essential amino-acid, EAA)及非必需氨基酸总量(Non-essential amino-acid, NAA)均无显著影响(P>0.05), 但不投喂组显示最低值。R100和R80处理组必需氨基酸与非必需氨基酸比值(EAA/NAA)均为0.75, 另三个处理组均为0.77,各组间无显著差异(P>0.05)。除天冬氨酸和苯丙氨酸随投喂水平的降低显著降低(P<0.05), 其余各组各氨基酸含量无显著差异(P>0.05)。

表2 背肌生化和质构参数 (平均值±标准误)Tab. 2 Biochemical and textural parameters in dorsal muscle of gibel carp, and significance level within treatments (mean±SE)
2.4 生长速率和脂肪沉积的关系
在线性回归模型中(图3), 背肌(r2=0.56, P=0.001)、腹肌(r2=0.66, P<0.000)、内脏(r2=0.71, P<0.001)的脂肪含量均随SGR的增加而显著增加, 尤其内脏团脂肪的增加最为明显。
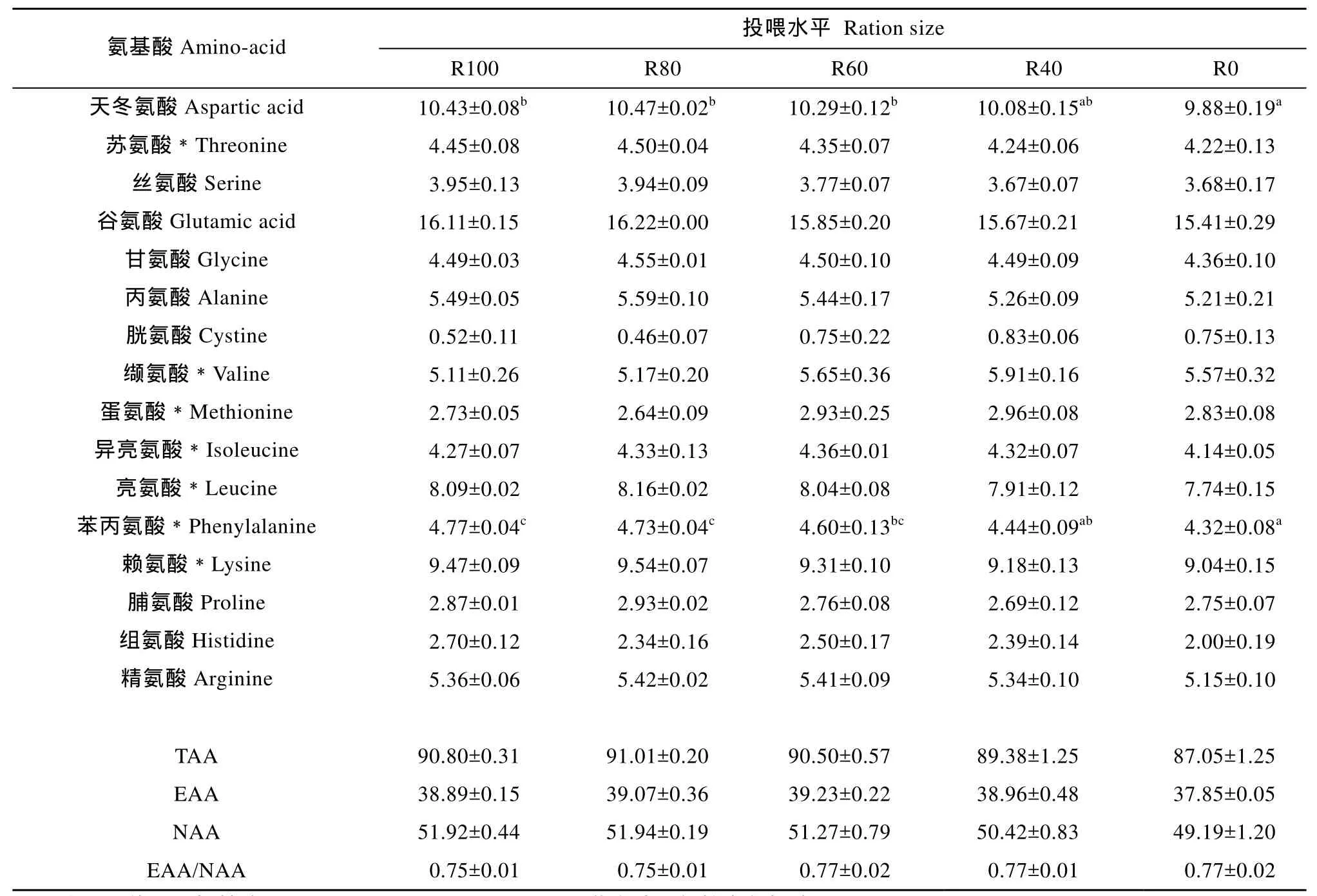
表3 不同投喂水平对异育银鲫肌肉氨基酸组成的影响(平均值±标准误)Tab. 3 Amino-acid composition (g/100 g protein ) in muscle of gibel carp under different feeding level (mean±SE)
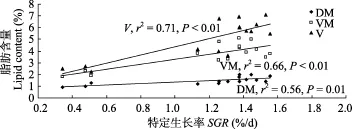
图3 实验鱼不同组织脂肪含量与特定生长率(%/d)间的关系(n=6)Fig. 3 A linear relationship between specific growth rate (%/d) and lipid content in different body parts of gibel carp (n=6)
3 讨论
限喂对鱼体生长的影响取决于鱼的种类、规格、限喂的程度和持续时间以及营养史。Regost, et al.发现褐鳟(Salmo trutta)投喂高脂肪饲料后饥饿 2个月体重显著下降[17], 而Grigorakis 和 Alexis发现3周的禁食对养殖金头鲷(Sparus aurata)生长没有显著影响[18]。在本研究中, 适量的限喂组(R80、R60)与饱食投喂组(R100)的SGR和终末体重接近, 表明投喂水平大于60%的限喂对鱼体的增重没有造成明显损失。与多数实验中完全不投喂处理下鱼体负增长的情况不同, 本实验中未投喂组鱼也表现出一定程度的生长(0.44%/d), 类似于Bosworth 和 Wolters在鲶(Ictalurus punctatus)实验中的情况[19]。同样, 这可归因于实验鱼采食池塘中天然存在的食物(藻类,微生物等)。一般而言, 适量的限喂会增加饲料效率,严重的限喂则会导致饲料效率下降[19]。而在本实验中随投喂水平的降低, 饲料效率稳定上升, 可能是由于低投喂水平下的实验鱼从水体中摄取更多的天然食物, 天然食物对鱼体生长的贡献也更大。
在实验结束时, 各投喂水平实验鱼体长无显著差异, 这与Suárez, et al.在金头鲷实验结果一致[20]。Einen, et al.发现大西洋鲑(Salmo salar)饥饿天数少于 30d时体长没有显著变化, 但饥饿天数超过 58d时显著增加[12]。多数研究表明, 在严重限喂的状况下, 肥满度和肝体比降低, 屠宰率增加[10,12]。但Regost, et al.报道限喂对鱼体空壳率无显著影响[17]。不同的研究结果与限喂的程度、持续时间以及鱼体原有能量储存状况密切相关。在本实验中, 当投喂水平为 40%时, 增加的屠宰率和较瘦的体形所带来的利益可能会抵消体重上的损失, 但对于完全不投喂组(R0), 屠宰率的增加未必能补偿鱼体产量上的巨大损失。
各处理异育银鲫的腹肌脂肪含量约为背肌的 3倍左右, 类似于大西洋鲑[11]、金头鲷[21,22]和舌齿鲈(Dicentrarchus labrax)[21]中的背、腹肌脂肪比例。与饱食投喂组鱼体相比, 未投喂组鱼内脏、腹肌和背肌脂肪含量分别减少了63.0%、53.2%和39.0%。这表明在限喂时, 异育银鲫内脏脂肪比肌肉中的脂肪优先利用, 腹肌脂肪比背肌脂肪优先利用。类似地, Lie 和 Huse报道大西洋鲑内脏脂肪显著减少, 而鱼片中的脂肪几乎没有减少[23]。但相反, Wathne报道饥饿时大西洋鲑腹部脂肪减少而脂肪含量却无明显降低[24]。这些不同结果表明了不同种类的鱼在能量代谢机制方面的差异。
虽然本实验中线性回归模型显示(图 3), 背肌(r2=0.56, P=0.001)、腹肌(r2=0.66, P<0.000)、内脏(r2=0.71, P<0.001)的脂肪含量均随SGR的增加而显著增加, 尤其内脏团脂肪的增加最为明显, 但生长较快的鱼含有较高的组织脂肪仅仅是由于鱼体末重的差异, 这与Young, et al.在大西洋鲑实验观察的结果是一致的: 当考虑鱼体大小因素时, SGR与苏格兰(SQC)鱼片中脂肪含量无相关性(r2=0.0198, P= 0.1087)[25]。另一方面, Rasmussen 和 Ostenfeld发现,当生长速率不同而终末体重在相同水平上时, 快速生长导致溪红点鲑(Salvelinus fontinalis) (r2= 0.75, P<0.01)和虹鳟(Oncorhynchus mykiss) (r2=0.68, P<0.01)的体脂含量均显著增加, 但仅与虹鳟鱼片中的脂肪含量显著正相关(r2=0.37, P<0.01)[26]。因此可以看出,生长速率与脂肪沉积的关系取决于鱼体大小、种类以及身体部位的差异。
在不同投喂水平下, 背肌粗蛋白含量保持相对稳定, 分别与Einen, et al.在大西洋鲑[10]和Suárez, et al.在金头鲷[21]中的观察结果一致。与其他鱼类研究中的报道相似, 背肌氨基酸组成显示, 天冬氨酸、谷氨酸、赖氨酸和亮氨酸占多数[27—29], 在本实验中,蛋氨酸、组氨酸和脯氨酸浓度低于其他种类氨基酸。Iwasaki和 Harada研究发现, 沙丁鱼(Sardina melonosticta)的EAA/NAA为0.69, 鲻(Mugil cephalus)为0.71, 鲱(Clupea pallasi)为0.74, 大麻哈鱼为0.75,真鲷(Pagrus major)、鲭(Scomber japonicus)和太平洋比目鱼(Paralichthys olivaceus)为0.77[30]。Jhaveri, et al. 报道了鳕(Gadus morhua)的必需氨基酸与非必需氨基酸的比值则为0.71[31]。Ozyurt 和Polat发现,较之食物充裕的季节, 在食物匮乏的季节, 舌齿鲈鱼片中的EAA/NAA并未受到显著影响[27]。相似地,在本研究中, 蛋白含量相对稳定且各投喂水平下EAA/NAA无显著差异, 表明在池塘养殖中, 一个月的限喂甚至饥饿未对异育银鲫的蛋白质的营养价值造成明显不良影响, 尽管有个别氨基酸含量发生变化, 依然满足人类蛋白营养的需求。
通常, 过量的投喂会导致较软的肌肉质地, 但减少能量摄入时对肌肉质地的影响研究结果却不尽相同。在虹鳟中, Andersen, et al.和Johansson, et al.均观察到饲喂高脂肪含量的饲料会降低肌肉硬度[32,33], Faergemand, et al.的研究却得出两者之间没有必然联系[34]。Regost, et al.在大西洋鲑的研究中也未观察到高脂饲料对鱼肉硬度产生显著影响[17]。当采用不同饲料营养水平和投喂策略联合的方式时, Young, et al.报道饲料油脂水平和投喂水平均不影响大西洋鲑的肌肉硬度[25], 而Johnsen, et al.却发现不管饲喂何种能量水平的饲料, 80%投喂水平下的大西洋鲑较之饱食投喂的大西洋鲑鱼片硬度明显增加[35]。
在本实验中, 不投喂组鱼体肌肉硬度显著增加的主要原因可能在于脂肪含量上的显著差异(r= 0.858, P<0.000), 即肌肉脂肪含量的增加导致鱼肉变软, 在虹鳟[32,33]和长吻[13]中也有类似的报道。但Bjørnevik, et al.和Regost, et al.在大西洋鲑中发现肌肉脂肪对其质地并无显著影响[17,36]。Love指出,对于在一些本身较瘦, 肌肉中很少储存脂肪的鱼类如大菱鲆(Scophthalmus maximus)说, 脂肪含量的小幅增加(2%ww)都可显著影响鱼产品的质量, 而同样的脂肪变化则一般不会影响如鲑鱼这种本身脂肪含量较高种类的鱼的品质特性[37]。考虑到异育银鲫本身作为一种脂肪含量较少的鱼类, 脂肪含量的变化可能对其质地有较明显的影响。同时, 脂肪含量的减少会导致异育银鲫肌间刺含量的相对增加, 肌间刺的存在可能是本文中所测肌肉质地的硬度值明显高于文献中所报道的一些海水鱼类如鲑、鲈等肌肉硬度的主要原因。
在本实验中, 肌肉的硬度与总胶原蛋白显著正相关(r=0.601, P=0.018), 与Hagen, et al.研究一致[38]。但各处理组总胶原蛋白含量并无显著差异, 因此不能解释肌肉硬度的变化。根据其他的一些进一步的研究, 在胶原蛋白中, 不溶性部分以及交联程度与肌肉的硬度正相关, 而当可溶性部分含量较高时,肌肉硬度反而下降[35,36,38]。Johnsen, et al.报道成熟胶原蛋白的羟基赖氨酰吡啶啉(PYD)的浓度是决定肌肉硬度的首要因素[35]。由于本实验中并未测量PYD, 因此, 限喂对异育银鲫的胶原蛋白交联程度极其对肌肉质地的影响并不清楚。
此外, 肌纤维的数量和直径、肌肉pH等因素也可能会影响肌肉的质地特性。如Johnston, et al.认为,大鱼具有较大的肌纤维直径和较小的肌纤维密度,所以肌肉硬度较小[39]。在大西洋鲑中的研究发现, pH的升高对鱼肉质地的硬度有显著的贡献[11,17,36], Ginés, et al.在金头鲷的研究中也认为较低的pH是引起肌肉质地软化的一个重要因素[2]。因此, 对肌肉质地变化的原因有待于深入的研究。
综上所述, 在池塘养殖环境中, 适度的限喂(80%和 60%)可得到与饱食投喂方式下(100%)生长及品质相似的异育银鲫, 并且同时可节约 20%—40%的饲料投喂量。即使对于 40%限喂的异育银鲫, 虽然生长减少了 13.7%, 但显著增高的饲料转化效率以及一些改善的品质特征或可补偿其产量的损失。一个月的完全饥饿使得异育银鲫肌肉硬度显著增加,蛋白质质量未有显著下降, 但考虑到产量的巨大损失, 完全饥饿的方式可能未必有利于生产者的盈利最大化。何种口感和质地的鱼肉将为消费者所喜好也是一个需要权衡的问题, 需要在以后的研究中增加人工品尝实验并与仪器测量结果做比较。此外,有必要引入更多的评价指标如系水力、肌纤维的组织学特性、PYD浓度等以丰富品质评价内涵并进一步了解影响肌肉质地的因素。
致谢:
感谢本实验室高级技师聂光汉先生在实验系统维护方面的大力帮助。
[1] Andersen H J, Oksbjerg N, Young J F, et al. Feeding and meat quality - a future approach [J]. Meat Science, 2005, 70(3): 543—554
[2] Ginés R, Palicio M, Zamorano M J, et al. Starvation before slaughtering as a tool to keep freshness attributes in gilthead sea bream (Sparus aurata) [J]. Aquaculture International, 2002, 10(5): 379—389
[3] Thakur D P, Morioka K, Itoh Y, et al. Influence of muscle biochemical constituents on the meat texture of cultured yellowtail (Seriola quinqueradiata) at different anatomical locations [J]. Journal of the Science of Food and Agriculture, 2002, 82(13): 1541—1550
[4] Thakur D P, Morioka K, Itoh Y, et al. Lipid composition and deposition of cultured yellowtail Seriola quinqueradiata muscle at different anatomical locations in relation to meat texture [J]. Fisheries Science, 2003, 69(3): 487—494
[5] Lefèvre F, Bugeon J, Auperin B, et al. Rearing oxygen level and slaughter stress effects on rainbow trout flesh quality [J]. Aquaculture, 2008, 284(1—4): 81—89
[6] Grigorakis K, Taylor K D A, Alexis M N . Organoleptic and volatile aroma compounds comparison of wild and cultured gilthead sea bream (Sparus aurata): sensory differences and possible chemical basis [J]. Aquaculture, 2003, 225(1-4): 109—119
[7] Grigorakis K, Alexis M, Gialamas I, et al. Sensory, microbiological, and chemical spoilage of cultured common sea bass (Dicentrarchus labrax) stored in ice: a seasonal differentiation [J]. European Food Research and Technology, 2004, 219(6): 584—587
[8] Mørkøre T, Mazo P I, Tahirovic V, et al. Impact of starvation and handling stress on rigor development and quality of Atlantic salmon (Salmon salar L.) [J]. Aquaculture, 2008, 277(3—4): 231—238
[9] Poli B M, Parisi G, Scappini F, et al. Fish welfare and quality as affected by pre-slaughter and slaughter management [J]. Aquaculture International, 2005, 13(1-2): 29—49
[10] Einen O, Mørkøre T, Rora A M B, et al. Feed ration prior to slaughter—a potential tool for managing product quality of Atlantic salmon (Salmo salar) [J]. Aquaculture, 1999, 178(1—2): 149—169
[11] Einen O, Thomassen M S. Starvation prior to slaughter in Atlantic salmon (Salmo salar) II. White muscle composition and evaluation of freshness, texture and colour characteristics in raw and cooked fillets [J]. Aquaculture, 1998, 169(1—2): 37—53
[12] Einen O, Waagan B, Thomassen M S. Starvation prior to slaughter in Atlantic salmon (Salmo salar) - I. Effects on weight loss, body shape, slaughter- and fillet-yield, proximate and fatty acid composition [J]. Aquaculture, 1998,166(1—2): 85—104
[13] Liu M, Lei W, Zhu X M, et al. Effects of diet formulation on the growth performance and quality of tank reared Chinese Longsnout catfish (Leiocassis longirostris Günther) [J]. Acta Hydrobiologica Sinica, 2010, 34(3): 598—610 [柳明, 雷武,朱晓鸣, 等. 不同饲料营养对池塘养殖长吻 生长性能和鱼肉品质的影响. 水生生物学报, 2010, 34(3): 598—610]
[14] AOAC. Offcial Methods of Analysis [A], 14th edn. Washington D C: Association of Official Analytical Chemists. 1984, 152—163
[15] Palka, K. Changes in intramuscular connective tissue and collagen solubility of bovine M. semitendinosus during retorting [J]. Meat Science, 1999, 53(3): 189—194
[16] Sato K, Yoshinaka R, Sato M, et al. Biochemicalcharacterization of collagen in myocommata and endomysium fractions of carp and spotted mackerel muscle [J]. Journal of Food Science, 1989, 54(6): 1511—1514
[17] Regost C, Arzel J, Cardinal M, et al. Fat deposition and flesh quality in seawater reared, triploid brown trout (Salmo trutta) as affected by dietary fat levels and starvation [J]. Aquaculture, 2001, 193(3—4): 325—345
[18] Grigorakis K, Alexis M N. Effects of fasting on the meat quality and fat deposition of commercial-size farmed gilthead sea bream (Sparus aurata L.) fed different dietary regimes [J]. Aquaculture Nutrition, 2005, 11(5): 341—344
[19] Bosworth B G, Wolters W. Effects of short-term feed restriction on production, processing and body shape traits in market-weight channel catfish, Ictalurus punctatus (Rafinesque) [J]. Aquaculture Research, 2005, 36(4): 344—351
[20] Suárez M D, Martinez T F, Saez M I, et al. Effects of dietary restriction on post-mortem changes in white muscle of sea bream (Sparus aurata) [J]. Aquaculture, 2010, 307(1—2): 49—55
[21] Testi S, Bonaldo A, Gatta P P, et al. Nutritional traits of dorsal and ventral fillets from three farmed fish species [J]. Food Chemistry, 2006, 98(1): 104—111
[22] Mnari A, Bouhlel I, Chraief I, et al. Fatty acids in muscles and liver of Tunisian wild and farmed gilthead sea bream, Sparus aurata [J]. Food Chemistry, 2007, 100(4): 1393—1397
[23] Lie Ø, Huse I. The effect of starvation on the composition of Atlantic salmon Salmo salar [P]. Fiskeridirekt. Skrifter. Serie Ernaering, 1992, 5: 11—16
[24] Wathne E. Strategies for directing slaughter quality of farmed Atlantic salmon Salmo salar with emphasis on diet composition and fat deposition [D]. Dr. Scient. Thesis, Agricultural University of Norway, As, Norway, 1995
[25] Young A, Morris P C, Huntingford F A. The effects of diet, feeding regime and catch-up growth on flesh quality attributes of large (1+sea winter) Atlantic salmon, Salmo salar [J]. Aquaculture, 2005, 248(1—4): 59—73
[26] Rasmussen R S, Ostenfeld T H. Effect of growth rate on quality traits and feed utilisation of rainbow trout (Oncorhynchus mykiss) and brook trout (Salvelinus fontinalis) [J]. Aquaculture, 2000, 184(3—4): 327—337
[27] Ozyurt G, Polat A. Amino acid and fatty acid composition of wild sea bass (Dicentrarchus labrax): a seasonal differentiation [J]. European Food Research and Technology, 2006, 222(3—4): 316—320
[28] Zuraini A, Somchit M N, Solihah M H, et al. Fatty acid and amino acid composition of three local Malaysian Channa spp. fish [J]. Food Chemistry, 2006, 97(4): 674—678
[29] Valente L M P, Cornet J, Donnay-Moreno C, et al. Quality differences of gilthead sea bream from distinct production systems in Southern Europe: Intensive, integrated, semiintensive or extensive systems [J]. Food Control, 2011, 22(5): 708—717
[30] Iwasaki M, Harada R. Proximate and amino acid composition of the roe and muscle of selected marine species [J]. Food Science, 1985, 50(6): 1585—1587
[31] Jhaveri S N, Karakoltsidis P A, Montecalvo J, et al. Chemical composition and protein quality of some Southern New England marine species [J]. Food Science, 1984, 49(1): 110—113
[32] Andersen U B, Thomassen M S, Rora A M B. Texture properties of farmed rainbow trout (Oncorhynchus mykiss): Effects of diet, muscle fat content and time of storage on ice [J]. Journal of the Science of Food and Agriculture, 1997, 74(3): 347—353
[33] Johansson L, Kiessling A, Kiessling K H, et al. Effects of altered ration levels on sensory characteristics, lipid content and fatty acid composition of rainbow trout (Oncorhynchus mykiss) [J]. Food Quality and Preference, 2000, 11(3): 247—254
[34] Faergemand J, Ronsholdt B, Alsted N, et al. Fillet texture of rainbow-trout as affected by feeding strategy, slaughtering procedure and storage post-mortem [J]. Water Science and Technology, 1995, 31(10): 225—231
[35] Johnsen C A, Hagen O, Adler M, et al. Effects of feed, feeding regime and growth rate on flesh quality, connective plasma hormones in farmed Atlantic salmon (Salmo salar L.) [J]. Aquaculture, 2011, 318(3—4): 343—354
[36] Bjørnevik M, Espe M, Beattie C, et al. Temporal variation in muscle fibre area, gaping, texture, colour and collagen in triploid and diploid Atlantic salmon (Salmo salar L) [J]. Journal of the Science of Food and Agriculture, 2004, 84(6): 530—540
[37] Love R M. Biochemical dynamics and the quality of fresh and frozen fsh [A]. In: Hall G M (Eds.), Fish Processing Technology [C]. Blackie Academic & Professional, Glasgow. 1992, 1—30
[38] Hagen O, Solberg C, Sirnes E, et al. Biochemical and structural factors contributing to seasonal variation in the texture of farmed atlantic halibut (Hippoglossus hippog-lossus L.) flesh [J]. Journal of Agriculture and Food Chemistry. 2007, 55(14): 5803—5808
[39] Johnston I A, Alderson R, Sandham C, et al. Muscle fibre density in relation to the colour and texture of smoked Atlantic salmon (Salmo salar L.) [J]. Aquaculture, 2000, 189(3—4): 335—349
THE EFFECTS OF PRE-HARVEST RESTRICTED FEEDING ON THE GROWTH AND THE PRODUCT QUALITY TRAITS OF POND-REARED GIBEL CARP (CARASSIUS AURATUS GIBELIO)
LI Hai-Yan1,2, ZHU Xiao-Ming1, HAN Dong1,3, YANG Yun-Xia1, JIN Jun-Yan1and XIE Shou-Qi1
(1. State Key Laboratory of Freshwater Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. Freshwater Aquaculture Collaborative Innovation Center of Hubei Province, Wuhan 430070, China)
One-month growth trial was conducted to investigate the effects of different feeding regimes prior to slaughter on the growth and the product quality of pond-reared gibel carp. Five feeding levels were approached: satiation (R100), 80% of satiation (R80), 60% of satiation (R60), 40% of satiation (R40), and unfed (R0). The results showed that the specific growth rate (SGR) of gibel carp decreased significantly at the feeding level of 60%. In the contrast, an improved gutted yield was observed at R40 and R0. The unfed fish exhibited a leaner body shape and a harder muscle mass compared to the control group. The lipid content and the total collagen content potentially contribute to muscle textural traits. Analysis on these two factors showed that the lipid content of the muscle reduced significantly whereas there was no difference in the total collagen content. The restricted feeding regime resulted in reduced fat contents in different parts of fish body, especially in the visceral. Relationships between SGR and the lipid content were established using a liner regression model, in which SGR accounted 56% for the dorsal muscle lipid, 66% for the ventral muscle lipid, and 71% for the visceral lipid in the total variation. Both the crude protein content and the ratio of essential amino acid to non-essential amino acid were stable in fish at different feeding levels, indicating that the restricted feeding regime did not affect the muscle protein quality in terms of the nutritional value.
Gibel carp; Feeding regime Restricted feeding; Growth; Quality
S965.1
A
1000-3207(2014)03-0525-08
10.7541/2014.74
2013-03-25;
2013-12-13
现代农业产业技术体系建设专项资金 (CARS-46-19); 公益性行业(农业)专项 (201203015, 201003020)资助
李海燕(1986—), 女, 安徽淮南人; 硕士研究生; 研究方向为鱼类生理生态学。E-mail: lhy0610111@163.com
解绶启, E-mail: sqxie@ihb.ac.cn
