光强和氮源对念珠藻胞外多糖分泌的影响
2014-03-29葛红梅周旭萍夏令张德禄胡春香
葛红梅周旭萍夏 令张德禄胡春香
(1. 中国科学院水生生物研究所, 中国科学院藻类生物学重点实验室, 武汉430072; 2. 中国科学院大学, 北京100049; 3. 武汉理工大学生命科学与技术学院, 武汉430070)
光强和氮源对念珠藻胞外多糖分泌的影响
葛红梅1,2周旭萍1,2夏 令1,2张德禄3胡春香1
(1. 中国科学院水生生物研究所, 中国科学院藻类生物学重点实验室, 武汉430072; 2. 中国科学院大学, 北京100049; 3. 武汉理工大学生命科学与技术学院, 武汉430070)
胞外多糖(EPS)是结皮蓝藻形成生物结皮的胶结剂, 为了理解常球状存在的丝状蓝藻——Nostoc胶结沙粒的机理, 探讨了光强[40、80 μE/(m2⋅s)]和氮源(气态氮, 硝态氮)对结皮优势种Nostoc sp.分泌EPS(包括荚膜多糖CPS和释放多糖RPS)的影响规律及其内在机理。结果发现: Nostoc sp.在气态氮和硝态氮下都有相似的快速生长, 但其分泌的RPS、CPS及EPS量, 在硝态氮下均随光强的增加而增加, 在气态氮下却与光强没有关系。相关代谢研究发现, 在硝态氮下细胞内有更高含量的可溶性糖和蔗糖。进一步的相关分析发现, 在两种氮源下, 蔗糖量与RPS量或CPS量间的显著正相关都只发生在80 μE/(m2⋅s)下, 在气态氮中, 两光强下的胞内总糖量都与CPS量显著负相关。以上结果说明, Nostoc sp.在氮源利用和光强适应方面都有明显优势,它即使在快速生长的对数期, 也可同时分泌相当量的 EPS, 这使其在球状藻殖段形成之前胶结沙粒成为可能。由此可推知, Nostoc sp.在贫瘠沙土表面的最初生长过程中, 其胞外的EPS均来自胞内的固碳产物, 在高光强下, 蔗糖很可能是其EPS合成的原料。
胞外多糖; 光强; 氮源; 生物结皮; Nostoc sp.; 蔗糖
蓝藻对干旱、半干旱地区表土的稳定、增肥、保湿, 其他微生物、原生动物、隐花植物的生存乃至维管植物的定植和整个土壤生态系统的演替进化都有重要的、拓殖性作用[1,2]。而它们之所以能够拓殖流沙、繁衍生息并改变环境的一个关键因素是其大量分泌的胞外多糖(Extracellular polysaccharides, EPS)[3—5]。依据 EPS与细胞结合的紧密程度, 其常被分为较紧密包裹在细胞外被上的荚膜多糖(Capsular polysaccharides, CPS)和松散结合易进入环境基质的释放多糖(Releleased polysaccharides, RPS)[6,7]; 分泌量主要受环境中的光、温度、营养等条件的综合影响, 在实验室条件下, 还受藻本身的生长阶段和培养中通气量的影响[6,8,9], 但分泌机理方面的知识还相当匮乏[9,10]。
现已知, 连续光照和较高光强常通过提高碳水化合物的合成增加EPS的产量[11—15], 异型胞固氮蓝藻在结合态氮(NO3-N)丰富时较固氮生长下产生更多的 EPS[9,12], 但强光和结合态氮共同作用的结果是完全相反的, 有的是提高了 RPS产量[12], 有的是降低了RPS产量[14], 而且, 他们很少关注过CPS量的变化。而CPS是EPS中与藻细胞紧密结合的胶鞘部分, 它不仅直接关乎着 EPS总量, 更涉及蓝藻在多种逆境下的生存[16,17]; RPS虽与细胞结合松散,但它是基质间胶结的主要成分[18]。再者, 蔗糖是生物体可长途运输的寡糖, 在蓝藻中也的确发现营养细胞通过蔗糖向异型胞运输碳营养的情况[19], 也有蔗糖向聚合多糖转化的证据[20]。基于此, 我们猜测可溶性糖、蔗糖可能是EPS合成的原料, 或与EPS合成密切相关。而Nostoc是干旱区生物结皮中常见的优势蓝藻, 通过异型胞固氮, 常以球状藻殖段形式分布在结皮表层[21]。因此, 本文研究了在不同光强和氮源条件下, 结皮Nostoc sp.胞内总糖、可溶性糖、蔗糖含量与胞外EPS中CPS和RPS产量间的关系, 旨在了解其 EPS分泌的规律与内在机理, 来进一步了解其胶结沙粒的机制。
1 材料与方法
1.1 藻种及其培养
Nostoc sp. (FACHB 892) 来自中国科学院典型培养物保藏委员会淡水藻种库, 最初分离自腾格里沙漠沙坡头试验站的生物结皮中。对数生长期的Nostoc sp. 转接到含200 mL BG-11[22](利用硝态氮)和 BG-110(BG-11[22]中缺 NaNO3, 利用气态氮)的250 mL的锥形瓶中, 在(25±1)℃单侧连续光照下培养。根据之前预实验的结果, 我们将光照强度设40、80 μE/(m2⋅s), 氮源为硝态氮和气态氮。初始接种叶绿素浓度为1.1 µg/mL。每个处理设3个平行, 为了避免培养条件造成的影响, 全部采用静置培养。每瓶每天摇4次, 每次30s。实验重复3次。
1.2 生物量测定
每隔4天取样, 藻体用蒸馏水清洗3遍, 8000 g离心4min, 真空冷冻干燥后称重。为了减小生长阶段的影响, 取样检测均在对数生长期进行。
1.3 糖类的测定
培养液用于测定培养液中多糖(Released polysaccharides, RPS)的含量[23]; 细胞荚膜多糖(Capsular polysaccharides, CPS)的测定参照Su, et al.[24]的方法并做改进, 称重干藻样品加蒸馏水80℃水浴6h, 离心(3000 g, 15min), 上清液用蒸馏水透析(分子截留量 3500D) 2d, 然后测定糖含量。总胞外多糖(Extracellular polysaccharides, EPS)是RPS和CPS糖含量的总和。细胞内总糖是将提取过CPS后的藻样加入 6 mol/L HCl于 100℃煮沸 30min, 冷却后用6 mol/L NaOH中和至pH 7, 离心(8000 g, 10min)后上清即为细胞内总糖粗提液[25]。可溶性糖是将干藻样品研磨后在蒸馏水中80℃水浴40min, 离心(8000 g, 10min)后上清为可溶性糖粗提液[20]。以上所得的RPS、CPS、总可溶糖、总糖粗提液的定量测定均利用苯酚硫酸法进行[26]。
可溶性糖粗提液用于蔗糖的分析测定。蔗糖的定量测定是取一定量的提取液, 加入 2 mol/L的NaOH, 100℃煮沸 5min, 冷却, 加入 30% HCl和0.1% 间苯二酚, 摇匀, 80℃水浴内反应 10min, 冷却后480 nm下测定其吸光值[27]。
1.4 数据分析
实验数据是 3个平行的平均值, 数据利用one-way ANOVA 进行方差分析, 用 Bivariate Correlations进行相关性分析, 在 SPSS 18.0软件上进行。数值P<0.05为有显著性差异。
2 结果
2.1 光强和氮源对生物量的影响
图1显示, 在两种氮源之间相比, 硝态氮中第4天的生物量已明显增加(P<0.05), 而气态氮下没有什么变化; 到第 8天以后, 两种氮源下的生物量无明显区别(P<0.05)。在光强之间相比, 气态氮下, 光越强生物量增加越快; 而硝态氮下, 光强对生物量无明显影响(P > 0.05)。

图1 不同光强和氮源对念珠藻生物量的影响Fig. 1 Effects of light intensity and nitrogen source on biomass ofNostoc sp.
2.2 光强和氮源对EPS各部分的影响
图2显示在两光强和氮源下Nostoc sp.释放到培养基中的RPS情况。第4天时, 在两种光强下, 氮源对 RPS无明显的影响(P>0.05), 在利用气态氮时,光越强释放得越多(P < 0.05), 而在利用硝态氮时,光强对RPS分泌无明显的影响(P > 0.05); 在第8天时, 40 μE/(m2⋅s)硝态氮下的最高(P<0.05), 其他条件下无区别(P > 0.05); 第12天时, 利用硝态氮时释放的RPS均高于利用气态氮时, 且光越强释放得越多(P<0.05); 而在利用气态氮时, 光强对 RPS分泌无明显的影响(P>0.05)。
如图3所示, 在第 4天时, 80 μE/(m2⋅s)下的Nostoc sp. CPS量明显高于40 μE/(m2⋅s)下的(P<0.01),而氮源对 CPS的量无明显影响(P>0.05); 第8至第12天, 硝态氮下产生的 CPS量明显高于气态氮的,且光越强增加得越多(P<0.05); 在气态氮下, 光强对CPS的分泌无明显的影响(P>0.05)。
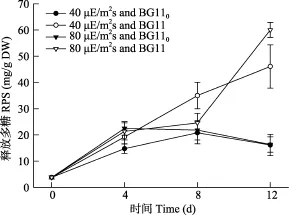
图2 不同光强和氮源对念珠藻RPS含量的影响Fig. 2 Effects of light intensity and nitrogen source on RPS production of Nostoc sp.
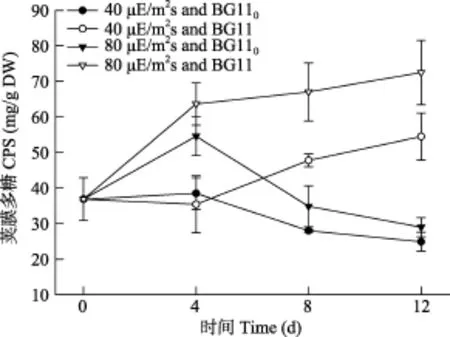
图3 不同光强和氮源对念珠藻CPS含量的影响Fig. 3 Effects of light intensity and nitrogen source on CPS production of Nostoc sp.
从Nostoc sp. EPS的总量来看(图4), 在两光强和氮源下的变化, 除第 8天时略有不同外, 总的规律与CPS的变化相似, 即硝态氮下产生的EPS量明显高于气态氮的, 且光越强增加得越多(P < 0.05);在气态氮下, 光强对EPS的分泌无明显的影响(P > 0.05)。第12天时, 在硝态氮并80 μE/(m2⋅s)培养条件下Nostoc sp. EPS的产量最大(P < 0.01)。
2.3 光强和氮源对细胞内糖含量的影响
由图5可知, 两光强和氮源对细胞内总糖含量都无明显影响(P > 0.05)。
如图6所示, 第4天时, 两个光强和两种氮源下细胞可溶性糖含量都无明显差别(P > 0.05); 第8天时, 80 μE/(m2⋅s)下利用气态氮的可溶性糖含量最低(P < 0.05), 其他条件下无区别(P > 0.05); 第12天时,硝态氮下的可溶性糖含量明显高于气态氮下的(P < 0.05), 但光强对其无明显的影响(P > 0.05)。
与气态氮相比, 硝态氮更能明显促进Nostoc sp.体内蔗糖的合成(图7)。在硝态氮下, 第 4天时, Nostoc sp.在 40 μE/(m2⋅s)下的胞内蔗糖含量已明显高于80 μE/(m2⋅s)下(P < 0.01); 第8至第12天时, 40 μE/(m2⋅s)下与80 μE/(m2⋅s)下无明显区别(P> 0.05)(图7)。而在利用气态氮的情况下, 第4至第8天时,各光强下的胞内蔗糖含量无明显区别(P > 0.05); 直到第12天时, 40 μE/(m2⋅s)下高于80 μE/(m2⋅s)下的(P < 0.05) (图7)。

图4 不同光强和氮源对念珠藻EPS含量的影响Fig. 4 Effects of light intensity and nitrogen source on EPS production of Nostoc sp.
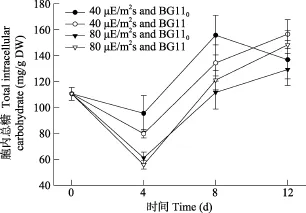
图5 不同光强和氮源对念珠藻细胞内总糖含量的影响Fig. 5 Effects of light intensity and nitrogen source on total intracellular carbohydrate content of Nostoc sp.
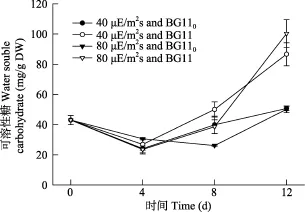
图6 不同光强和氮源对念珠藻可溶性糖含量影响Fig. 6 Effects of light intensity and nitrogen source on soluble sugar content of Nostoc sp.
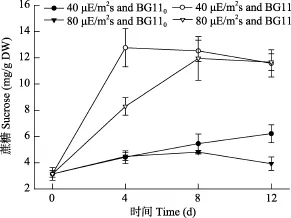
图7 不同光强和氮源对念珠藻蔗糖含量的影响Fig. 7 Effects of light intensity and nitrogen source on sucrose content of Nostoc sp.
将Nostoc sp.胞内蔗糖、可溶性糖、总糖含量分别与其胞外RPS、CPS和总EPS量进行Pearson相关分析, 具有显著相关性的结果如下: 在40 μE/(m2⋅s)光照下, 气态氮中的细胞内总糖量与CPS量显著负相关(P < 0.05), 与EPS 量显著正相关(P<0.05); 硝态氮中的细胞内总糖量与 CPS量显著正相关(P< 0.01)。在80 μE/(m2⋅s)光照下, 气态氮中的细胞内总糖量与 CPS量显著负相关(P < 0.05), 蔗糖量还与RPS量显著正相关(P < 0.01); 硝态氮中的蔗糖量与CPS量显著正相关(P < 0.05)。
3 讨论
3.1 光强和氮源对生长的影响
光照和氮营养供应都是蓝藻光合生长的必需条件, 在适宜的光强和氮浓度范围内, 蓝藻的生长都与光照和氮浓度成正相关[12,14,15]。但蓝藻可以利用多种形态的氮源, 典型的如固氮蓝藻, 它们除了可利用结合态氮生长外, 还可在没有添加氮素的培养基中利用N2固氮生长。但目前的问题是异型胞固氮蓝藻在不同氮源下的生长没有规律性, 研究发现Nostoc PCC 8113在硝态氮下生长好[12], 而在相同培养条件下, 氮源(气态氮, 硝态氮)对Nostoc PCC 7936和Nostoc PCC 7413的生长无明显的影响[12]。在本研究中, 结皮Nostoc sp.在两种氮源下的生长没有区别, 只可能因先要启动固氮作用, 在气态氮下生物量开始增加的时间稍晚于硝态氮下。至于目前报道的Nostoc藻株在不同氮源下生长的差异, 我们认为很可能与它们的异型胞特征及固氮效率有关。由于氮源影响规律的不确定, 相应地, 光强对Nostoc在不同氮源下的生长也没有较一致的模式[12]。在本研究中, 气态氮下表现出有明显影响和硝态氮下没有影响, 很可能是BG11培养基中硝态氮过于丰富,它补偿了气态氮下较低光强的不足, 从而使光强的效果不明显。因此, Nostoc在光和氮源方面的生长特征对我们的大规模培养技术应该有重要的启发。
3.2 光强和氮源对EPS分泌的影响
光强对蓝藻RPS产量的影响, 一般规律是随光强的增加而增加[11—15]。在我们的研究中, Nostoc sp.在硝态氮下, 不论RPS、CPS, 还是EPS总量, 对光强的响应都与以上规律相似。但在气态氮下, 只有第4天80 μE/(m2⋅s)下的RPS、CPS和EPS量高于40 μE/ (m2⋅s), 而8—12d, 光强对它们的量无明显影响。我们认为主要原因在于此时气态氮中的藻细胞将过多的能量用于了生长[28], 而结合态氮中两光强下的生物量相似, 且生长都要慢些。
氮是影响蓝藻EPS合成的重要因素之一, 而且不论氮浓度[29], 还是氮形态都对蓝藻EPS的分泌有重要的影响[9,11,12,29,30]。如虽结合态的硝态氮[Mg(NO3)2、KNO3、NaNO3、NH4NO3]与铵态氮(NH4Cl)对丝状鱼腥藻Anabaena flos-aquae A-37的EPS分泌没有明显影响[30], 但丝状念珠藻Nostoc PCC 8113和Nostoc PCC 7413在高浓度结合态氮(NO3-N)时产生的RPS较气态氮时多[12], 而单细胞固氮蓝藻Cyanothece在有限结合态氮(NO3-N)浓度下分泌的RPS较高浓度结合态氮(NO3-N)下多[29],丝状鱼腥藻Anabaena sp. ATTCC 33047在气态氮时产生的EPS也较结合态氮时多[11]。在本研究中, 无论40 μE/(m2⋅s) 还是80 μE/(m2⋅s)下, 对数阶段的Nostoc sp.产生的RPS、CPS及EPS总量都与Nostoc的一般规律类似, 即在丰富硝态氮下高于气态氮下[9,12]。虽然因为藻株固碳效率和胞内外碳平衡控制力的不同[9,12], 我们还无法将固氮生长条件与氮营养限制条件直接联系起来, 但藻株利用气态氮较直接利用结合氮更耗能是显而易见的。因此, 由于不少能量用于固氮, 向胞外输出的EPS自然就减少了, 这很好理解。相反, 有限的结合态氮促进EPS的分泌[29]很可能是有限的氮已抑制了藻的生长, 造成了胞内有机碳的过剩[9,31]。而Anabaena sp. ATTCC 33047在气态氮下较硝态氮下产生更多EPS, 可能与该藻株在不同氮源下的固碳效率或碳平衡控制力有关, 而且这很可能是蓝藻在不同氮源下EPS分泌量依赖藻株的一个很重要原因[9]。
高光强并高浓度硝氮明显提高了Nostoc中RPS产量[12]。我们发现, 该条件也促进了Nostoc sp.分泌更多的CPS, 同时, EPS总量也得到明显提高。但这与Microcystis aeruginosa中氮限制并低光强[35 μE/(m2⋅s)]使RPS产量最高的结果相反[14]。我们认为, 这种矛盾结果的根本在于, 光强的高低和氮浓度的高低对不同来源藻株来说是不同的, 因为分布在结皮表层的Nostoc sp.对辐射和强光有很强的适应能力[32,33], 因此, 我们建议, 不同藻株间EPS分泌量及其分泌机制的比较研究, 一定要在它们各自适宜的生长条件下进行才有意义。
总之, Nostoc sp.在多种氮源和光强下, 既能保持快速生长, 又能分泌大量EPS, 这说明其对环境的高度适应性。而且对数生长期EPS的分泌特性, 意味着它在球状藻殖段形成之前就已经分泌了大量EPS, 已经初步胶结了沙粒。因此, 尽管我们观察到它呈球形, 但仍有一定的固沙能力[34]。
3.3 细胞内糖含量与EPS含量的关系
一般较高的光强会促进蓝藻胞内碳水化合物的合成[9,12,35]。但在我们的研究中, 光强未影响Nostoc sp.胞内总糖量, 这很可能与该属藻种有较高含量光保护色素及其他适应高光强的特性有关[32,33]。不过,在固氮生长条件下, 细胞内总糖含量与CPS量显著负相关性, 说明在耗能的固氮生长时, 胞外的CPS很可能来自胞内的碳水化合物。在结合态氮下, 40 μE/(m2⋅s)光照时, 细胞内总糖含量与CPS量都成显著正相关关系, 说明在能量输入较低时, 胞内总糖积极参与了EPS的合成; 而在80 μE/(m2⋅s)下, 胞内总糖含量与胞外CPS和RPS量间都没有相关性,说明能量输入过高时, 多种次生代谢增强了, 从而使糖代谢路径多分支, 胞内、胞外糖之间的关联变得不明显了。
可溶性糖是植物体内可直接利用和运输的营养物质和能量, 其含量的高低直接反映着生物体的代谢水平[36]。我们的研究发现, 无论是40 μE/(m2⋅s)还是在80 μE/(m2⋅s)下, Nostoc sp.在硝态氮下的总可溶性糖含量都要高于气态氮下的, 这说明该藻种在结合态氮下的代谢水平较气态氮下高。
蔗糖是光合放氧生物细胞内的重要寡糖[37,38]。它可长途运输, 也可从胞内向胞外的EPS转化[20]。在我们的研究中, 80 μE/(m2⋅s)下, 蔗糖与RPS (N2)和 CPS (NO3-N)存在明显的正相关关系, 这说明在能量输入较高时, 蔗糖很可能积极参与了 EPS中RPS或CPS的合成; 而在40 μE/(m2⋅s)下, 蔗糖含量与两氮源中产生的EPS间都没有显著相关关系, 这说明在能量输入相对较低的情况下, 作为可以合成其他代谢物的蔗糖[20]可能主要用于细胞内物质的合成, 很少参与到胞外代谢, 因而与 EPS间的关系变得不明显。
[1] Belnap J. The potential roles of biological soil crusts in dryland hydrologic cycles [J]. Hydrological Processes, 2006, 20(15): 3159—3178
[2] Lan S B, Wu L, Zhang D L, et al. Effects of drought and salt stresses on man-made cyanobacterial crusts [J]. European Journal of Soil Biology, 2010, 46(6): 381—386
[3] Mager D M, Thomas A D. Extracellular polysaccharides from cyanobacterial soil crusts: A review of their role in dryland soil processes [J]. Journal of Arid Environments, 2011, 75(2): 91—97
[4] Hu C X, Liu Y D, Song L X, et al. Effect of desert soil algae on the stabilization of fine sands [J]. Journal of Applied Phycology, 2002, 14(4): 281—292
[5] Hu C X, Liu Y D, Paulsen B S, et al. Extracellular carbohydrate polymers from five desert soil algae with different cohesion in the stabilization of fine sand grain [J]. Carbohydrate Polymers, 2003, 54(1): 33—42
[6] De Philippis R, Vincenzini M. Exocellular polysaccharides from cyanobacteria and their possible applications [J]. FEMS Microbiology Reviews, 1998, 22(3): 151—175
[7] De Philippis R, Vincenzini M. Outermost polysaccharidic investments of cyanobacteria: Nature, significance and possible applications [J]. Recent Research Developments in Microbiology, 2003, 7(17): 13—22
[8] Xie Z M, Liu X D, Chen L Z, et al. The effects of different cultivation condition on the biomass and exopolysaccharide production [J]. Acta Hydrobiologica Sinica, 2008, 32(2): 272—275 [谢作明, 刘永定, 陈兰洲, 等. 不同培养条件对具鞘微鞘藻生物量和多糖产量的影响. 水生生物学报, 2008, 32(2): 272—275]
[9] Pereira S, Zille A, Micheletti E, et al. Complexity of cyanobacterial exopolysaccharides: Composition, structures, inducing factors and putative genes involved in their biosynthesis and assembly [J]. FEMS Microbiology Reviews,2009, 33(5): 917—941
[10] Jittawuttipoka T, Planchon M, Spalla O, et al. Multidisciplinary evidences that Synechocystis PCC6803 exopolysaccharides operate in cell sedimentation and protection against salt and metal stresses [J]. PLoS ONE, 2013, 8(2): e55564
[11] Moreno J, Vargas M A, Olivares H, et al. Exopolysaccharide production by the cyanobacterium Anabaena sp. ATCC 33047 in batch and continuous culture [J]. Journal of Biotechnology, 1998, 60(3): 175—182
[12] Otero A, Vincenzini M. Extracellular polysaccharide synthesis by Nostoc strains as affected by N source and light intensity [J]. Journal of Biotechnology, 2003, 102(2): 143—152
[13] Yu H F, Jia S R, Dai Y J. Accumulation of exopolysaccharides in liquid suspension culture of Nostoc flagelliforme cells [J]. Applied Biochemistry and Biotechnology, 2010, 160(2): 552—560
[14] Yang Z, Geng L, Wang W, et al. Combined effects of temperature, light intensity, and nitrogen concentration on the growth and polysaccharide content of Microcystis aeruginosa in batch culture [J]. Biochemical Systematics and Ecology, 2012, 41: 130—135
[15] Mota R, Guimaraes R, Büttel Z, et al. Production and characterization of extracellular carbohydrate polymer from Cyanothece sp. CCY 0110 [J]. Carbohydrate Polymers, 2013, 92(2): 1408—1415
[16] Tamaru Y, Takani Y, Yoshida T, et al. Crucial role of extracellular polysaccharides in desiccation and freezing tolerance in the terrestrial cyanobacterium [J]. Applied and Environmental Microbiology, 2005, 71(11): 7327—7333
[17] Rossi F, Potrafka R M, Pichel F G, et al. The role of the exopolysaccharides in enhancing hydraulic conductivity of biological soil crusts [J]. Soil Biology and Biochemistry, 2012, 46: 33—40
[18] Hu C X, Liu Y D, Zhang D L, et al. Cementing mechanism of algal crusts from desert area [J]. Chinese Science Bulletin, 2002, 47(16): 1361—1368
[19] Curatti L, Flores E, Salerno G. Sucrose is involved in the diazotrophic metabolism of the heterocyst-forming cyanobacterium Anabaena sp. [J]. FEBS Letters, 2002, 513(2—3): 175—178
[20] Curatti L, Giarrocco L, Cumino A, et al. Sucrose synthase is involved in the conversion of sucrose to polysaccharides in filamentous nitrogen-fixing cyanobacteria [J]. Planta, 2008, 228(4): 617—625
[21] Hu C X, Zhang D L, Huang Z B, et al. The vertical microdistribution of cyanobacteria and green algae within desert crusts and the development of the algal crusts [J]. Plant and Soil, 2003, 257(1): 97—111
[22] Rippka R, Deruelles J, Waterbury J B, et al. Generic assignments, strain histories and properties of pure cultures of cyanobacteria [J]. Journal of General Microbiology, 1979, 111(1): 1—61
[23] Chen L Z, Li D H, Liu Y D. Salt tolerance of Microcoleus vaginatus Gom., a cyanobacterium isolated from desert algal crust, was enhanced by exogenous carbohydrates [J]. Journal of Arid Environments, 2003, 55(4): 645—656
[24] Su J Y, Jia S R, Chen X F, et al. Morphology, cell growth, and polysaccharide production of Nostoc flagelliforme in liquid suspension culture at different agitation rates [J]. Journal of Applied Phycology, 2008, 20(3): 213—217
[25] Li D H , Xing W, Li G B, et al. Cytochemical changes in the developmental process of Nostoc sphaeroides (cyanobacterium) [J]. Journal of Applied Phycology, 2009, 21(1): 119—125
[26] Li H S. Experiment Principle and Technology of Plant Physiology and Biochemistry (2 rd edition) [M]. Beijing: High Education Press. 2000, 194—197 [李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版. 2000, 194—197]
[27] Tang Z C. Experimental Handbook of Modern Plant Physiology [A]. In: Wang G Q, Xu C H, Wei J M (Eds.), Respiration and Carbohydrate Metabolism [C]. Beijing: Science Press. 1999, 127—128 [汤章城. 现代植物生理性.见: 王国强, 徐春和, 魏家绵. 呼吸和碳水化合物代谢.北京: 科学出版社. 1999, 127—128]
[28] Herms D A, Mattson W J. The dilemma of plants: to grow or defend [J]. Quarterly Review of Biology, 1992, 67(4): 478—478
[29] De Philippis R, Margheri M C, Materassi R, et al. Potential of unicellular cyanobacteria from saline environments as exopolysaccharide producers [J]. Applied and Environmental Microbiology, 1998, 64(3): 1130—1132
[30] Tischer R G, Davis E B. The effect of various nitrogen sources upon the production of extracellular polysaccharide by the blue-green alga Anabaena flos-aquae A-37 [J]. Journal of Experimental Botany, 1971, 22(3): 546—551
[31] Otero A, Vincenzini M. Nostoc (cyanophyceae) goes nude: extracellular polysaccharides serve as a sink for reducing power under unbalanced C/N metabolism [J]. Journal of Phycology, 2004, 40(1): 74—81
[32] Wang G H, Chen K, Chen L Z, et al. The involvement of the antioxidant system in protection of desert cyanobacterium Nostoc sp. against UV-B radiation and the effects of exogenous antioxidants [J]. Ecotoxicology and Environmental Safety, 2008, 69(1): 150—157
[33] Wang G H, Hao Z J, Huang Z B, et al. Raman spectroscopic analysis of a desert cyanobacterium Nostoc sp. in response to UVB radiation [J]. Astrobiology, 2010, 10(8): 783—788
[34] Hu C X, Liu Y D, Song L R, et al. Effect of desert soil algae on the stabilization of fine sands [J]. Journal of Applied Phycology, 2002, 14(4): 281—292
[35] González-Fernández C, Ballesteros M. Linking microalgae and cyanobacteria culture conditions and key-enzymes forcarbohydrate accumulation [J]. Biotechnology Advances, 2012, 30(6): 1655—1661
[36] Kumudini S, Hume D J, Chu G. Genetic improvement in short season soybeans: I. Dry matter accumulation, partitioning, and leaf area duration [J]. Crop Science, 2001, 41(2): 391—398
[37] Salerno G L, Curatti L. Origin of sucrose metabolism in higher plants: when, how and why? [J]. Trends in Plant Science, 2003, 8(2): 63—69
[38] Kolman M, Torres L, Martin M, et al. Sucrose synthase in unicellular cyanobacteria and its relationship with salt and hypoxic stress [J]. Planta, 2012, 235(5): 955—964
EFFECTS OF LIGHT AND NITROGEN SOURCE ON THE SECRETION OF EXTRACELLULAR POLYSACCHARIDES FROM NOSTOC SP.
GE Hong-Mei1,2, ZHOU Xu-Ping1,2, XIA Ling1,2, ZHANG De-Lu3and HU Chun-Xiang1
(1. Key Laboratory of Algal Biology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. Department of Biological Science and Biotechnology, Wuhan University of Technology, Wuhan 430070, China)
Extracellular polysaccharides (EPS) play an essential role in adhesion for crust cyanobacteria to form the biological soil crust. The mechanisms of how the normally ball-shape filamentous cyanobacteria Nostoc sp. cements sand grains remains to be elucidated. To understand the mechanisms we investigated the effects of light intensity and nitrogen source on the the secretion of EPS [including releleased exopolysaccharides (RPS) and capsular polysaccharides (CPS)] in the subtype of Nostoc sp. that dominates the formation of the biological soil crust. We tested two forms of nitrogen source – N2and nitrate, and the light intensities at 40 and 80 μE/(m2·s). The results showed that the biomass of Nostoc sp. in diazotrophic condition was almost the same to that in non-diazotrophic condition. The production of RPS, CPS and EPS in Nostoc sp. was elevated along with the increase in light intensity in nitrate-grown cultures. However, light intensity did not affect the yields of RPS, CPS and EPS in N2-fixing cultures. Studies in Nostoc sp. metabolism showed that the intracellular contents of soluble sugar and sucrose were significantly higher in the presence of nitrate compared to N2. Interestingly a positive correlation between the sucrose content and RPS/CPS production was only observed at the light intensity of 80 μE/m2⋅s, whereas in the N2-fixing cultures, the total contents of intracellular carbohydrate were negatively correlated with CPS production at both tested light intensities. These results suggested that Nostoc sp. had the advantages of utilizing nitrogen and adapting to the light intensity. Although Nostoc sp. in the logarithmic phase displays a rapid growth rate, they are able to secrete a considerable amount of EPS which enables them to cement sand grains before forming the spherical hormogonium. Thus, these results further suggested that, during the early stage of the growth of Nostoc sp. in the poor soil surface, the secreted extracellular EPS may originate from the intracellular products of fixing carbon, and sucrose was probably the source for the EPS biosynthesis under high intensity of light.
Extracellular polysaccharides; Light intensity; Nitrogen source; Biological soil crust; Nostoc sp.; Sucrose
Q142
A
1000-3207(2014)03-0480-07
10.7541/2014.68
2013-03-04;
2013-12-14
国家自然科学基金项目(31170464; 30870470); 国家林业公益性行业科研专项(201404204)资助
葛红梅(1983—), 女, 湖北武汉人; 博士; 研究方向为藻类生理生化学。E-mail: esapir@163.com
胡春香, 女, 研究员, 博士生导师; 研究方向为特殊环境藻类生物学。E-mail: cxhu@ihb.ac.cn
