添加不同益生菌对草鱼养殖水体菌群结构的影响
2014-03-29张小平王一冰邓斌郑佳佳胡彩虹吴学祥李卫芬
张小平王一冰邓 斌郑佳佳胡彩虹吴学祥李卫芬
(1. 浙江大学动物科学学院饲料研究所, 杭州 310058; 2. 贵州大学动物科学学院, 贵阳 550025)
添加不同益生菌对草鱼养殖水体菌群结构的影响
张小平1王一冰1邓 斌1郑佳佳1胡彩虹1吴学祥2李卫芬1
(1. 浙江大学动物科学学院饲料研究所, 杭州 310058; 2. 贵州大学动物科学学院, 贵阳 550025)
为评价添加不同益生菌对草鱼养殖水体菌群结构的影响, 研究采用454焦磷酸测序技术分析其水体菌群结构。结果表明: 添加益生菌后的处理组(枯草芽孢杆菌BS、光合细菌PSB和复合菌CB)其微生物多样性高于对照组(Control)。在门的水平, Control和CB样品中变形菌(Proteobacteria)为优势菌, PSB和BS中变形菌(Proteobacteria)和放线菌(Actinobacteria)所占比例差别不大。与 Control相比, 其他三组中拟杆菌(Bacteroidetes)和放线菌(Actinobacteria)都增加。对变形菌深入分析发现, 在PSB, BS和 CB 样品中, α-变形杆菌为优势菌, 接下来是β-变形杆菌纲、γ-变形杆菌纲和δ-变形杆菌纲。对拟杆菌分析发现, 除对照外, 其他样品中黄杆菌纲(Flavobacteria)为优势菌。在对照和处理组中, β-变形杆菌、α-变形杆菌、γ-变形杆菌和拟杆菌门在目的水平组成也有差异。以上结果表明, 水体中添加益生菌能增加水体菌群多样性, 改变菌群结构。
益生菌; 草鱼; 菌群结构; 454焦磷酸测序
水产养殖业是发展最快的食品产业, 其产量占世界水产动物产量的44%[1], 它提供高质量的动物蛋白, 提升食物营养水平, 并且可在全球范围内提供就业岗位、增加人民收入[2]。作为世界水产大国,我国同时也是世界上唯一水产养殖产量高于捕捞产量的国家, 这主要得益于我国水产养殖集约化程度的不断提高。但是集约化生产在提高经济效益的同时也带来新的问题, 比如, 水产养殖排放的废水中含有氮化合物(氨氮、亚硝酸盐氮和硝酸盐氮)、磷和难溶的有机碳, 这些物质可导致环境恶化[3,4]。同时, 集约化池塘水质的恶化还可增加疾病的发生率,造成水产养殖动物死亡, 导致严重的经济损失[5]。因此, 受污养殖水体治理是目前养殖业的迫切需求,也是实现渔业水体可持续发展的必由之路。
目前, 在水产养殖中水质治理主要包括物理、化学和生物修复等三种方法。与传统或现代的物理、化学修复方法相比, 生物修复技术具有操作简单、高效、费用低, 不会产生二次污染的优点[6—8]。在生物修复技术中, 有益微生物因其生长繁殖快、比面值大、吸收转化快、适应性强以及种类多、分布广等优势被广泛应用[9]。在水产养殖中, 改善水质一般会用到益生菌[10]。微生物之所以可以改善水质, 是由于他们参与水体中物质代谢, 可将有毒的物质转化为无毒害的物质。菌群在水处理中发挥着重要的作用。近年来, 研究者采用一些方法来研究菌群结构, 然而, 这些传统的方法由于其固有的缺陷, 不能完全反应全部菌群信息[8]。新一代测序技术的出现, 可以更全面更准确地描述微生物群落信息[11]。454焦磷酸测序由于其优势目前已被广泛应用[8,12—14]。本文应用454测序技术比较了3种益生菌对草鱼养殖水体菌群结构的影响, 以期为利用微生态制剂调控养殖水质提供依据。
1 材料与方法
1.1 材料
草鱼由浙江绍兴县大畈水产合作社提供; 枯草芽孢杆菌和光合细菌由本实验室分离得到, 复合益生菌由1株具硝化功能和2株具反硝化功能的枯草芽孢杆菌按等比例混合而成。菌株经过发酵、干燥、混合而制成干菌粉, 所用载体为玉米淀粉。菌含量为109cfu/g。
1.2 方法
实验设计 试验在浙江绍兴县大畈水产合作社进行。草鱼用2.5%的食盐水进行浸泡消毒10min,饲养10d后, 选取草鱼228尾, 初始体重约为15 g,随机分为4组, 每组设3个重复, 每个重复19尾鱼:对照组(Control)在水中不添加任何菌, 处理组每隔7天分别向水中添加枯草芽孢杆(BS) 1 × 109cfu/m3、光合细菌(PSB) 1×1011cfu/m3、复合益生菌(CB) 6 × 108cfu/m3, 所有组饲喂相同质量的饲料(表1)。水源为浙江省绍兴县孙端镇大畈河(经纬度: 30°03′38″N, 120°40′52″E)河水。实验鱼在圆形水桶中饲养, 养殖实际水体积为340 L, 氧气泵连续增氧。每天9: 00和17: 00两次投饵, 日投饵量为体重的2%。每天观察鱼的活动情况, 实验时间为15d。
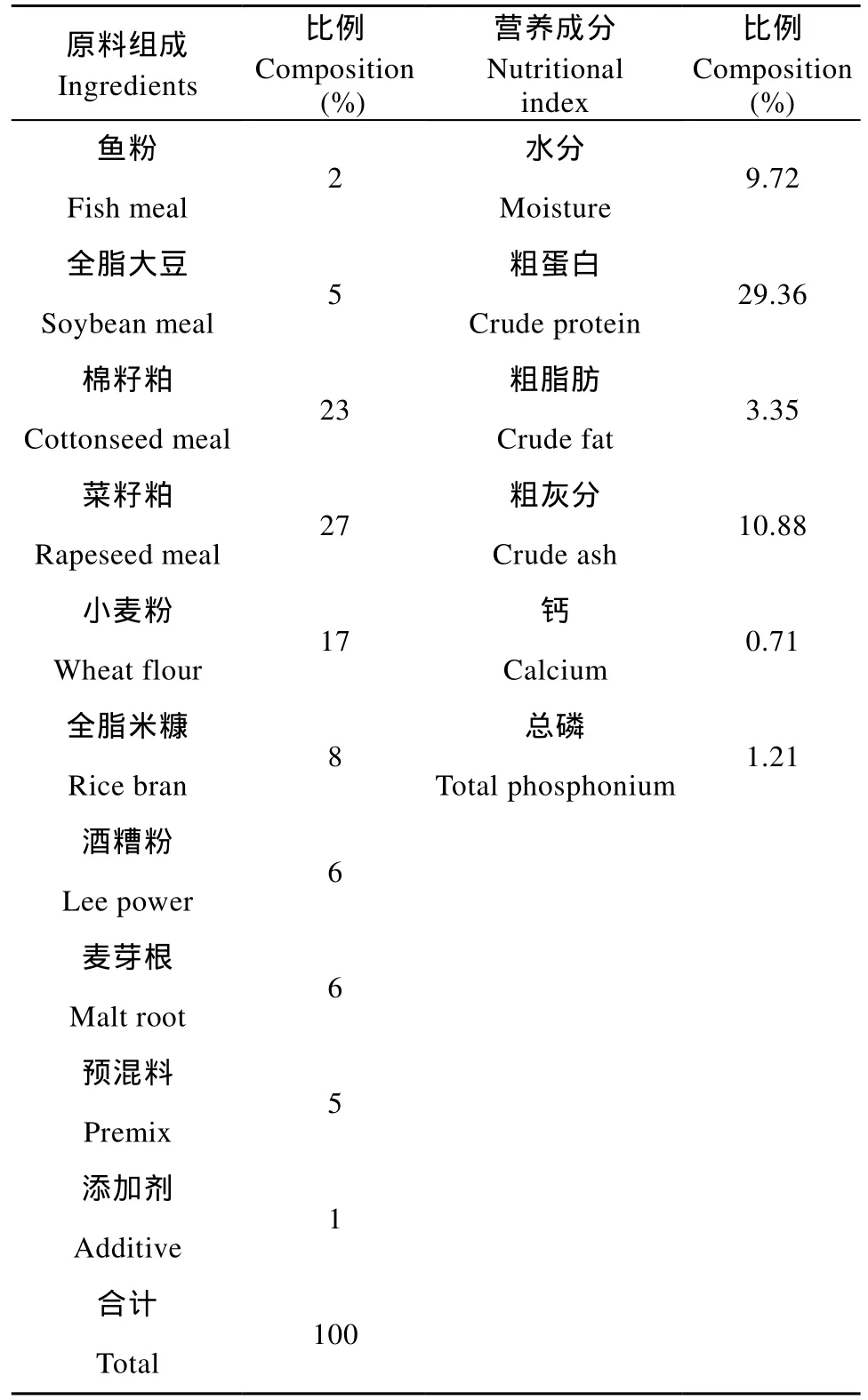
表1 基础饵料的原料组成和营养成分Tab. 1 Ingredients and nutritional composition of the basal diet
取样和 DNA提取 在每个桶的同一位置取养殖水体 100 mL, 每组三个平行水样混合均匀后,经 SARTORIUS(德国赛多利斯)三联微生物滤器0.22 μm过滤, 将含有水样细菌的滤膜保存于–20℃冰箱。DNA提取按照Zhang, et al.[14]的方法进行。
ROCHE454测序 本实验使用16S rDNA的V3区域作为目标DNA序列, 来进行PCR扩增。上游引物: F341 5′-CCTACGGGAGGCAGCAG-3′, 下游引物 R534 5′-TAGATTACCGCGGCTGCT-3′。在上游引物的 5′端加上了一个 8碱基长的标签序列,每种特异的标签序列都对应特异的样品。使用生工货物编号为 SK2701的 2×PCR试剂, PCR buffer 10 μL, 引物(20 μmol/L) 0.8 μL, DNA模板50 ng, 灭菌双蒸水 8.8 μL。PCR反应条件为 94 ℃ 5min, 94 ℃ 40s, 55 ℃ 50s, 72 ℃ 40s, 35个循环, 4 ℃ forever。PCR产物割胶回收, 测定DNA浓度。对于每个样品的PCR产物, 分别取100 ng等量混合, 送至上海同达科信生物技术发展有限公司进行 454 GS FLX Titanium测序。
测序数据分析 所得序列分析方法按照Zhang, et al.[14]进行。将获得的序列通过Mothur软件[15], 去除低质量的DNA序列、Barcode序列和引物序列。去杂后的数据与Sliva数据库[16]比对后, 计算序列之间距离。一个微生物可操作单元(OUT)为序列相似度大于97%的DNA序列。将序列提交至RDP[17]得到每条序列的分类单元, 并利用MEGAN4.7[18]分析软件, 对对照组和处理组的物种分类进行比较。
2 结果
采用454高通量测序技术对水样中微生物 16S rRNA基因的V3区进行了测序, 去掉不合格序列之后, 共获得7830条有效序列。
2.1 菌群多样性
稀疏曲线分析 图1为对照组和处理组的稀疏曲线分析结果, 相同序列数时处理组比对照组的菌群OUTs高, 表明处理组菌群多样性高于对照组。其中BS组多样性最高, 接下来是PSB和CB, 说明在水体中添加益生菌能增加水体菌群多样性, 但不同菌的影响各不相同。
聚类分析 由图5可知 , 在PSB和CB聚集后, 再后BS聚为一类。这说明处理组样品间其细菌群落组成十分相近, 和对照组间有差异。
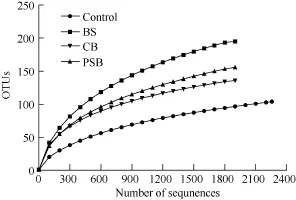
图1 稀疏曲线分析图Fig. 1 Rarefaction results

图2 对照组和处理组样品的聚类分析Fig. 2 The similarity of the control and treatment group samples
2.2 菌群组成
从图3可以看出, 在4个水体样品中菌群组成轮廓相似, 但各菌所占比例有差异。其中control和CB中变形菌(Proteobacteria)为优势菌; PSB和BS中变形菌(Proteobacteria)、拟杆菌(Bacteroidetes)和放线菌(Actinobacteria)所占比例差别不大。与control相比, 其他三组中拟杆菌(Bacteroidetes)和放线菌(Actinobacteria)都增加, 变形杆菌(Proteobacteria)降低。

图3 水体菌群结构(门水平)Fig. 3 Community structure of culture water by phylum level
对变形菌深入分析发现, 在PSB、BS和 CB 样品中, α-变形杆菌为优势菌(48.29%—69.36%), 接下来是β-变形杆菌纲(19.28%—38.43%), γ-变形杆菌纲(5.93%—25.43%), 和δ-变形杆菌纲(0.31%— 4.28%) (图4a); 而在 control中, γ-变形杆菌纲为优势菌(74.43%), 接下来是β-变形杆菌纲(22.42%)、α-变形杆菌纲(2.74%)和δ-变形杆菌纲(0.06%)。拟杆菌分析发现, 在 PSB、BS和 CB 样品中黄杆菌纲(Flavobacteria)为优势菌, control中优势菌为鞘脂杆菌纲(Sphingobacteria)(图4b)。
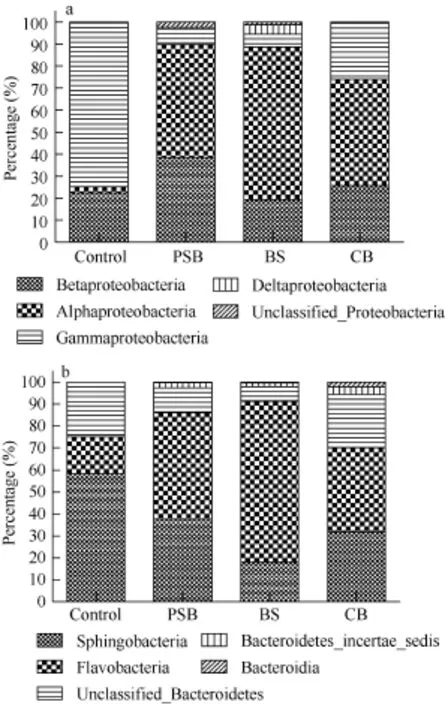
图4 变形菌门(a)和拟杆菌门(b)组成(纲水平)Fig. 4 Proteobacteria (a) and Bacteroidetes (b) composition by class
由图5知, β-变形杆菌、α-变形杆菌、γ-变形杆菌和拟杆菌门在目的水平组成也有差异。对β-变形杆菌分析发现, 对照组 Neisseriales(54.43%)和 Burkholderiales(45.05%)是优势菌, 而 PSB、BS和 CB中都是Burkholderiales为优势菌, 分别占83.58%、94.87%和 97.28%。α-变形杆菌分析发现, 对照组中Rhizobiales为优势菌, 紧接着是 Rhodobacterales (21.28%)、Rhodospirillales(19.15%)和 Rickettsiales (12.77%), 而PSB、BS和CB三组中的优势菌各不相同, 分别为 Rhodospirillales (31.60%)、Sphingo-monadales (28.98%)和Rhizobiales (30.76%)。γ-变形杆菌分析发现, 除 PSB外, 其他三组的优势菌均为Chromatiales, 但所占比例各不相同。拟杆菌中, 对照组的优势菌为 Sphingobacteriales (58.33%), 而PSB、BS和 CB三组均为 Flavobacteriales, 所占比例分别为48.56%、73.29% 和38.52%。
利用Megan 4比较水体菌群, 不同的颜色和饼图大小表该菌在各个样品中所占比例, 结果发现,从门到属的水平 4个样品中各菌相对丰度不同(图6)。由图6可知, 在属的水平上, 有些是四个样品共有的菌(如Agrococcus、 Kinneretia等), 有些是三个处理组共有的菌, (如 Flavobacterium、Phenylobacterium、Polynucleobacter等), 每个样品也有各自特有的菌(如对照组中的 Deinococcus、Virgibacillus和 Pelomonas等, PSB中的 Acidovorax、Alcaligenaceae和 Opitutus等, BS中的 Nakamurella、Jeotgalicoccus和 Roseomonas等, CB中的 Rhizobium、Rubrivivax和Acinetobacter)。
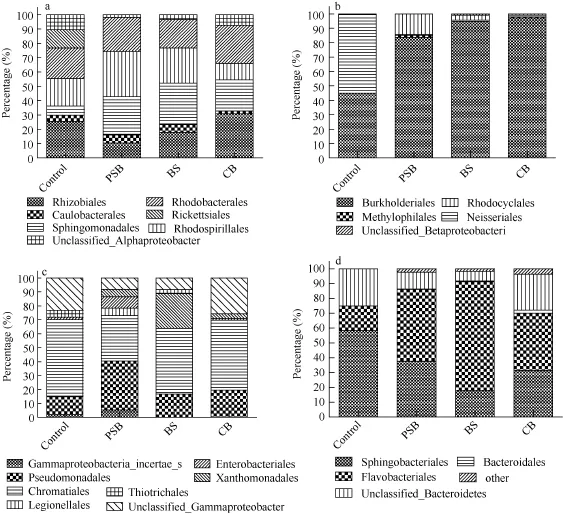
图5 β-变形杆菌(a)、α-变形杆菌(b)、γ-变形杆菌(c)和拟杆菌门(d)组成(目水平)Fig. 5 β-proteobacteria (a), α-proteobacteria (b), γ-proteobacteria (c) and Bacteroidetes (d) composition by order in different samples
3 讨论
水体中微生物的代谢促进了系统中的物质循环和能量流动, 维系着一个系统的正常运转[19]。 李革雷等[20]指出, 有些菌群具有丰富的蛋白酶、淀粉酶、脂肪酶、氧化酶等可以降解不被水生动物或植物利用的大分子有机物, 使其生成二氧化碳、水及其他小分子的物质; 有些细菌可以改善养殖水质, 维护有利于水生动物, 尤其是鱼虾的生长的良好环境;细菌可以产生某种次生代谢产物从而抑制有害细菌和藻类的生长繁殖; 细菌还可以作为生产者将可溶性有机物转化成菌体蛋白, 从而直接或间接地给水生动物提供营养物质在食物链中起重要作用。此外,有研究表明, 水体中的细菌对早期肠道菌群的组成和结构起着决定作用; 淡水鱼和海水鱼肠道中的优势菌分别与淡水和海水水体中的优势菌(好氧和兼性厌氧)类似[21]。因此, 研究养殖水体中的菌群结构具有重要意义。
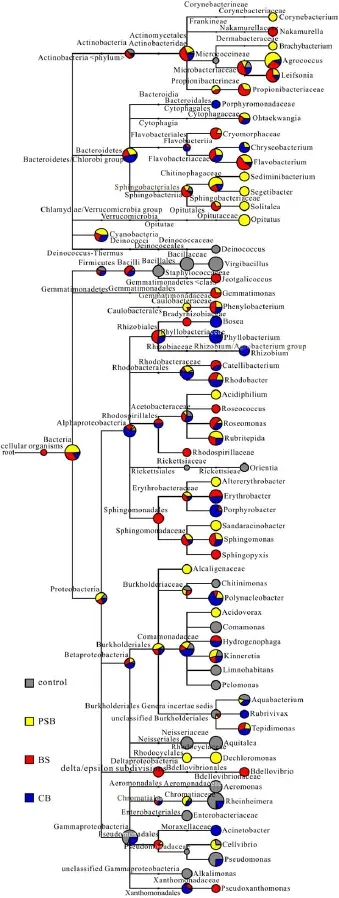
图6 MEGAN 4比较不同样品序列Fig. 6 Sequences from different samples were compared by MEGAN 4
本研究发现, 添加益生菌后可增加水体菌群的多样性, 这与益生菌的抑菌特性和改善养殖水质有关。芽孢杆菌在水中增殖后产生的许多胞外酶能把养殖水体、底泥中的淀粉、蛋白质、脂肪等有机质分解,从而达到维持养殖水生动物消化道微生物的生态平衡、降低养殖水体富营养化、减少病菌滋生和增强水生动物免疫力的效果[22]。Thimmalapura, et al.[23]向虾池中投入了以芽孢杆菌为主的复合微生物制剂, 试验结果表明, 加入益生菌增加了水体沉积物好养菌的数量, 抑制了有害弧菌的数量, 加速了水体中有机物的降解过程, 提高了对虾的产量。李卓佳等[24]分析比较施用芽孢杆菌制剂的虾池和没有施用任何有益菌的虾池在养殖后期不同空间的微生物群落结构的差异。结果表明, 施用了芽孢杆菌的虾池芽孢杆菌在虾池表泥和底泥形成可培养细菌的优势菌属, 表泥和底泥总异养细菌数量增加而水体总异养细菌数量降低, 水体Shannon指数、Simpson指数和McIntosh指数以及底泥 McIntosh指数显著升高。 熊晖等[25]研究发现, 投加光合细菌后, 使得水体中微生物种类达到了自然条件下的2.5倍, 明显增加了种类丰富度,同时加入光合细菌能明显提高水体中微生物的多样性, 且具有持续性。林亮等[26]对施用芽孢杆菌制剂后虾池底泥细菌群落的变化进行了研究, 利用Shannon-Wiener 指数进行生物多样性分析, 发现试验池和对照池底泥细菌的多样性指数、丰度和均匀度在整个养殖过程的动态变相似, 前期较低, 中期、后期和末期都有不同程度的升高。
本研究结果表明, 在添加益生菌后, 水体菌群结构发生改变。林亮等[26]对施用芽孢杆菌制剂后虾池底泥细菌群落的变化进行了研究。结果表明, 芽孢杆菌制剂改变了虾池底泥细菌类群组成, 增加了底泥好氧细菌的数量; 与对照池相比, 试验池的优势菌属发生了变化黄杆菌属 (Flavobacterium)和黏纤维菌属 (Cytophaga)数量增加, 而弧菌 (Vibrio)和发光细菌(Photobacterium)数量相对减少, 且对虾的成活率、体重和产量提高。赵亮等[27]发现, 在人工半咸水河蟹全封闭育苗系统中加入光合细菌, 异养细菌的类群发生了较大变化, 弧菌数量下降了11.1%, 气单胞菌数量下降了 8.3%, 生物多样性有增加的趋势。本研究还发现, 添加益生菌后养殖水体中变形菌(Proteobacteria)、拟杆菌(Bacteroidetes)和放线菌(Actinobacteria)为优势菌。变形菌属革兰阴性细菌, 是原核生物中最大的分支之一[28—30]。据报道, α- 和 β-变形杆菌和脱氮有关[31,32]。 放线菌可降解有机化合物, 并参与物质循环[33], 拟杆菌一直是废水处理系统中的最优势类群[34], 在复杂生物大分子和腐殖质降解中发挥着重要作用[35,36]。放线菌能够产生种类繁多的抗生素、维生素和酶, 它的生长能改善水体的味道并对水体有消毒作用, 对病原微生物有抑制作用, 特别是能够抑制腐败菌的生长繁殖, 转化氮、磷等元素的功能[37], 还起着一些无法定义的生态作用[38]。由此可见, 在水体中添加益生菌改变菌群结构有益于改善养殖水质。
[1] FAO. Biotechnologies for Agricultural Development: Proceedings of the FAO international technical conference on “Agricultural Biotechnologies in Developing Countries: options and opportunities in crops, forestry, livestock, fisheries and agro-industry to face the challenges of food insecurity and climate change” (ABDC-10), FAO, Rome. 2011
[2] FAO. The state of world fisheries and aquaculture. FAO, Rome. 2010
[3] Zhang Q H, Feng Y H, Wang J, et al. Study on the charac-teristics of the ammonia-nitrogen and residual feeds degrada-tion in aquatic water by Bacillus licheniformis [J]. Acta Hydrobiologica Sinica, 2011, 35(3): 498—503 [张庆华,封永辉, 王娟, 等. 地衣芽孢杆菌对养殖水体氨氮、残饵降解特性研究. 水生生物学报, 2011, 35(3): 498—503]
[4] Zheng J J, Shen T, Fu L Q, et al. Identification and denitrification characteristics of a denitrifer Pseudomonas putida F6 [J]. Acta Hydrobiologica Sinica, 2012, 36(1): 161—167 [郑佳佳, 沈涛, 傅罗琴, 等. 一株硝化反硝化菌的筛选鉴定及反硝化特性研究. 水生生物学报, 2012, 36(1): 161—167]
[5] Bondad-Reantaso M G., Subasinghe R P, Arthur J R, et al. Disease and health management in Asian aquaculture [J]. Veterinary Parasitology, 2005, 132: 249—272
[6] Xiang W Y, Wang X F. Remediation of different aquatic animals and plants on eutrophic water body [J]. Acta Hydrobiologica Sinica, 2012, 36(4): 792—797 [向文英, 王晓菲. 不同水生动植物组合对富营养化水体的净化效应.水生生物学报, 2012, 36(4): 792—797]
[7] Autry A R, Ellis G M. Broremediation: An effective remedial alternative for peltoleum hydrocarbon- contaminated soil [J]. Environmental Progress, 1992, 11(4): 318—323
[8] Hu M, Wang X H, Wen X H, et al. Microbial community structures in different wastewater treatment plants as revealed by 454-pyrosequencing analysis [J]. Bioresource Technology, 2012, 117: 72—79
[9] Li Q S, Wang Y Q. Aquaculture & Microorganisms [M]. Wuhan: Wuhan Press. 2000, 94—107 [李勤生, 王业勤. 水产养殖与微生物. 武汉: 武汉出版社. 2000, 94—107]
[10] Wang Y B, Li J R, Lin J D. Probiotics in aquaculture: Challenges and outlook [J]. Aquaculture, 2008, 281: 1—4
[11] Roesch L F, Fulthorpe R R, Riva A. et al. Pyrosequencing enumerates and contrasts soil microbial diversity [J]. The ISME Journal, 2007, 1(4): 283—290
[12] Wu S G, Tian J Y, Gatesoupe F J, et al. Intestinal microbiota of gibel carp (Carassius auratus gibelio) and its origin as revealed by 454 pyrosequencing [J]. World Journal of Microbiology and Biotechnology, 2013, doi:10.1007/s11274-013-1322-4
[13] Wu S, Wang G, Angert E R, et al. Composition, diversity, and origin of the bacterial community in grass carp intestine [J]. PLoS One, 2012, 7(2): e30440
[14] Zhang X P, Fu L Q, Deng B, et al. Bacillus subtilis SC02 supplementation causes alterations of the microbial diversity in grass carp water [J]. World Journal of Microbiology and Biotechnology, 2013, doi: 10.1007/s11274-013-1327-z
[15] Schloss P D, Westcott S L, Ryabin T, et al. Introducing mothur: Open-source, platform-independent, communitysupported software for describing and comparing microbial communities [J]. Applied and Environmental Microbiolog, 2009, 75: 7537—7541
[16] Pruesse E, Quast C, Knittel K, et al. SILVA: a comprehensive online resource for quality checked and aligned ribosomal RNA sequence data compatible with ARB [J]. Nucleic Acids Research, 2007, 35(21): 7188—7196
[17] Wang Q, Garrity G M, Tiedje J M, et al. Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy [J]. Applied and Environmental Microbiology, 2007, 73(16): 5261—5267
[18] Huson D H, Mitra S, Ruscheweyh H J, et al. Integrative analysis of environmental sequences using MEGAN4 [J]. Genome Research, 2011, 21(9): 1552—1560
[19] Zhou J M, Wu Z X, Zeng L B, et al. Microflora in digestive tract of yellow catfish (Pseudobagrus fulvidraco) and in the water [J]. Journal of Huazhong Agricultural University, 2010, 29(5): 613—617 [周金敏, 吴志新, 曾令兵, 等. 黄颡鱼肠道及养殖水体中菌群的分析. 华中农业大学学报, 2010, 29(5): 613—617]
[20] Li G L, Chen C F, Gao Y, et al. Biodiversity of aquatic microbial communities in three aquacultural systems [J]. Journal of Huazhong Agricultural University, 2012, 31(3): 381—390 [李革雷, 陈昌福, 高宇, 等. 3种养殖模式水体中细菌多样性研究. 华中农业大学学报, 2012, 31(3): 381—390]
[21] Wang W J, Pan B H, Sun D Y, et al. Establishment and its physiological role of aquatic animal intestinal flora [J]. FeedResearch, 2012, 2: 37—39 [王文娟, 潘宝海, 孙冬岩, 等.水产动物肠道菌群的形成及其生理作用. 饲料研究, 2012, 2: 37—39]
[22] Zheng H, Shi Q Q, Shi B H, et al. Comparison of Bacillus sp. on depuration of aquaculture water-body [J]. Journal of Microbiology, 2005, 25(6): 41—44 [郑虹, 施巧琴, 施碧红,等. 芽孢杆菌对养殖水体净化作用的比较研究. 微生物学杂志, 2005, 25(6): 41—44]
[23] Thimmalapura N D, Fatimah M Y, Mohamed S. Changes in bacterial populations and shrimp production in ponds treated with commercial microbial products [J]. Aquaculture, 2002, 206: 245—256
[24] Li Z J, Lin L, Yang Y Y, et al. Influence of Bacillus on the microbial communities in shrimp ponds [J]. Journal of Agro-Environment Science, 2007, 26(3): 1183—1189 [李卓佳, 林亮, 杨莺莺, 等. 芽孢杆菌制剂对虾池环境微生物群落的影响. 农业环境科学学报, 2007, 26(3): 1183—1189]
[25] Xiong H, Liang Y X. Study on the impact of external photosynthetic bacteria on water quality and microbial community of aquaculture water [J]. Hubei Agricultural Sciences, 2011, 50(22): 4682—4685 [熊晖, 梁运祥. 外加光合细菌对养殖水体水质及微生物群落的影响. 湖北农业科学, 2011, 50(22): 4682—4685]
[26] Ling L, Li Z J, Guo Z X, et al. Influence of Bacillus on the bacterial communities in the sediment of shrimp ponds [J]. Chinese Journal of Ecology, 2005, 24(1): 26—29 [林亮, 李卓佳, 郭志勋, 等. 施用芽孢杆菌对虾池底泥细菌群落的影响. 生态学杂志, 2005, 24(1): 26—29]
[27] Zhao L, Sun D X, Chen H L. Effects of photosynthesis bacteria on other bacteria in crab larvae rearing systems [J]. Reservoir Fisheries, 2004, 24(5): 10—13 [赵亮, 孙德祥,陈红玲. 光合细菌对河蟹育苗系统细菌类群的影响. 水利渔业, 2004, 24(5): 10—13]
[28] Stackebrandt E. Unifying phylogeny and phenotypic diversity [A]. In: Balows A, Truper H G, Dworkin M, et al. (Eds.), The Prokaryotes [C]. New York: Springer-Verlag. 1992, 19—47
[29] Stackebrandt E, Murray R G E, Trüper H G. Proteobacteria classis nov., a name for the phylogenetic taxon that includes the “purple bacteria and their relatives” [J]. International Journal of Systematic Bacteriology, 1988, 38(3): 321—325
[30] Zinder S H. Bacterial Diversity [A]. In: Balows A, Duerden B I (Eds.), Topley and Wilson’s Microbiology and Microbial Infections, Vol 2, Systematic Bacteriology [C]. London: Arnold. 1998, 125—147
[31] Labbé N, Laurin V, Juteau P, et al. Microbiological community structure of the biofilm of a methanol-fed, marine denitrifcation system, and identifcation of the methanol-utilizing microorganisms [J]. Microbial Ecology, 2007, 53: 621—630
[32] Shapleigh J P. Oxygen control of nitrogen oxide respiration, focusing on α-proteobacteria [J]. Biochemical Society Transactions, 2011, 39: 179—183
[33] Goodfellow M, Haynes J A. Actinomycetes in marine sediments [A]. In: Oritz-Oritz L, Bojalil L F, Yakoleff V (Eds.), Biological, Biochemical and Biomed Ical Aspects of Actinomycetes Academic [C]. Academic Press, New York, London, 1984, 453—472
[34] Wagner M, Loy A. Bacterial community composition and function in sewage treatment systems [J]. Current Opinion in Biotechnology, 2002, 13(3): 218—227
[35] Kirchman D L. The ecology of Cytophaga-Flavobacteria in aquatic environments [J]. FEMS Microbial Ecology, 2002, 39: 91—100
[36] Hutalle-Schmelzer K M L, Zwirnmann E, Krüger A, et al. Enrichment and cultivation of pelagic bacteria from a humic lake using phenol and humic matter additions [J]. FEMS Microbiology Ecology, 2010, 72: 58—73
[37] Lin Q, Zhu Z H. Beneficial microorganisms: the application of microorganisms in aquaculture [J]. China Fisheries, 2008, 10: 48—49 [林钦, 朱志红. 有益微生物专题之一: 有益微生物菌群在水产养殖中的应用研究. 中国水产, 2008, 10: 48—49]
[38] Jensen P R, Lauro F M. An assessment of actinobacterial diversity in the marine environment [J]. Antonie van Leeuwenhoek, 2008, 94: 51—62
COMPARATIVE ANALYSIS OF MICROBIAL COMMUNITY FROM GRASS CARP CULTURE WATER SUPPLEMENTATION WITH DIFFERENT PROBIOTICS
ZHANG Xiao-Ping1, WANG Yi-Bing1, DENG Bin1, ZHENG Jia-Jia1, HU Cai-Hong1,
WU Xue-Xiang2and LI Wei-Fen1
(1. Institute of Feed Science, College of Animal Science, Zhejiang University, Hangzhou 310058, China; 2. College of Animal Science, Guizhou University, Guiyang 550025, China)
In this study, 454-pyrosequencing technology was employed to investigate the microbial community structure in grass carp culture water with or without different probiotics. The results showed that all three treatments remarkably increased the bacterial diversity compared to the control. In two samples (Control and CB), the dominant phylum was Proteobacteria. However, there was only moderate difference in the content of Proteobacteria and Actinobacteria between sample BS and PSB. Actinobacteria and Bacteroidetes in PSB, BS, and CB were more abundant than those in the control group. The detailed analysis of Proteobacteria showed that in PSB, BS and CB samples, the majority of Proteobacteria consisted of αsubdivision, followed by Betaproteobacteria, Gammaproteobacteria, and Deltaproteobacteria; in the control sample, the dominant subtype was Gammaproteobacteria, followed by Betaproteobacteria, Alphaproteobacteria, and Deltaproteobacteria. For Bacteroidetes, Flavobacteria was the dominant subtype in treated samples but not in the control sample. At the order level we also oberseved a marked difference between the control and the treatment in terms of the composition of Alphaproteobacteria, Betaproteobacteria, Gammaproteobacteria and Bacteroidetes. The results indicated that the addition of different probiotics into water could increase the diversity and alter the structure of a microbial community.
Probiotic; Grass carp; Microbial community structure; 454- Pyrosequencing
S965.1; Q145+.1
A
1000-3207(2014)03-0459-08
10.7541/2014.65
2013-05-07;
2014-02-12
国家重点基础研究发展规划(973)项目(2009CB118705); 公益性行业(农业)科研专项(201203083); 贵州省农业科技攻关“喀斯特山区大鲵模拟生境繁育配套技术研究”项目(黔科合NY字[2010]3053号)资助
张小平(1985—), 男, 湖北枣阳人; 博士研究生; 研究方向为益生菌与健康养殖。E-mail: zhangxiaoping403@gmail.com
李卫芬(1965—), E-mail: wfli@zju.edu.cn
