鄱阳湖的中国水华蓝藻新记录属—气丝藻属
2014-03-29李守淳黄虞功亮李仁辉
李守淳黄 静,虞功亮李仁辉
(1. 江西师范大学生命科学学院, 南昌 330022; 2. 中国科学院水生生物研究所, 武汉 430027)
鄱阳湖的中国水华蓝藻新记录属—气丝藻属
李守淳1黄 静1,2虞功亮2李仁辉2
(1. 江西师范大学生命科学学院, 南昌 330022; 2. 中国科学院水生生物研究所, 武汉 430027)
2012年4月和10月在江西省鄱阳湖进行野外调查时, 发现一种浮游的丝状蓝藻。通过分离纯培养, 获得了6个纯化藻株。根据藻株主要形态学特征及其16S rRNA基因序列与比较, 鄱阳湖这些藻株与老挝的2株Aerosakkonema funiforme较为相近, 其中16S rRNA基因序列的相似度达到98%。鉴于这些藻株不同于颤藻目中其他属的藻株, 因此确定为我国一水华蓝藻新记录属——气丝藻属Aerosakkonema Nanda & Watanabe 2012, 模式种为索状气丝藻Aerosakkonema funiforme Nanda & Watanabe 2012。
气丝藻属; 索状气丝藻; 丝状蓝藻; 水华; 鄱阳湖
近年来, 随着人类活动和社会经济的迅速发展,水环境污染加剧, 湖泊水体富营养化日益严重, 继而引起藻类水华暴发, 已成为典型的生态问题[1]。藻类水华不仅严重污染水体景观, 还会释放出藻毒素和异味物质等严重威胁水体本身及水生生物, 甚至周边生活的动物和人类的健康[2]。迄今已报道有上百种蓝藻可形成水华[3], 其中微囊藻 Microcystis Kützing、鱼腥藻 Anabaena Bory、束丝藻 Aphanizomenon Morren和节球藻Nodularia Mertens为常见的可产生藻毒素的水华种类。由于微囊藻水华发生的范围规模最大, 频率最高, 毒性强, 影响大, 故研究报道最多, 而对其他丝状水华蓝藻较少, 特别是无异形胞分化的颤藻类(Oscillatorialean)研究得更少[2]。
Anagnostidis和Komárek[4]于1988年将颤藻属Oscillatoria Vaucher ex Gomont内具气囊的大部分浮游种类重新划分为一个新属浮丝藻属(Planktothrix)。2002年Suda等[5]根据形态、脂肪酸成分和16S rDNA序列等多种特征将具气囊的浮游性淡水颤藻划分为浮丝藻属(Planktothrix)和拟浮丝藻属 (Planktothricoides)。气丝藻属Aerosakkonema Nanda & Watanabe是Nanda等[6]2012年根据形态、脂肪酸成分、16S rDNA序列及细胞内气囊结构GvpA蛋白质序列等多种特征将其从颤藻属中分离出来的, 并以索状气丝藻Aerosakkonema funiforme Nanda & Watanabe作为模式种的新属。
最近, 在江西省鄱阳湖进行蓝藻水华多样性调查时发现该物种的存在, 为我国水华蓝藻的新记录属种, 也是我国水华蓝藻的新记录属——气丝藻属Aerosakkonema。据此, 本文通过形态和分子生物学研究进一步观察, 描述并首次报道了该物种的中国藻株的分类学特征。
1 材料与方法
1.1 样品的采集
在江西省鄱阳湖的都昌至星子水域, 用25号筛绢制作的浮游生物网(网目64 μm)采集水体表层中的浮游性藻类。采集地环境数据: 水温(20—23)℃,透明度(10—60) cm, pH 7.33—8.17, 溶解氧(3.87—8.96) mg/L。
1.2 藻种分离
采用经典的毛细管分离法[7]: 将巴斯德吸管制作成毛细管(Pasteur Micropipette)在解剖镜下挑取单根藻丝, 使用无菌纯水清洗7—8次, 最后放入含有5 mL CT培养基[8]的试管中培养, 培养温度(25+1)℃,光强25 μE/(m2·s), 光暗周期为12︰12, 3周后便可得到单克隆藻种。纯化后的藻种保存在中国科学院水生生物研究所有害藻类生物学组的藻种库, 编号分别为: CHAB5106、CHAB5107、CHAB5112、CHAB5138、CHAB5170、CHAB5177。
1.3 形态观察和测量
藻丝形态的观察使用Olympus BX51 型光学显微镜, 外接500万像素的数码相机(QIMAGING Micropublish 5.0 RTV)和台式计算机。数码拍照和数据测量通过其附带的图像分析软件Image-pro express 5.1控制和实行。选取50个以上的藻体进行各项数据的测量统计。
1.4 16S rRNA基因序列测定和分子系统分析
藻株培养、细胞富集、藻细胞DNA的提取方法参照王捷的描述[9]。16S rDNA扩增引物为F1和1492[10,11], 均由上海英骏生物技术有限公司合成。PCR反应体系为50 μL, 包含1.5 mmol/L MgCl2; 200 mmol/L dNTP; 10 pmol引物; 1×buffer PCR 缓冲液; 1 U TaqDNA聚合酶(Takara, Japan)。扩增条件为: 94℃预变性3min; 94℃变性30s, 55℃退火30s, 72℃延伸50s, 35个循环; 72℃延伸10min。PCR 扩增产物用1%的琼脂糖凝胶电泳, EB 染色, 在2F-90型暗箱式紫外透射仪下检测。PCR 测序由北京华大基因科技有限公司进行正、反向测序, 将测序得到的序列整理拼接后, 用BioEdit软件对测得的基因序列和GenBank数据库中的基因序列进行多序列对齐排列。运用分子进化遗传分析软件MEGA5.2 中的Kimura2-parameter 模型计算各序列间的距离和序列相似性等等, 采用邻接法(Neighbor-joining method, NJ)构建邻接法关系树, 空位或缺失位点均当作配对删除(Pairwise deletion)处理。使用PHYLIP软件构建最大简约(Maximum parsimony, MP)树, 结合MrMTgui和Modeltest3.7 软件, 估算出数据集最优模型: TrN+I+G。在PAUP4.0 软件中, 利用最优数据模型构建最大似然法(Maximum likelihood, ML)树。采用自举检验(Bootstrap)估计系统树分支节点的置信度, 自展数据集为1000, 以Gloeobacter violaceus PCC 7421为外类群。
1.5 藻胆蛋白的提取及光谱分析
将培养好的藻液以5000 r/min离心15min, 弃上清液, 得到藻体。然后将藻体用蒸馏水洗涤两次, 离心(5000 r/min, 10min)后富集藻体[14]。取少量藻体以蒸馏水作空白, 测藻株的活体吸收光谱; 取较多藻体加入少量10 mmol/L (pH 6.8)的磷酸缓冲液并用细胞破碎仪破碎细胞, 然后–20℃下冷冻 30min, 迅速解冻, 此过程反复 2—3次, 离心(12000 r/min, 20min), 将上清液转至超高速离心机(OptimaTM MAX-XP)中继续离心(80000×g, 1h), 收集上清液[13]。用岛津uv-2550型分光光度计在(400—750 nm)范围内测定藻株的活体吸收光谱及吸收光谱。藻蓝蛋白(PC)、别藻蓝蛋白(APC)和叶绿素a的激发波长分别为620、650和680 nm。
2 结果
2.1 形态学分析
气丝藻属Aerosakkonema Nanda & Watanabe 2012 植物体为单生藻丝或由许多藻丝组成自由漂浮的松散群体。藻丝直或略弯曲, 有时折叠, 蓝绿色或橄榄绿色。横壁收缢, 末端细胞不渐尖细。培养状态下偶尔可见很薄的鞘。内囊体排列不规则。以藻殖段进行繁殖。

图1 鄱阳湖分离的索状气丝藻的形态特征图(图例均为20 μm)Fig. 1 The morphological characterization of Aerosakkonema funiforme strains isolated from Poyang lake, China (All bars representing 20 μm)
分类地位: 蓝藻门(Cyanophyta), 蓝藻纲(Cyanophyceae), 颤藻目(Oscillatoriales), 席藻科(Phormidiaceae)。
索状气丝藻Aerosakkonema funiforme Nanda & Watanabe 2012 (图1) 藻丝单生或多数聚集成松散群体, 自由漂浮。藻丝直或稍微弯曲, 有时折叠,蓝绿色或橄榄绿色, 偶尔可见拧成一束, 横壁收缢,末端不尖细, 钝圆, 无帽状结构, 具透明的薄鞘。细胞盘状, 细胞长(2.1—4.1) µm, 宽(11.2—15.1) µm。气囊小且分散在细胞内, 无伪分枝、不含异形胞和厚壁孢子。以藻殖段进行繁殖。
从细胞大小上看, 本文中的索状气丝藻与Nanda等[6]描述的略小一点, 其他的形态特点均相似。
分布: 江西省鄱阳湖, 老挝Nam Ngum水库。
2.2 分子系统分析
利用上述引物扩增藻株的 16S rRNA基因, 均得到较亮的电泳条带, 进一步测序获得长度为 1444 bp序列。通过 Blast 比对和基于 16S rDNA序列的NJ/MP/ML 系统树的构建, 可看出从鄱阳湖分离的6株藻株同两株老挝的索状气丝藻(A.funiforme Lao26和A. funiforme Lao35 )相似度很高(都达到了98%的相似度), 从而聚集在一起(图2)。
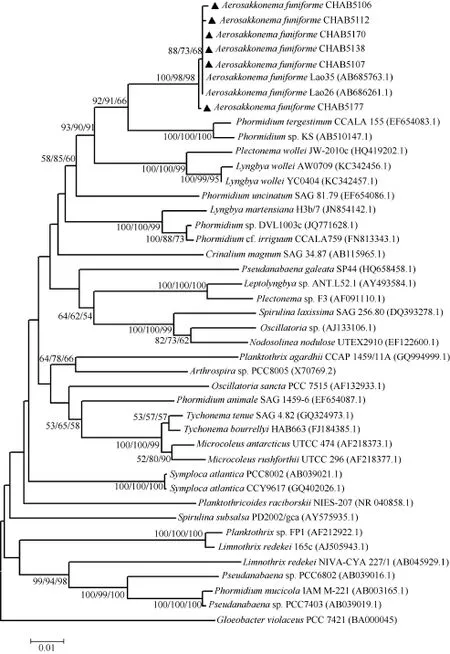
图2 基于16S rRNA基因序列的丝状蓝藻的NJ/MP/ML分子系统树Fig. 2 Phylogenetic tree (NJ/MP/ML) of filamentous cyanobacteria based on 16S rDNA sequences
2.3 藻胆蛋白的光谱分析
索状气丝藻活细胞的吸收光谱如图3所示。可以看出有3个明显的吸收峰, 430 nm和678 nm为叶绿素a的吸收峰, 620 nm为藻蓝蛋白(PC)的吸收峰。而560 nm左右代表藻红蛋白(PE)的吸收峰并没有出现。
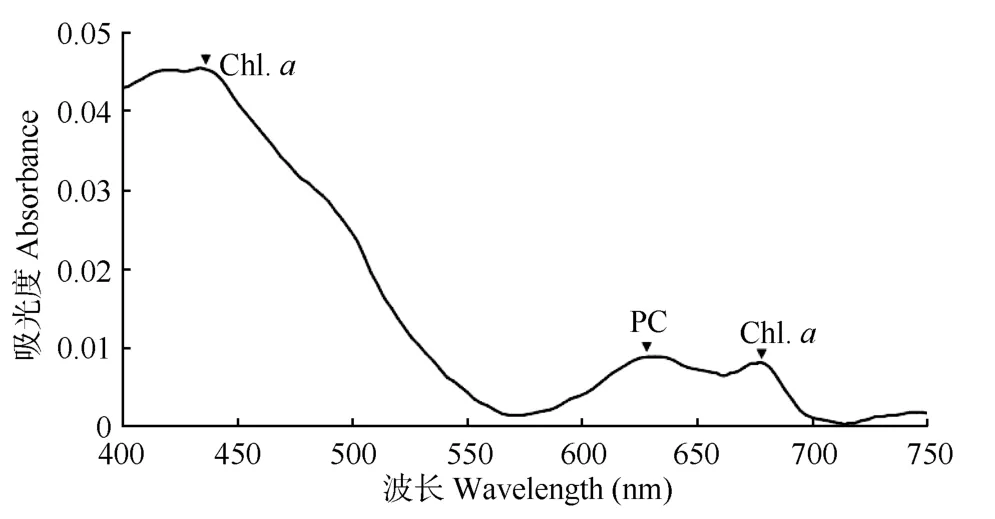
图3 索状气丝藻的活体吸收光谱Fig. 3 In vivo absorption spectrum of Aerosakkonema funiforme.
3 讨论
随着分子生物学的发展, 对非异形胞分化的丝状蓝藻颤藻目(Oscillatoriales)的分类变化和调整很大[4]。典型例子为颤藻属(Oscillatoria)的分类修订调整。Nanda等[6]于2012年从颤藻属中分离并建立了气丝藻属(Aerosakkonema), 其模式种为索状气丝藻Aerosakkonema funiforme, 藻株分离于老挝Nam Ngum水库。Nanda等[6]研究表明, Aerosakkonema的16S rDNA序列与无伪空泡藻株Phormidium sp. KS相似性最高, 为93.8%(相似性低于94.6%即为不同的属[12])。其营养细胞大小, 细胞内类囊体的形状和排列也与Phormidium有明显的差异; Aerosakkonema与有气囊淡水颤藻类藻株, 如Planktothrix, Planktothricoides和Limnothrix在形态方面存在区别, 内囊体不规则排列、营养细胞盘状、细胞更宽、藻株培养时可长达至23 mm, 有时藻丝可拧成一束成绳状,此现象在有气囊淡水颤藻类中首次报道; GvpA蛋白质序列和电镜均显示含有气囊, 其形状排列区别于Planktothrix, Planktothricoides和Limnothrix, 且无藻红蛋白(PE)。
本研究显示, 从形态上, 鄱阳湖分离的藻株营养细胞长(2.1—4.1) µm, 宽(11.2—15.1) µm, 比 Planktothrix的细胞大。吴忠兴等[2]报道Planktothricoides营养细胞长(3—8) µm, 宽(9—16) µm, 藻丝末端渐细, 近顶端略弯。本研究的藻株的细胞大小范围虽与其有重叠, 但末端细胞钝圆, 无帽状结构,存在明显区别; 藻株培养生长后具有明显的鞘, 更接近Lyngbya[4], 与Lyngbya hieronymusii var. hieronymusii[13]相比营养细胞更大, 而与老挝藻株(Lao26和Lao38)相比营养细胞略小, 其他的形态特点均相似。藻胆蛋白吸收光谱显示分离藻株只有藻蓝蛋白(PC)和别藻蓝蛋白(APC), 但Lyngbya hieronymusii var. hieronymusii[13]还含有藻红蛋白(PE), 因此可初步鉴定为索状气丝藻; 16S rDNA的序列比较以及所构成的系统树也表明, 鄱阳湖的气丝藻与A. funiforme Lao26和A. funiforme Lao35聚为一簇(图2)。总之, 通过形态学特征、藻胆蛋白的光谱特征和16S rDNA的序列表明, 鄱阳湖分离到的藻种确定为中国新记录属气丝藻属Aerosakkonema的模式种索状气丝藻Aerosakkonema funiforme。
已知气丝藻属 Aerosakkonema藻种主要分布在亚洲, 可以形成水华[6], 目前Aerosakkonema藻株中尚未监测出微囊藻毒素, Anatoxin-a和PSP等蓝藻毒素, 因而索状气丝藻的毒性还未能确定。根据野外调查结果, 鄱阳湖水体中索状气丝藻在全湖的敞水区域都有分布, 但并未见其水华现象。但由于索状气丝藻的气囊结构使其为潜在的水华蓝藻种类, 随着环境变化及水体富营养化的进程, 索状气丝藻有可能成为我国的蓝藻水华种类的新类群, 因此今后开展对气丝藻属和模式种索状气丝藻生物学、生理学和生态学研究, 将对深入研究我国淡水生态系统中水华蓝藻多样性以及藻类演替和水华发生具有重要意义。
[1] Carmichael W W. Health effects of toxin producing cyanobacteria: “the CyanoHABs” [J]. Human and Ecological Risk Assessment 1, 2001, 7(5): 1393—1407
[2] Wu Z X, Yu B S, Peng X, et al. Planktothricoides, a newly recorded genus of water bloom forming cyanophyta in China [J]. Journal of Wuhan Botanical Research, 2008, 26(5): 461—465 [吴忠兴, 余博识, 彭欣, 等. 中国水华蓝藻的新记录属—拟浮丝藻(Planktothricocides). 武汉植物学研究, 2008, 26(5): 461—465]
[3] Yu B S, Wu Z X, Zhu M L, et al. The formation of cyanobacterial bloom in the Shuiguohu Bay and its effect onDonghu Lake, Wuhan [J]. Acta Hydrobiologica Sinica, 2008, 32(2): 286—289 [余博识, 吴忠兴, 朱梦灵, 等. 水果湖湾蓝藻水华的形成及其对东湖影响的评价. 水生生物学报, 2008, 32(2): 286—289]
[4] Anagnostidis K, Komarek J. Modern approach to the classification system of cyanophytes 3-Oscillatoriales [J]. Algological Studies/Archiv für Hydrobiologie, 1988, (50—53): 327—472
[5] Suda S, Watanabe M M, Otsuka S, et al. Taxonomic revision of water-bloom-forming species of oscillatorioid cyanobacteria [J]. International Journal of Systematic and Evolutionary Microbiology, 2002, 52(Pt5): 1577—1595
[6] Nanda K T, Yuuhiko T, Masaki Y, et al. Aerosakkonema funiforme gen. et sp. nov. (Oscillatoriales), a new gas-vacuolated oscillatorioid cyanobacterium isolated from a mesotrophic reservoir [J]. Phycologia, 2012, 51(6): 672—683
[7] Rippka R. Recognition and identifcation of cyanobacteria [J]. Methods in Enzymology, 1988, 167: 28—67
[8] Kasai F, Kawachi M, Erata M, et al. NIES-Collection list of strains (8th edition) [J]. The Japanese Journal of Phycology (Sôrui), 2009, 57(1): 216
[9] Wang J, Xie S L, Wang Z J, et al. Molecular diversity and microcystin production of Microcystis in Fenhe River of Taiyuan [J]. Journal of Lake Sciences, 2011, 23(4): 505—512 [王捷, 谢树莲, 王中杰, 等. 汾河(太原市景区段)微囊藻的分子多样性及产毒能力. 湖泊科学, 2011, 23(4): 505—512]
[10] Lin S, Wu Z, Yu G, et al. Genetic diversity and molecular phylogeny of Planktothrix (Oscillatoriales, cyanobacteria) strains from China [J]. Harmful Algae, 2010, 9(1): 87—97
[11] Turner S, Pryer K M, Miao V P, et al. Investigating deep phylogenetic relationships among cyanobacteria and plastids by small subunit rRNA sequence analysis [J]. Journal of Eukaryot Microbiology, 1999, 46(4): 327—338
[12] Devereux R, He S, Orkland S, et al. Diversity and origin of Desulfovibrio species: phylogenetic definition of a family [J]. Journal of Bacteriology, 1990, 172(7), 3609—3619
[13] Shoichiro S, Liu Y D, He J W, et al. Morphological, biochemical and physiological characteristics of Lyngbya hieronymusii var. hieronymusii (Oscillatoriales, Cyanobacteria) [J]. Phycological Research, 1998, 46(2): 51—55
[14] Wen S H, Xu C Y, Ju B, et al. Purification and properties of phycobiliprotein in Porphyridium cruentum [J]. Marine Science Bulletin, 2000, 19(3): 90—94 [温少红, 徐春野,鞠宝, 等. 紫球藻藻红蛋白的分离纯化及光谱特性研究. 海洋通报, 2000, 19(3): 90—94]
AEROSAKKONEMA, A NEWLY REPORTED GENUS OF WATER BLOOM FORMING CYANOBACTERIA IN THE POYANG LAKE OF CHINA
LI Shou-Chun1, HUANG Jing1,2, YU Gong-Liang2and LI Ren-Hui2
(1. School of Sciences in Jiangxi Normal University, Nanchang 330022, China; 2. Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430027, China)
During a recent field survey of the water bloom forming cyanobacteria in the Poyang Lake, we collected a type of gas-vacuolated filamentous cyanobacterial. Six strains of this species were isolated and purified after the culture in the lab. The 16S rRNA gene sequence of this species showed a high similarity (98%) with those of two strains from the Nam Ngum Reservoir of Lao People’s Democratic Republic. This result, together with their morphological characteristics, suggested that these six strains were different from other Oscilatorialean cyanobacteria. Therefore this species was identified as Aerosakkonema funiforme that belonged to Aerosakkonema (Nanda & Watanabe 2012). Aerosakkonema is a new record of cyanobacteria genus in China.
Aerosakkonema; Aerosakkonema funiforme; Filamentous cyanobacteria; Water bloom; Poyang Lake
Q949.22
A
1000-3207(2014)06-1071-05
10.7541/2014.157
2013-11-11;
2014-03-07
国家科技重大专项(2012ZX07101-002-001); 鄱阳湖湿地与流域研究教育部重点实验室(江西师范大学)开放基金(PK2014007); 江西省自然科学基金(20132BAB204006)资助
李守淳(1965—), 女, 江西余干人; 博士; 主要从事藻类生物学研究。E-mail: lsc_982@126.com
李仁辉(1965—), 研究员; 主要从事蓝藻分类系统以及藻类环境生物学研究。E-mail: reli@ihb.ac.cn
