NX方案和GX方案治疗蒽环类及紫杉类药物治疗后复发转移乳腺癌的疗效观察
2014-03-29邹德辉屈淑贤
邹德辉屈淑贤
(1 朝阳市建平县红山街道办事处卫生院内科,辽宁 朝阳 122400;2 沈阳军区总医院肿瘤内科,辽宁 沈阳 110016)
NX方案和GX方案治疗蒽环类及紫杉类药物治疗后复发转移乳腺癌的疗效观察
邹德辉1屈淑贤2
(1 朝阳市建平县红山街道办事处卫生院内科,辽宁 朝阳 122400;2 沈阳军区总医院肿瘤内科,辽宁 沈阳 110016)
目的 观察和评价长春瑞滨联合卡培他滨(NX)以及吉西他滨联合卡培他滨(GX)两种方案用于蒽环类及紫杉类药物治疗后复发转移乳腺癌疗效及安全性。方法 NX组20例:长春瑞滨25 mg/m2,第1、8天,卡培他滨2000 mg/m2,分两次口服,第1~14天,每21 d为1个周期,GX方案20例;吉西他滨1000mg/m2,第1、8天,卡培他滨第1~14天,分两次口服,每21 d为1个周期,每2个周期评价疗效,有效及稳定患者至少2~6周期,有进展的患者更换其他方案。结果 40例患者均可评价疗效,NX方案组RR 55 %,中位疾病进展时间(TTP)6.8个月,1年生存率63 %,2年生存率34.1 %,GX方案组有效率50 %,中位疾病进展时间6.4个月,1年生存率61 %,2年生存率33.8 %。NX组与GX两组间有效率、TTP、1年生存率、2年生存率比较无统计学差异(P>0.05),两组间常见不良反应为骨髓抑制、手足综合征、胃肠道反应,骨髓抑制主要为中性粒细胞、血小板减少,其中大多为Ⅰ~Ⅱ级,未发现Ⅳ度毒副反应,两组不良反应比较差异无统计学意义(P>0.05)。结论 NX和GX方案,近期疗效确切,毒性低,两种方案比较,疗效及不良反应相近,都可以作为治疗蒽环类和紫杉类复发转移的乳腺癌的挽救治疗方案,值得临床推广。
复发转移性乳腺癌;长春瑞滨;吉西他滨;卡培他滨
乳腺癌是对女性危害最大的恶性肿瘤,乳腺癌术后辅助治疗近年来有了长足进步,使得乳腺癌复发转移风险下降达30 %~50 %,生存率明显提高,但仍有30 %~40 %的乳腺癌患者会出现复发转移,随着越来越多的患者在术后辅助治疗中使用过了蒽环类和紫杉类,出现复发转移尚无标准方案[1],寻找新的高效低毒且与既往化疗无交叉耐药的新方案成为进一步提高晚期乳腺癌生存的关键。我们对2012年4月至2013年10月入我科的经蒽环类及紫杉类治疗后复发转移的乳腺癌患者,利用长春瑞滨(NX)与吉西他滨联合卡培他滨(GX)两种方案治疗,现报道如下。
1 资料与方法
1.1 一般资料
40例经组织病理学确诊为乳腺癌患者,即往均接受过紫杉类、蒽环类或内分泌治疗并临床判定耐药而进展的患者,包括浸润性导管癌25例,浸润性小叶癌13例,髓样癌2例,人表皮生长因子受体(HER2)基因阳性22例,但因家庭经济原因拒绝曲妥珠单抗靶向治疗,绝经前22例,绝经后18例,年龄33~65岁,中位年龄45岁,所有患者均有CT或MRI可测量病灶,化疗前1个月内未行抗肿瘤治疗,化疗前接受内分泌治疗出现病情进展停止内分泌治疗,化疗前血常规、肝肾功能、心电图检查无化疗禁忌证,体力状态评分比ECOG≤2分,预期生存期>3个月。两组临床资料具有可比性。
1.2 治疗方法
20例NX方案:长春瑞滨25 mg/m2,第1、8天,卡培他滨2000 mg/m2,分两次口服,第1~14天,21 d为1个周期,20例GX方案;吉西他滨1000 mg/m2,分两次口服,第1、8天,卡培他滨第1~14天,每21 d为1个周期,化疗后每周检查血常规、肝肾功能,出现骨髓抑制时,给予升血象等对应治疗,每2个周期评价疗效,有效及稳定患者至少2~6周期,有进展的患者更换其他方案,所有病例门诊或电话随访至2013年5月,无失访病例,无治疗相关死亡,均可评价疗效。
1.3 疗效与不良反应评价标准
根据RECTST实体瘤评价标准,分为完全缓解(CR),部分缓解(PR),稳定(SD),和进展(PD),有效率(RR)=(CR+PR)×100 %,病病控制率=(CR+PR+SD)×100 %,不良反应按WHO抗癌毒副反应评价标准评价。
1.4 统计学处理
采用SPSS13.0软件进行统计学处理,组内采用χ2检测,P<0.05为差异有统计学意义。
2 结 果
2.1 临床疗效
二组完成3个周期化疗者23例,4个周期者12例,6个周期者5例,40例患者2例CR,PR19例,SD9例,PD:10例,总有效率52.5 %,其中NX方案组RR55 %,疾病控制率75 %,中位疾病进展时间(TTP)6.8个月,1年生存率63 %,2年生存率34.1 %,GX方案组有效率50 %,疾病控制率75 %,中位疾病进展时间6.4个月,1年生存率61 %,2年生存率33.8 %。NX组与GX两组间有效率、TTP、1年生存率、2年生存率比较无统计学差异(P>0.05)

表1 NX与GX联合方案治疗乳腺癌比较( %)
2.2 不良反应
两组间常见不良反应为骨髓抑制、手足综合征、胃肠道反应,骨髓抑制主要为中性粒细胞减少,血小板减少,其中大多为Ⅰ~Ⅱ级,未发现Ⅳ度毒副反应,NX组2例、GX组3例出现Ⅱ度血小板减少,延迟化疗,手足综合征发生率较高,NX组9例,GX组8例,但都为Ⅰ~Ⅱ度,在给予大剂量维生素B6后症状缓解,不影响继续化疗,其他反应如消化道反应、脱发等,两组不良反应比较差异无统计学意义(P>0.05)。见表1。
3 讨 论
乳腺癌是女性常见恶性肿瘤,虽然辅助化疗及内分泌治疗可提高乳腺癌生存,但对复发转移的乳腺癌有效率低[2-3],转移性乳腺癌平均生存期18~36个月,选用与蒽环类及紫杉类无交叉耐药的方案对延长患者生存,改善生活质量至关重要[4]。目前以卡培他滨为主的联合用药方案是复发转移乳腺癌的首选药物之一[5-6],卡培他滨单药二线治疗有效率达20.0 %~26.0 %[7],同样以卡培他滨为主的联合用药也取得明显疗效,且联合用药可能优于单药[8-9]。
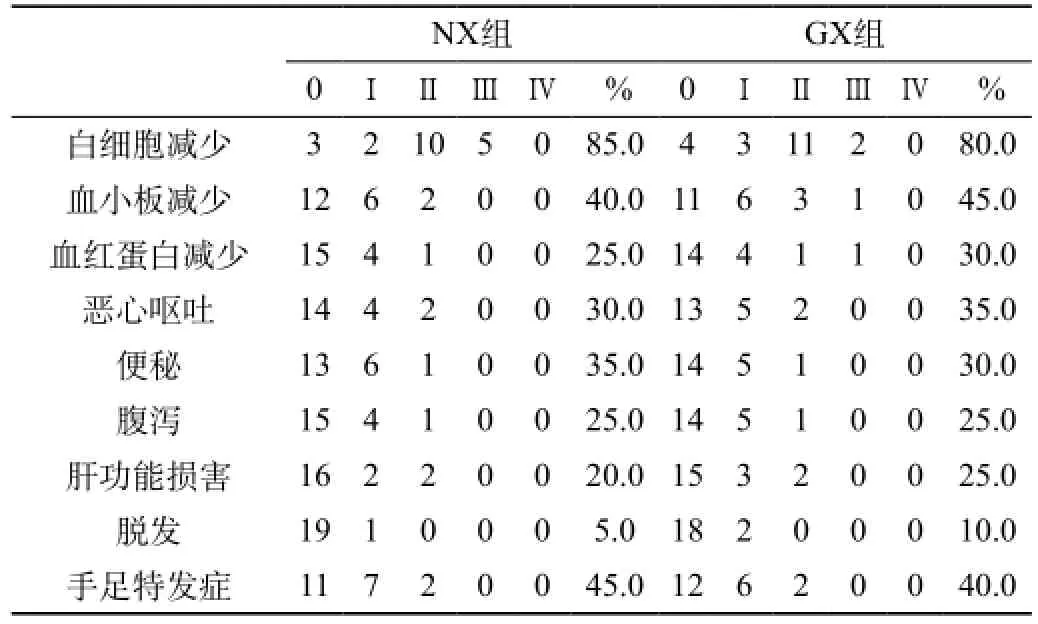
表1 NX与GX方案两组患者不良反应比较
吉西他滨是一种细胞周期特异性代谢药物,主要作用于DNA合成期(S期),也可以阻止肿瘤细胞由G1期进入S期,其被肿瘤细胞摄取后,在细胞内经过核甘激酶的作用转化为具有活性的二磷酸核甘(dFdCDP)及三磷酸核苷(dFdCTP),dFdCDP与dFdCTP可抑制核甘酸还原酶的活性,致使合成DNA所必需的三磷酸脱氧核产生受抑制,还可以竞争性掺入DNA链中,抑制DNA链继续延长,引起细胞程序死亡[10]。长春瑞滨是长春花碱的第三代衍生物,因对微管蛋白较高的亲和力,能阻止微管蛋白聚合形成微管和诱发微管的解聚,使细胞分裂停滞于有些分裂中期,阻止肿瘤细胞复制、增殖[11]。
卡培他滨属于氟脲嘧啶类药物,主要作用是通过三重酶活化反应完成,在肝脏和肿瘤组织内被代谢为有抗肿瘤活性的5-Fu,胸腺嘧啶磷酸化酶(TP)在肿瘤组织中浓度较高,在增殖活性较高的乳腺癌中浓度明显高于正常组织,尤其对化疗不敏感的乏氧区活性更高,所以卡培他滨具有独特抗肿瘤作用,对正常组织毒性较小的高选择性药物,且卡培他滨联合长春瑞滨、吉西他滨等化疗药物,可使肿瘤细胞内的TP活性上调,且具有随剂量增加和时间延长而增强,相互之内有协同作用,增强抗肿瘤疗效[12-13]。单药长春瑞滨治疗有效率在16 %~25 %,单药吉西他滨有效率为18 %~23 %,因此,本研究采用联合方案治疗复发转移性乳腺癌。
本研究比较了NX与GX两种方案用于蒽环类和紫杉类治疗复发转移性乳腺癌疗效及安全性,结果NX组和GX组RR分别为55 %和50 %,两组中位疾病进展时间分别为6.8个月和6.4个月,1年生存率分别为63 %和61 %,2年生存率34.1 %和33.8 %,差异无统计学差异(P>0.05)。两组间常见不良反应为骨髓抑制、手足综合征、胃肠道反应,两组不良反应比较差异无统计学意义(P>0.05)。经过对症治疗后可完成治疗。
综上所述,NX和GX方案,近期疗效确切,毒性低,两种方案比较,疗效及不良反应相近,都可以作为治疗蒽环类和紫杉类复发转移的乳腺癌的挽救治疗方案,值得临床推广。
[1] 王涛,江泽飞,宋三泰,等.单药希罗达治疗复发转移乳腺癌的疗效观察[J].中华肿瘤杂志,2004,26(6):379.
[2] Mansour EG,Gray R,Shatila AH,et al.Survival advantage of adjuvant chemotherapy in high-risk node-negative breast cancer: ten-year analysis-an intergroup study[J].J Clin Oncol,1998,16(11) :3486-3492.
[3] Goldhirsch A,Glick JH,Gelber RD,et al.Meeting highlights: International consensus panel on the treatment of primary breast cancer.Seventh International Conference on Adjuvant Therapy ofPrimary Breast Cancer[J].J Clin Oncol,2001,19(18):3817-3827.
[4] Moreno-Aspitia A,Perez EA.Anthracycline-and/or taxaneresistant breast cancer:results of a literature review to determine the clinical challenges and current treatment trends[J].Clin Ther, 2009,31(8):1619-1640.
[5] Yardley DA.A ctivity of ixabepilone in patients with metastatic breast cancer with primary resistance to taxanes[J].Clin Breast Cancer.2008,8(6):487-492.
[6] Schüller J,Cassidy J,Dumon E,et al.Preferential activation of capecitabine to tum or following oral adm in istration in colorectal cancer patients[J].Cancer Chemother Phamacol,2000, 45(4):291-297.
[7] Fumoleau P,largilier R,Clippe C,et al.Multicentre,phase Ⅱstudy evaluating capecitabine monotherapy in patients with anthracycline and taxane-pretreated matastatic breast cancer[J]. Eur Cancer,2004,40(4):536.
[8] 徐兵河.蒽环类耐药性乳腺癌治疗策略[J].中华肿瘤杂志,2007,29(4):241-244.
[9] Langkjer ST Ejlertsen B,Mouridsen H,et al.Vinorelbine as firstline or second-line therapy for advanced beast cancer:a Phase Ⅰ-Ⅱ trial by the Danish Breast Cancer Co-operative Group[J].Acta Oncol,2008,47(4):735-739.
[10] Wang J,Lohman GJ,Stubbe J,et al.Mechanism of inactivation of human ribonucleotide reductase with p53R2 by gemcitabine 5-diphosphate[J].Biochemistry,2009,48(49):11612-11621.
[11] Potier P.The synthesis of metastaic breast carcinoma after failure of anthracycline and(or) paclitaxed-contaning regimens[J]. Cancer,1998,82(1):134-140.
[12] Wang HQ,Qian ZZ,liu XM,et al.Capecitabine combined with weekly docetaxel in Chinese>65 years with anthracyclineresistant metastatic breast cancer[J].Clin Med J(Engl),2010,123( 22):3212-3216.
[13] Mao W,Guan X,Tucker S,et al.Second-line combination chemotherapy with vinorelbine and capecitabine in patients with advanced breast cancer previously treated with anthracyclines and/or taxanes[J].Chemotherapy,2011,57(1):71-76.
R737.9
:B
:1671-8194(2014)01-0118-03
