甲氨蝶呤治疗大疱性类天疱疮引起间质性肺炎1例
2014-03-29刘海波颜文良
张 敏 刘 芳 刘海波 颜文良 桑 红
·短篇论著·
甲氨蝶呤治疗大疱性类天疱疮引起间质性肺炎1例
张 敏 刘 芳 刘海波 颜文良 桑 红∗
患者,男,57岁。全身散在红斑、水疱伴瘙痒半年,加重2个月。有慢性肾衰竭15年。免疫荧光病理示:表皮下大疱和表皮基底膜带IgG和C3线状沉积。给予累积剂量MTX 20mg后出现急性间质性肺炎和全血细胞减少。予连续性肾脏替代治疗(CRRT)5天后,血清MTX浓度降低,临床症状和肺部间质性病变均明显改善。
大疱性类天疱疮; 甲氨蝶呤; 急性间质性肺炎; 尿毒症
甲氨蝶呤(methotrexate,MTX)是一种叶酸拮抗剂,为治疗类风湿性关节炎(rheumatoid arthritis,RA)等自身免疫性疾病的常用药,皮肤科常用低剂量MTX (low-dose MTX,LD-MTX,<20 mg/周)治疗重症银屑病、免疫性大疱性疾病、血管炎等疾病。
1969年Clarysse等报道了首例MTX致间质性肺疾病(MTX-induced pneumonitis,MIP),1后陆续有LD-MTX治疗RA发生MIP的报道,但LD-MTX治疗皮肤疾病致MIP国内外文献罕见报道,2本文报道低剂量甲氨蝶呤治疗大疱性类天疱疮合并尿毒症引起间质性肺炎1例,希望能够引起临床医师的关注,对此类合并症及时诊断及治疗,避免严重后果。
1 病例资料
患者,男,57岁。全身散在红斑、水疱伴瘙痒半年,加重2个月于2013年8月14日收入我院。有慢性肾功能不全(尿毒症期)、高血压病史15年,5年前开始予血液透析治疗,每周透析3次,并间断予促红细胞生成素3000 IU,每周1~2次治疗肾性贫血。患者于2013年2月出现全身散在红斑,少量水疱,瘙痒明显,于当地医院就诊,考虑“湿疹”,予“氯雷他定”等药物治疗,病情控制不佳,近2个月加重,红斑、水疱较前明显增多,瘙痒明显,于我院门诊查常规病理示:表皮下大疱形成,疱内有纤维素性渗出及嗜酸粒细胞聚集,结合临床,符合类天疱疮;直接免疫荧光病理示:表皮下水疱,表皮基底膜带IgG、C3线状沉积,IgA、IgM(-)(图1)。门诊拟“大疱性类天疱疮”收入我院治疗。入院查体,体温:36.5℃,脉搏:86次/分,呼吸:21次/分,血压:145/75 mmHg,SpO2:95%;心肺未见明显异常。血常规白细胞总数8.9×109/L、红细胞计数3.24×1012/L、嗜酸粒细胞比例0.12、血红蛋白98 g/L;血生化示:尿素9.4(0~6.8)mmol/L、肌酐713 (45~110)μmol/L、尿酸695(150~430)μmol/L;亚甲基四氢叶酸还原酶(methylenetetrahydrofolate reductase MTHFR)C667T基因型为CT型;传染病四项、自身免疫抗体阴性。胸部X片、心电图、肝、胆、胰、脾B超未见异常。皮肤科检查:躯干、四肢红斑,其上见绿豆至黄豆大水疱,疱液清,尼氏征阴性(图2)。入院后给予甲泼尼龙60 mg/d静滴,卤米松20 g/d外用,1周后,每日仍有新发水疱,瘙痒明显,加用甲氨蝶呤片10 mg口服,每周1次,连用2次,患者病情基本控制,无新发皮损,瘙痒症状消失。但患者于口服甲氨蝶呤第2周时诉胸闷,伴轻咳,无痰,体温:38.4℃,脉搏: 99次/分,呼吸:32次/分,血压:146/90 mmHg;SpO2: 85%~90%。神志清,精神差,呼吸急促,轻度三凹征,双肺呼吸音粗、呼吸音减低,未闻及明显干湿啰音;查血气分析:pH7.14,SpO285%,PO265 mmHg,PCO245mmHg,血常规:白细胞总数1.8×109/L、红细胞计数1.57×1012/L、血红蛋白51 g/L、血小板计数42×109/ L;血生化:尿素9.4(0~6.8)mmol/L,肌酐713(45~110)μmol/L、尿酸695(150~430)μmol/L;MTX血清浓度0.14μmol/L;血培养、痰细菌、真菌培养阴性,血多项病原体抗体均为阴性,结核菌素试验(-)。胸部CT显示双肺透亮度减低,弥漫分布磨玻璃影(图3)。

图1 免疫荧光:表皮基底膜带IgG、C3线状沉积,IgA、IgM(-)图2 a、b:躯干、腹股沟红斑,绿豆至黄豆大水疱,疱液清
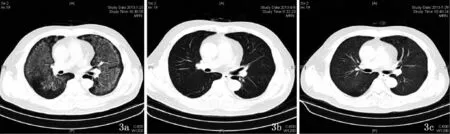
图3 a:双肺透亮度减低,弥漫分布磨玻璃影;b:CRRT治疗后第1天双肺阴影密度较前明显减淡;c:CRRT治疗结束后双肺阴影基本消失
诊断:MTX相关性间质性肺炎。
治疗:予面罩吸氧,停用甲氨蝶呤,继续甲泼尼龙60 mg/d,血液透析增加至每日1次,亚叶酸钙解毒,粒细胞集落刺激因子、促红细胞生成素及红细胞悬液补充红细胞,加用头孢呋新预防感染,5天后查血常规:白细胞总数7.9×109/L、红细胞计数2.3×1012/L、血红蛋白68 g/L、血小板计数98×109/L;但患者胸闷无明显改善,复查胸部CT示双肺阴影密度较前稍减低,范围无明显变化,复测MTX血清浓度0.14μmol/ L,遂改连续性肾脏替代治疗(continuous renal replacement therapy,CRRT),CRRT治疗1天后患者症状改善明显,复测MTX血清浓度0.07μmol/L,CT示双肺阴影密度范围较前明显减轻,CRRT治疗5天后,患者症状基本消失,复查胸部CT基本正常。出院后患者继续口服泼尼松40 mg/d,卤米松外用治疗,现随访3个月,患者无新发皮损,无胸闷不适症状出现。
2 讨论
MIP是MTX治疗中可能出现的严重并发症,多数情况下可危及生命,在LD-MTX使用的患者中发生甲氨蝶呤相关肺炎的比例约占2%~7%。
MIP包括两种类型,I型表现为小剂量MTX(< 300mg),早期发病(<6个月),与中性粒细胞相关,肺纤维化重,死亡率高;II型表现为大剂量MTX(>600mg),临床发病晚(>6个月),与淋巴细胞相关,肺纤维化轻,死亡率低。3
MIP发生机制目前尚不清楚,临床上亦发现发病与药物的用量无关,停止用药后应用糖皮质激素治疗可以完全恢复,再次用药时可再引起MIP复发,这一点虽符合变态反应,但亦有报道4称有些患者在MIP治愈后再次用药,不出现复发。目前认为MTX诱发MIP是激活的T细胞介导的超敏反应,MTX刺激II型肺泡细胞,可促进其释放炎性因子,导致炎性细胞聚集引起肺泡炎。5Yamauchi认为p38丝裂原激活的蛋白激酶是MTX诱发肺内趋化因子释放引起炎症反应的重要因素。6
MIP风险因素包括基础性肺疾病、吸烟、用药前使用其他DMARD药物和肾功能不全。7MTX主要经肾小球滤过和肾小管的主动分泌排泄,肾功能损害可能是MIP最重要的危险因素之一,因此,应谨慎考虑低剂量MTX治疗肾功能不全的患者。血液透析病人如使用MTX,需严密监测血清药物浓度和临床表现。遗传药理学表明,MTX毒性作用与MTHFR基因多态性相关。MTHFR是催化5,10亚甲基四氢叶酸还原成10亚甲基四氢叶酸的关键酶,对叶酸代谢和DNA合成具有重要作用。MTHFR具有遗传多态性,其中C677T位点C→T是目前最常见的突变,丙氨酸被缬氨酸替换,酶的热不稳定性增加。8目前有研究表明MTHFR-C677TTT基因型毒性反应发生率高,但是CT和CC基因型比较则没有显著差异。9本例患者为MTHFR-C677TCT型,可能在肾功能衰竭的基础上增加了MTX的毒性,进而导致了患者的间质性肺炎和骨髓抑制。
MIP起病隐匿,因临床表现和病理表现缺乏特异性,确诊困难,很难与RA致间质性肺炎、心源性肺水肿、肺感染及其他药物引起的肺损伤相鉴别。目前国际上多采用Searles等10的诊断标准:(1)急性发作的呼吸困难;(2)体温>38℃;(3)呼吸急促>28次/分、干咳;(4)影像学表现间质性肺炎或肺泡浸润;(5)血常规白细胞<5×109/L;(6)血、痰培养阴性;(7)肺功能检查提示弥散功能降低导致限制性肺功能障碍;(8)氧分压(空气环境)<55mmHg;(9)肺活检病理符合支气管炎或间质性肺炎。在患者存在MTX用药史的前提下,以上标准符合4条为疑似诊断,5条为拟诊,符合6条可确诊。该患者表现符合以上6条诊断标准。然而,MIP的诊断标准并不是特异性的,所以寻找病原学依据除外感染,并认真进行鉴别诊断非常重要。
对于MIP的治疗首先应停止MTX的使用,静脉滴注糖皮质激素,氧疗,加用叶酸、亚叶酸钙治疗。CRRT较血液透析可以更好的清除MTX,CRRT是采用每天24小时或接近24小时的一种长时间、连续的体外血液净化疗法以替代受损的肾功能,其在调节体液电解质平衡的同时,可以清除各种代谢产物、药物和各种致病性生物分子等,有效地降低血清MTX水平。11因此,对于MIP尤其是伴有肾功能不全的可以采用CRRT治疗。本例患者经过连续5天的血液透析,其临床症状和胸部CT均未明显改善,采用CRRT治疗后,患者的MTX血清浓度有效降低,临床症状和胸部CT很快好转,也证实了这一点。
综上所述,MIP是使用LD-MTX治疗的严重并发症之一,其中肾功能不全和MTHFR C677T基因变异可能是其危险因素,CRRT可以作为有效清除MTX的方法之一,可以用于治疗MIP。医生和患者均应提高MIP的认识,以早期诊断、及时治疗,降低MIP的误诊率和病死率。
1Clarysse AM,CatheyWJ,CartwrightGE,etal.Pulmonary disease complicating intermittent therapywithmethotrexate.JAMA,1969,209(12):1861-1868.
2 Imokawa S,Colby TV,Leslie KO,et al.Methotrexate pneumonitis:review of the literature and histopathological findings in nine patients.Eur Respir J,2000,15(2):373-381.
3 Chikura B,Sathi N,Lane S,et al.Variation of immunological response in methotrexate-inducedpneumonitis.Rheumatology (Oxford),2008,47(11):1647-1650.
4 Carson CW,Cannon GW,Egger MJ,et al.Pulmonary disease during the treatment of rheumatoid arthritiswith low dose pulse methotrexate.Semin Arthritis Rheum,1987,16(3):186-195.
5 Jakubovic BD,Donovan A,Webster PM,et al.Methotrexateinduced pulmonary toxicity.Can Respir J,2013,20(3):153-155.
6 Yamauchi Y,Okazaki H,DesakiM.Methotrexate induces interleukin-8 production by human bronchialand alveolar epithelialcells.Clin Sci,2004,106(6):619-625.
7Sathi N,Chikura B,Kaushik VV,etal.How common ismethotrexate pneumonitis?A large prospective study investigates.Clin Rheumatol,2012,31(1):79-83.
8Wiemels JL,Smith RN,Taylor GM,etal.Methylenetetrahydrofolate reductase(MTHFR)polymorphisms and risk of molecularly defined subtypes of childhood acute leukemia.Proc Natl Acad Sci USA,2001,98(7):4004-4009.
9 Toffoli G,Russo A,Innocenti F,et al.Effect ofmethylenetetrahydrofolate reductase 677C-->T polymorphism on toxicity and homocysteine plasma level after chronicmethotrexate treatment of ovarian cancer patients.Int JCancer,2003,103(3):294-299.
10 Searles G,McKendry RJ.Methotrexate pneumonitis in rheumatoid arthritis:potential risk factors.Four case reports and a review of the literature.JRheumatol,1987,14(6):1164-1171.
11 Saland JM,Leavey PJ,Bash RO,et al.Effective removal of methotrexate by high-flux hemodialysis.Pediatr Nephrol,2002,17(10):825-829.
(收稿:2013-11-22 修回:2013-12-31)
Acute interstitial pneumonitis induced by methotrexate in the treatment of a patient w ith bullous pemphigoid
ZHANGMin,LIU Fang,LIU Hai-bo,et al.Department ofDermatology,Nanjing General Hospital ofNanjing Military Region PLA Hospital,Nanjing,210002
A 57-years-old male presented with redness and blister over whole body with pruritus for 6 months and aggravated for 2months.The patienthas a history of uraemia for15 years.Histopathology and DIF showed subepidermal bliaters and IgG,C3 linear deposition along the basementmembrane.Acute interstitial pneumonia and pancytopenia developed when MTX accumulative dosage of 20 mg.The patient’s clinical symptomswere improved and serum MTX concentration became lower after treated with continuous renal replacement therapy(CRRT)for 5 days.
bullous pemphigoid;methotrexate;acute interstitial pneumonitis;uraemia
南京军区南京总医院皮肤科,南京,210002
∗通信作者
