再访我国《侵权责任法》第59条:情景化、类型化与限缩性适用
2014-03-28赵西巨
摘要:《侵权责任法》第59条出身于我国“医药不分家”的医疗体制,它过于注重医疗机构“销售”医疗产品这一表征,而没有对医疗服务区别于商品销售的特性给予充分考虑。在医药尚未分离的时代,第59条具有存留价值。在医疗机构走向“医药分家”的进程中,与其狭隘地、机械地、不加区分地适用第59条从而将其演化为旧体制的“固化剂”,不如全面地、辩证地分析医疗机构的责任归属、使其细微地反映不同情形,将第59条演变为新体制产生和建立的“压力阀”和“推动器”。可通过类型化处理方式,比如医疗机构的类型化、服务商品区分的类型化、产品缺陷的类型化、医疗产品的类型化和与医疗产品有关的责任类型化,来缓解第59条对医疗服务提供者所带来的负面影响。
关键词:医疗产品责任;《侵权责任法》;第59条
中图分类号:DF526文献标识码:ADOI:10.3969/j.issn.1001-2397.2014.02.16
在其他法域,医疗产品侵权责任一般属于产品责任法的领地,它是产品生产者和销售者的问题,在以医疗从业者为主体的医疗侵权法或医疗损害赔偿法中很难寻到踪影。医疗产品侵权责任出现在我国的医疗损害责任法(《侵权责任法》第7章)中,有其特定的社会背景和政策考量,可谓别具一格。关于“产品责任”,我国《侵权责任法》有专门一章,共计7条(第41条-第47条)。从法条上讲,医疗产品(如药品和医疗器械)完全可以适用其规定。但是,关于医疗产品侵权责任,我国《侵权责任法》在医疗损害责任一章中专门规定了第59条,称之为“医疗产品责任”,成为一条颇具中国特色的条款。该条规定,“因药品、消毒药剂、医疗器械的缺陷,或者输入不合格的血液造成患者损害的,患者可以向生产者或者血液提供机构请求赔偿,也可以向医疗机构请求赔偿。患者向医疗机构请求赔偿的,医疗机构赔偿后,有权向负有责任的生产者或者血液提供机构追偿。” 由此,医疗机构被拉入了医疗产品侵权损害赔偿锁链当中。对于第59条,作者曾将其置于美国法背景的比较之下[1]。本文则再访第59条,旨在对其进行情景化、类型化处理和限缩适用。
本文从第59条产生的社会背景着手,探讨了对它的解释和适用,检讨其存留价值。其中贯穿着对域外法的观察和比较。本文试图向读者传递的信息是:《侵权责任法》第59条脱胎于我国特有的医疗体制,尤其是旧有的市场主导型医疗体制,是一种偏向于患者救济、轻医疗服务提供者利益、重“销售”行为存在这一事实、轻医疗服务区别于商品销售的特性之考虑的立法安排。它与国际做法并不一致。在《侵权责任法》的解释适用时代,应尊重第59条产生的社会背景、利益权衡和政策考虑,缓解其对医疗服务提供者所带来的负面影响,避免其成为旧体制的“固化剂”,努力使其成为当下政府主导型新医疗体制改革的“催化剂”。
一、第59条产生的社会背景我国的医疗体制改革肇始于上世纪八十年代,与我国的改革开放与经济体制改革几乎同步。受经济体制改革思潮的影响,初始的医疗改革并没有充分认识到医疗行业不同于其它产业的特殊性质,而是将诸多企业改革的理念和措施引入医院管理领域,充满着较多的市场经济思维和操作模式[2]。在市场经济条件下,寄希望于市场调控,政府也从改革开放之前的大包大揽的管理方式中退出,造成了医疗服务提供上政府投入、干预和责任承担的缺位。医院从单纯强调社会效益,不重视经济效益,转变为在强调社会效益的同时,重视经济效益。公立医院的趋利性渐浓,公益性淡化。
市场化医改模式造成的局面是,由于政府对公立医院投入水平过低,医院以创收来实现自我发展的压力和动力加大,曾经依靠国家财政补助的公立医疗机构转变为商业利润和自身利益最大化的追逐者。医疗机构补偿机制扭曲,医疗机构形成了“以医疗服务经营性收入补偿为主,以公共财政投入补偿为辅”的复合型格局,公共财政投入占医疗机构总收入比例不到10%[3]。医疗机构受市场利益驱动, 供方诱导需求的现象严重,过度检查、“大处方”泛滥。医疗机构的业务与药品收益影响到医务人员的收入和医院的发展,使其成为主要的利益驱动力。由此形成的过度供给不仅浪费了大量宝贵的医疗资源,而且影响到了医疗服务的可及性和公平性。改革开放以来医改最大的损失就是医疗行业发展方向的迷失和对宗旨灵魂的破坏以及医患关系紧张[4] 。
现代法学赵西巨:再访我国《侵权责任法》第59条:情景化、类型化与限缩性适用 2005年,风向变动。市场化并非医改的方向、医改应以政府为主导、应坚持医疗卫生事业的公共品属性的声音开始强大起来并占据了主导地位。2006年的《国民经济和社会发展第十一个五年规划纲要》强调了政府在提供公共卫生和基本医疗服务中的责任。2007年,卫生部开始实行以政府为主导、以省为单位的网上药品集中采购办法。2008年“新医改方案”公开向社会征求意见。2009年国务院《关于深化医药卫生体制改革的意见》表达了“推进医药分开,积极探索多种有效方式逐步改革以药补医机制”的决心。2012年国务院印发的《“十二五”期间深化医药卫生体制改革规划暨实施方案》承诺要“落实政府办医责任”,“扭转公立医院逐利行为”,并且再次重申,“以破除‘以药补医机制为关键环节,推进医药分开,逐步取消药品加成政策,将公立医院补偿由服务收费、药品加成收入和财政补助三个渠道改为服务收费和财政补助两个渠道。医院的药品和高值医用耗材实行集中采购。” 政府主导型医改进入实质性阶段。
目前,我国正在构建“以政府为主导、以资源配置和成本控制为核心内容”的基本医疗保障体系。正是意识到了有限的医疗资源供给与日益增长的医疗需求之间的矛盾,基本医疗保险制度将资源的有效利用、优化配置和成本控制列为核心的追求目标。这表现在诸多方面,比如,设置基本的医疗保险药品目录、诊疗项目、医疗服务设施标准、鼓励优先使用基本药物和适宜技术、推行疾病临床路径、限制使用大型医疗设备检查、限制使用高价药品与新增诊疗项目和高费用新技术等。
我国的《侵权责任法》正是酝酿产生于市场化医改模式向政府主导型医改模式转型之际。新的政府主导型医改模式推出之后,旧有的市场化操作模式仍存在惯性。我国的《侵权责任法》“医疗损害责任”一章中的规定难免烙有市场化医改模式的印记。比如,其第63条关于过度医疗之禁止显然是回应了新医改之前“按服务收费(fee-for-service)”体制下由不正当经济利益正面驱动所导致的医疗资源的过度消费,而没有注意到资源有限和成本控制型(cost-containment)医疗体制(如我国正在建立的基本社会医疗保险体制)下外在经济压力(如总额控制、优先考虑资源节约型医疗方案)负面驱动所引发的“医疗节制、不足或短缺”现象。另一例证便是本文所关注的第59条。第59条所反映的社会背景是:在医疗行业市场化运作模式之下,政府没有完全承担起医疗服务提供上的责任,因政府投入不足,医疗机构被迫、被容忍,甚至被鼓励转向市场通过药品买卖来弥补政府财力支持的不足。它很难适用于医疗机构已脱身药品买卖链条和事务,其功能已净化为单纯的医疗服务提供者的新医疗体制设想之下。
通常认为,新中国建国以来最大的一起假药致害事件——“齐二药”案件2006年4月,位于广州市天河区的中山大学附属第三医院(“中山三院”)发现该院先后出现多例急性肾衰竭症状患者,而这些患者均使用了齐齐哈尔第二制药有限公司(“齐二药”)生产的亮菌甲素注射剂。2006年7月19日,国务院召开常务会议,认定这些假药事件是一起因药品生产企业“齐二药”的采购和质量检验人员严重违规操作、使用假冒药用辅料制成假药投放市场并致人死亡的恶性案件。根据国家食品药品监督管理局通报,齐二药违反有关规定,将“二甘醇”冒充辅料“丙二醇”用于“亮菌甲素注射液”的生产,而二甘醇在病人体内氧化成草酸,导致肾功能急性衰竭。仅中山三院使用的亮菌甲素注射剂已造成14人死亡,其中11名受害人将中山三院、销售商“金蘅源”、“省医保”、生产商“齐二药”告上法庭,索赔总额达2000万元左右。2008年7月15日,广州市天河区人民法院判决赔偿金额为350万元,四被告承担连带责任。2008年12月10日,广州市中级人民法院做出维持原判的终审结果。广州市天河区人民法院在其判决书中认定药品“亮菌甲素注射液”为假药,构成《产品质量法》上的缺陷产品。对《侵权责任法》第59条的出台和行文有重要影响[5]。在该案中,两审法院均据被告中山三院有偿并加价向患者提供涉案药品这一事实而认定其构成“销售者”,从而与其他被告承担连带责任。比如,广州市中级人民法院在判决书中指出,“中山三院属于涉案假药的销售者。在目前我国‘以药补医、‘以药养医的机制下,医疗机构一方面通过药品加价的方式获取大量的收益,另一方面却不欲作为药品销售者以劣药、假药等缺陷产品对患者造成的损害承担赔偿责任,这显然于理不合,亦与权利与义务相统一之法律原则相悖。”法院同时认为,中山三院加价提供药品的行为“与药品经营企业通过卖药获得收入的销售行为虽然表现形式不同,但并无本质区别”。由此可见,之所以让医疗机构承担产品损害赔偿责任,我国司法看重的是医疗机构在产品销售链条中的商业化身份(作为药品销售者的身份),并没有对其提供医疗服务的特殊性质给予过多关注。对受害患者的救济之考虑压倒了医疗机构利益保护之需要,对“社会效果”的追逐压倒了对应有法律规则的尊重。
二、第59条的解释论关于医疗产品责任,我国有几位学者曾提出立法建议。比如,由王利明教授主持的“中国民法典学者建议稿及立法理由”科研项目提出:“在医疗活动中,因医疗机构使用的药品、血液、血液制品或医疗设备的缺陷造成他人损害的,适用关于产品侵权责任的规定。”同时规定,医疗机构、供血单位或者血液制品生产者能够证明自己已尽到最大的注意义务仍然无法避损害的,不承担赔偿责任,但应当依据实际情况给予适当补偿[6]。杨立新教授主持的《侵权责任法草案建议稿》建议道:“药品、医疗设备、医疗器械及其他医疗用品存在缺陷,造成患者损害的,适用本法关于产品侵权责任的规定。”“用于植入或输入的人体组织、器官存在缺陷,造成患者损害的,应当承担侵权责任。医疗机构或者供应单位能够证明已采取必要检验技术并尽到合理注意义务的,不承担赔偿责任,但应当依据实际情况给予适当补偿。”[7]此类立法建议的一个共同特点是,将医疗产品责任视为产品责任的一部分,在行文上将医疗产品缺陷责任法与产品责任法联结起来,没有特别指明医疗机构为销售者从而承担医疗产品责任,而且特别指明在责任承担上医疗机构只承担过错责任。此类建议具有较强的弹性、包容性和普适性。它既不妨碍在医疗机构兼具医疗服务提供者和医疗产品销售者身份的体制下让其以销售者的身份去承担产品缺陷责任(从而实现目前《侵权责任法》第59条的效果),也包容了医疗机构在摆脱掉医疗产品销售者身份的情况下不再以销售者的身份承担医疗产品责任的可能。在不同医疗体制下医疗机构“销售者”身份的有无决定了它是否承担产品责任法中的“销售者”责任。相比之下,《侵权责任法》第59条关于医疗产品责任的规定过于僵硬和直白。它直接将医疗机构置于医疗产品“销售者”的责任之下。它很难适用于医疗机构不再是“销售者”的情形。在后者情形出现时,它的有效性值得怀疑,可能遭受被废弃的命运。
第59条简单套用了产品责任法中生产者与销售者的责任分配套路。参见:我国《侵权责任法》第五章“产品责任”部分第41条、第42条和第43条。比如,《侵权责任法》“产品责任”章第43条规定,“因产品存在缺陷造成损害的,被侵权人可以向产品的生产者请求赔偿,也可以向产品的销售者请求赔偿。产品缺陷由生产者造成的,销售者赔偿后,有权向生产者追偿。”第59条所做的工作仅是将其中的“销售者”替换为“医疗机构”。这一机械替换导致的后果是,连真正的商业领域的销售者(如医疗产品的批发商和零售商)都给替换掉了。对真正销售商的追责,第59条已无法适用,不得不又需要回归至第43条加以适用。这造成了第59条和第43条的并立。
立法者通过第59条所欲建立的效果尚不清晰。是将医疗机构置于真实的产品责任(无过错责任)之下,还是仅提供一个方便患者救济的机制?从归责原则的归类上看,第59条所展现的医疗产品侵权形态本身会让人直观地认为它对医疗机构适用的是无过错责任原则,但是,细究一下,对于医疗机构,它适用的仍是过错责任原则。就医疗产品来说,此条肯定的只是“生产者”对有缺陷的医疗产品的无过错责任。从法条上看,医疗机构对有缺陷的医疗产品所造成的损害承担的仍是过错责任,而不是无过错责任。血液提供机构和医疗机构对“不合格的血液”所造成的损害承担的也均是过错责任。而且,第59条只规定了医疗机构赔偿后有权向负有责任的医疗产品生产者追偿,而没有对应地规定医疗产品生产者可以向有过错的医疗机构追偿。这种单向追偿权的规定似乎向人们昭示医疗机构不同于通常的产品销售者[8],而只是提供便利之人。
尽管第59条没有就医疗机构适用无过错责任,但这仍不能让人释然。该条所规定的医疗机构对有缺陷的医疗产品所造成的损害“最终”只承担过错责任(即“不真正”连带责任)仅是就生产者与医疗机构之间的内部关系而言的。就外部关系上而言,即就生产者和医疗机构与第三人(医疗产品使用者)的关系而言,医疗产品使用者(患者)可以选择“生产者”或“医疗机构”作为赔偿主体,医疗机构不能以其没有过错为免责事由。即使是患者一方只起诉医疗产品生产者或者医疗机构,人民法院也可能依被告的申请或必要时依职权,追加医疗机构或者医疗产品生产者为案件的当事人。最高人民法院关于审理医疗损害责任纠纷案件适用法律若干问题的解释(征求意见稿),第4条第2款。“生产者”和“医疗机构”被认为是承担“连带”责任。“医疗机构”被拉入了缺陷医疗产品损害赔偿链条之中,且要承担生产者赔偿不能的风险。当医疗产品侵权导致损害时,医疗机构不再是无干系的一方,它极有可能被缠入诉讼,面临着应诉成本、辩明自身“清白”的成本和生产者赔偿不能时的赔偿成本的支出。可以讲,在医疗机构身上存在着切实的承担产品责任和无过错责任的可能和风险。这使得第59条所产生的后果变得凝重起来。
我国《侵权责任法》第59条承继了“齐二药”案法院将“医疗机构”视为医疗产品“销售者”的观念。此种观念之所以在我国存在巨大市场、没有太多抵抗(包括来自医疗机构的),是因为我国旧有的、现在仍持续存在的医疗体制造成的。它回应了我国目前医疗机构“医药不分家”、医疗机构加价销售医疗产品的现状,尽管这种状况是不正常的、需要改革的和正在改革的。可以说,它是我国现有医疗体制的产物,具有现实基础。但是,比较来看,它难以堪称为一种良好的法律设计。
三、域外法的观察就我国法意义上的“销售者”责任而言,美国《侵权法重述·第三次·产品责任编》美国《侵权法重述·第三次·产品责任编》替代的是34年前的美国《侵权法重述·第二次》第402A条。它包括四章。其中,第一章规定了产品缺陷责任的规则。第一章又分为两个主题:第一个主题可以一般性地适用于所有产品,第二个主题特别规定了适用于一些特殊产品(如药品和食品)的规则。第二章规定了并非建立在产品销售时的产品缺陷之上的产品损害责任,包括违反售后警示义务和违反售后召回义务所导致的损害责任。第四章规定的是具有普遍适用性的一些规则,如产品缺陷与损害间的因果关系、抗辩事由。将“从事商业性销售或以其它方式分销者(one who sells or otherwise distributes)”置于产品缺陷所导致的损害赔偿责任之下。Restatement of the Law, Third, Torts: Products Liability, § 1.“商业性销售者或分销者”包括“非生产性的销售者或分销者(nonmanufacturing sellers or distributors)”(比如批发商和零售商),它是一个与“生产商(manufacturer)”相对应的概念。“非生产性的销售者或分销者”对产品缺陷也要承担责任,即使他们自己并没有使得产品产生缺陷,不管他们是否知道或应当知道风险的存在,也不管他们是否处于避免缺陷发生的位置。Restatement of the Law, Third, Torts: Products Liability, § 2, Comment o.一旦证明,在产品销售之时或之前,处于销售链条中的前手,应该能够提供合理的替代设计或合理的警示,并且这些合理的替代设计或合理的警示能够减少原告的损害,该产品的“非生产性的销售者”就应承担设计缺陷和警示缺陷责任,而不管他们是否行使了合理的注意。Restatement of the Law, Third, Torts: Products Liability, § 2, Comment o.这些都说明了严格责任的存在。
但是,对于处方类药品和医疗器械(Prescription Drugs and Medical Devices),即那些只有经过健康服务提供者的处方才可合法销售或以其它方式分发的药品和医疗器械,情形有所不同。销售或其它方式分发具有缺陷的处方类药品和医疗器械的生产商(manufacturer)是缺陷所致损害责任的承担主体。Restatement of the Law, Third, Torts: Products Liability, § 6 (a).处方类药品和医疗器械的零售商和其它分发者(retail seller or other distributor)只有在存在以下两种情形之一时才承担产品缺陷责任:(1)在产品销售或分售之时,产品具有制造缺陷;或者(2)在产品销售或分售之时或之前,零售商和其它分发者因未行使合理的注意(fails to exercise reasonable care),而对人身导致损害。Restatement of the Law, Third, Torts: Products Liability, § 6 (e).也就是说,处方类药品和医疗器械的零售商和其它分销者,只有在存在“过失”(即违反合理注意义务)时,才对此类产品的设计缺陷和警示缺陷承担责任。之所以在此领域对其责任加以限制,是因为应允许他们信赖产品制造者的特殊专业知识、开方及治疗的医务人员以及政府的管理机构,且要考虑到病人方便地买到价格合理的处方类药品之需要。Restatement of the Law, Third, Torts: Products Liability, § 6, Comment h.这不同于一般产品的零售商和其它分销者所承担的产品设计缺陷和警示缺陷责任。
但是,美国许多州出现了一些立法,试图全面免除“非生产性的销售者或分销者”的严格责任。这主要是考虑到将“非生产性的销售者或分销者”置入产品责任诉讼中会浪费法律成本和资源。但是,为了确保原告受害人的赔偿不会因此而落空,这些立法一般规定只有在以下条件满足时才免除“非生产性的销售者或分销者”的严格责任:(1)生产者处于原告住所地法院的管辖范围之内;(2)生产者没有破产,也太不可能破产。Restatement of the Law, Third, Torts: Products Liability, § 1, Comment e.即要考虑到原告救济得以实现的需要。此种立法存在二个问题。一是,如果在起诉时免除了“非生产性的销售者或分销者”的严格责任,原告可能会承担在起诉时到判决时之间生产者破产的风险,导致原告的损害无法获得赔偿。对于此,美国《侵权法重述·第三次·产品责任编》建议针对“非生产性的销售者或分销者”规定诉讼时效,以便在必要时将其拉入诉讼。Restatement of the Law, Third, Torts: Products Liability, § 1, Comment e.二是,如果产品的缺陷是由“非生产性的销售者或分销者”制造的,其应对产品的制造缺陷承担产品严格责任,而不管其是否行使了合理的注意。Restatement of the Law, Third, Torts: Products Liability, § 1, Comment e.在学术界,也有学者主张,只要产品缺陷的制造者或者其保险者是可及的和能承担判决结果的,处于销售链条中的、没有导致缺陷的非生产商不应承担产品缺陷责任,也不应因成为诉讼一方而耗费大量的费用[9]。美国法中这种将“非生产性的销售者”有条件地移出严格责任之射程的动向值得关注。
不管怎么样,在美国法中,在医疗这个特殊领域,提供医疗服务时同时提供医疗产品的医院和医生并不被认为是产品的销售者(sellers)[10-13],从而远离了产品缺陷责任和严格责任。在美国法中,在是否适用严格责任上,有一种服务与商品二分(the sale-service dichotomy)的理论。在医疗服务过程中的医疗产品使用在整体上被定性为“服务”的一附属部分,而非产品“销售”,从而适用以过错责任为原则的医疗损害赔偿法,而不是以无过错责任或严格责任为基础的产品责任法。由于是基于过错责任,在医疗服务当中,医生行使的仅仅是“合理的注意和技能”,而不是就结果承担担保责任。
应该看到,在美国,对于让医疗行业和医疗从业者免于侵权法中的严格责任这一点,有些学者也颇有微词。产生这些异议的主要原因是医疗服务提供者的商业化动向,他们看到了医院从事商品销售并获得巨大赢利这一情况,并认为对医疗行业的豁免让原告患者丧失了一个有利的救济渠道[14]。 在早期有些法院也认定医院的血液提供和产品使用是一种销售行为[15-16],并得到了当时学者的支持。有学者认为将服务主导型中的商品交易不定性为一种销售是法律上的虚构,它剥夺了对消费者的保护(Comment. Sale of Goods in Service-Predominated Transactions[J]. Fordham L. Rev., 1968, 37: 115-122)。但是,在美国,将医疗机构和医疗从业者排除在产品责任和严格责任之外是立法和司法的主流。许多法域不愿将产品严格责任赋加在医院和医生身上,比如加利福尼亚州[17]、纽约州[18]、宾夕法尼亚州[19]、新罕布什尔州[20]、密苏里州[21]、佛罗里达州[22]、华盛顿州[23]、新泽西州[24]等。即使医院在手术使用医疗器械时对医疗器械额外加价了,法院也不愿将医院定性为医疗器械的销售者,而是将其视为医疗服务的提供者[10]。再进一步讲,即使医疗服务提供者可以定性为“销售者”,但是,基于“政策(policy)”原因,法院也不会将医疗服务提供者置于产品严格责任之下[19] 。这些“政策”原因主要与医疗服务提供者的独特性质(peculiar characteristics),或者说医疗服务与商品销售的区别有关[19]。有法官甚至言道,即使医院在提供与某种医疗器械有关的服务中没有使用医疗技能或知识,仍然可以讲医院是在尽其所能为患者的治疗做一些必要的事情,也不能说其活动完全与医疗服务无关[10]。
在英国法中,产品缺陷所导致损害的责任主体是产品的“生产者或制造者(producer)”。Consumer Protection Act 1987 (Eng), Section 2 (2). 产品的“提供者(supplier)”可能承担产品责任,条件是:(1)遭受损害的人要求提供者指明产品的生产者(不管是否仍存在);(2)这种要求是在损害发生后的合理时间内提出的,而且要求遭受损害的人辨明生产者是不(合理地)符合实际的;(3)产品提供者未能在收到请求的合理时间内指明向其提供产品的人。Consumer Protection Act 1987 (Eng), Section 2 (3).也就是说,产品的提供者是可以通过指明向其提供产品的人(比如生产者)来避免产品责任的。产品的“提供者”指的是销售产品的人,或者,为履行法定义务而提供产品的人。Consumer Protection Act 1987 (Eng), Section 46.就药品或医疗器械来说,在英国的全民健康服务(NHS)体系当中,销售很少发生,医疗服务提供者不会是“销售”产品的人。但是,药师、医生、医疗服务提供者可能因为在全民健康服务体系中“提供”了医疗产品而成为产品的“提供者”而承担产品责任。但是,这种责任可以通过指明产品提供链条中的前手(如生产者)而简单地免除的,而且医疗服务提供者指明生产者的义务也并不是无条件的。
在英国法中,对于全民健康服务(NHS)体系之外的私人医疗来说,因医疗产品遭受损害的患者多了一条救济,即他可以以违反合同为由起诉医生。如果医生提供的只是医疗服务,医生只需在服务中行使“合理的注意和技能”,除非医生对结果有过保证。如果医生在提供医疗服务中使用了医疗产品(即出现了产品与服务的混合形态),医生在诊断、提供医疗建议和治疗的职业角色定位通常被认为是以交易为主导特征,而不是将其视为销售合同[25]。这也避免了医疗服务提供者去承担适用于商业领域的严格性质的责任。
在欧洲大陆,医疗侵权多是聚焦于医生的诊疗和信息告知领域,很难寻到医疗服务提供者承担医疗产品责任的影子[26]。在荷兰法中,尽管有学者主张应由医疗服务提供者(尤其是医院)承担医疗产品缺陷责任、担保所使用物品的质量,但这不是立法者的声音[26] 185-186。 荷兰《民法典》要求制造商对其产品缺陷所致伤害承担严格责任。针对医生或医院而提起的产品缺陷责任诉讼可以被驳回,因为让制造者承担责任更合理[26] 185-186 。
四、对第59条的检讨我国《侵权责任法》出台之后,包括笔者在内的一些学者发出了一些对第59条进行反思和质疑的声音[1,5,27]。第59条可能使过多的医院陷入诉累,加剧医患矛盾,而且医疗机构的追偿权有时难以实现[5]。从我国司法和后来的立法反应来观察,我国《侵权责任法》第59条将医疗机构拉入医疗产品责任法的主要现实基础是医疗机构向患者“加价销售”医疗产品,兼具了“销售者”身份。但是,它只看到了问题的一个方面,而且仅仅是一个非关键的方面。 它没有意识到“(医疗)服务” 与“商品/产品销售”之不同,没有很好地区分产品责任法和医疗损害赔偿法,没有精心地权衡对医疗机构课以无过错责任的利弊得失,也没有正视我国“医药分家”的医疗改革趋向。
首先,从发展方向上来看,第59条与我国的医疗改革动向和实践并不合拍。它是旧有的市场主导型医疗体制的反映。自2005年开始,我国已经进入了构建“政府主导型、以资源配置和成本控制为核心内容的基本医疗保障体系”的时代。尽管这种改革的成功尚需时日,也不乏阻力和冲突,但是我国目前的注重政府主导、全民覆盖、资源节约的新医疗改革符合国际上追求全民性医疗保障、注重医疗服务的公平性和可及性的医改大趋势[28],方向是正确的,也是不可逆转的,应得到促进和被推动。
其次,从操作层面来看,作为深化医药卫生体制改革的一部分,我国已经全面实行“以政府为主导、以省(自治区、直辖市)为单位的网上药品集中采购制度”。根据2009年卫生部、食品药品监管局、中医药局等六部门联合印发的《进一步规范医疗机构药品集中采购工作的意见》和关于《进一步规范医疗机构药品集中采购工作的意见》有关问题的说明,由政府搭建的非营利性采购交易平台不仅适用于包括国家基本药物在内的各种药品之采购,而且要成为高值医用耗材、省级管理的乙类大型医用设备之采购平台。这种集中采购采取公开招标、网上竞价、专业分类、专家评议(考察安全性、疗效、副作用、企业规模、品牌知名度、企业服务等指标)、集中议价、直接挂网(包括直接执行政府定价)的方法,形成统一价格,即医药企业向省(区、市)内所有参加药品集中采购医疗机构的供应价格。县及县以上人民政府、国有企业(含国有控股企业)等所属的非营利性医疗机构,必须全部参加药品集中采购,而且鼓励其他医疗机构参加药品集中采购活动。除非有特殊情况且经过审批,各医疗机构只能购买中标(入围)药品,严禁标外采购、违价采购或从非规定渠道采购。药品集中采购制度大大减少了医疗机构在药品选择、推荐上的话语权和影响力。从某种意义上讲,采用何种药品和哪个厂家的药品是政府主导的集体智慧的结果。医疗机构很难与通常和完全意义上的“购售商”同日而语。
再次,从宏观角度看,在一个从药品的研发、生产、上市都存在着政府严格监管,即制定并要求相关主体遵从药物非临床研究质量管理规范(GLP)、药物临床试验质量管理规范(GCP)、药品生产质量管理规范(GMP)和药品经营质量管理规范(GSP),药品质量的把关者应是药品研发、生产、销售企业和国家药品监督管理部门。医疗机构不应成为政府监管薄弱、企业自律不足和道德沦丧的“替罪羊”。医疗机构和医务人员有理由期望进入市场的药品具有合理的安全性。医疗机构及其医务人员对药品的审查义务仅限于外观审查,而不能苛求其对药品的内在质量进行深入检验和解剖。即使药品存在缺陷,医疗机构和医务人员不可能开启或造成这种不合理危险,医疗机构也无法减少和消灭这种不合理危险。因此,医疗机构及其医务人员不应承担此种可能的不合理危险所带来的法律后果。
我国的新一轮医疗体制改革已经走入实质性和实践层面。随着我国以“医药分家”为前进方向的医疗体制改革的深入,在医疗机构中药品加价销售这一做法会成为历史,医疗机构充当药品“销售者”的角色将逐渐弱化和淡去,医疗服务机构的功能将逐渐由双重趋于单一。产品责任法与医疗服务损害赔偿法之间的界限将逐渐明朗和清晰。如果没有了医疗机构“销售”产品这一层现实基础,患者为消费者从而适用产品质量和消费者权益保护方面的法律的论辩将相当脆弱。如果我国不动摇“医药分家”的改革方向,坚持医疗机构“去商业化”的努力,有理由认为我国《侵权责任法》第59条关于医疗产品责任的规则注定是短命的。
但是,需是指出的是,我国目前司法和立法将医疗机构置于产品缺陷责任之中主要是由医疗机构存在药品销售行为这一事实或直观原因所驱动。其实,正如美国法所展现的,将医疗服务提供者剥离出医疗产品缺陷责任的最根本的原因并不在于此,而在于对医疗机构医疗产品使用行为的定性和医疗服务的特性。也就是说,不管医疗服务提供者的产品使用行为是不是“销售”行为,医疗服务不同于商品销售的基本特性足以将医疗服务提供者挡在产品严格责任之外。我国法过度关注医疗机构“销售”医疗产品这一表面事实,而忽略了对医疗服务之特性的考虑的状况值得检讨。
五、第59条的存续价值和适用笔者注意到,我国“医药分家”的政策早在2000年就以公文的形式面世了。当年国务院办公厅转发国务院体改办等部门《关于城镇医药卫生体制改革指导意见》的通知(国办发[2000]16号),就提出了实行“医药分开核算、分别管理”的目标。为了切断医疗机构和药品营销之间的直接经济利益联系,当时还提出要在逐步规范财政补助方式和调整医疗服务价格的基础上,把医院的门诊药房改为药品零售企业,独立核算。但是,十多年过去了,早已成熟的国际经验——“医药分离”做法在我国仍在摸索中前行,许多医院仍沉浸在通过“卖药”补贴家用的状态当中。由此可见旧体制的顽固性、强大的惯性和改革的艰巨性、复杂性。“医药分家”牵动着政府、医院和医疗保障部门的利益调整和重组。我国真正向国际做法看齐尚需时日。
如果不真正实现“医药分家”从而彻底让医疗服务提供者从医疗产品销售中脱身,至少从外观上讲,医疗服务提供者就很难摆脱承担医疗产品责任的干系,《侵权责任法》第59条就存在着适用的借口、理由和市场。在这种情况下,如何既让法律的既有规定(第59条)得以适用,又忠实于不从事产品“销售”就不应承担产品责任这样一条底线,将第59条对医疗机构的负面影响最小化是需要思考的一个问题。在适用第59条时,有必要考虑到医疗服务的特殊性质和医疗机构在现有医疗体制中的两难处境,在具体案件中做具体分析具体对待,不过分加重医疗机构的责任承担。与此同时,有必要发挥第59条的威慑力和正面规范功能,使其成为医疗机构“医药分家”改革乃至国家整个医疗体制改革的“推动器”,而不是旧体制的“固化剂”。
首先,在患者使用医疗产品过程中,由于医疗产品的使用是医疗服务不可分割的一部分,患者与医疗机构距离最近,且关系最直接,医疗机构当然处在了患者表达诉求和伸张正义的最前沿。但是,应当认识到,医疗产品的质量建设是一个系统工程,其中不仅包括医疗服务提供者的积极参与(如不良反应报告制度),而且包括政府部门上市前和上市后的强有力的监管,当然更离不开医疗产品研发部门和生产企业的硬实力和责任心。我国应注重每个环节的建设,包括政府层面的环节在内,并要求其承担相应的责任,而不是通过简单地将医疗机构置于医疗产品责任之下给本身已处于水深火热之中的医患关系再添一把“助燃剂”。与此同时,通过监管,应强化医疗产品责任承担主体——生产商和销售商——的生产经营能力和责任承担能力,以避免医疗机构在承担赔偿责任后追偿权的落空。
其次,在解释第59条时,立法者和司法者应释放并强化医疗机构在医疗产品责任中只承担过错责任这样一条信息。医疗产品责任的首要的而且主要的承担主体是医疗产品生产商。医疗机构在其中扮演的角色更多的应是提供生产商信息、辨明生产商和代为赔偿的作用。应降低患者和公众在医疗产品责任归属和承担上对医疗机构的过高期望,降低医疗机构在其中承担的过重负担。相较于美国法中的让医疗服务提供者免于医疗产品责任和英国法中的医疗服务提供者只有条件地承担“指明产品生产者”责任,不分情况地让医疗机构与生产商承担连带责任,对医疗机构来说实属负担过重。
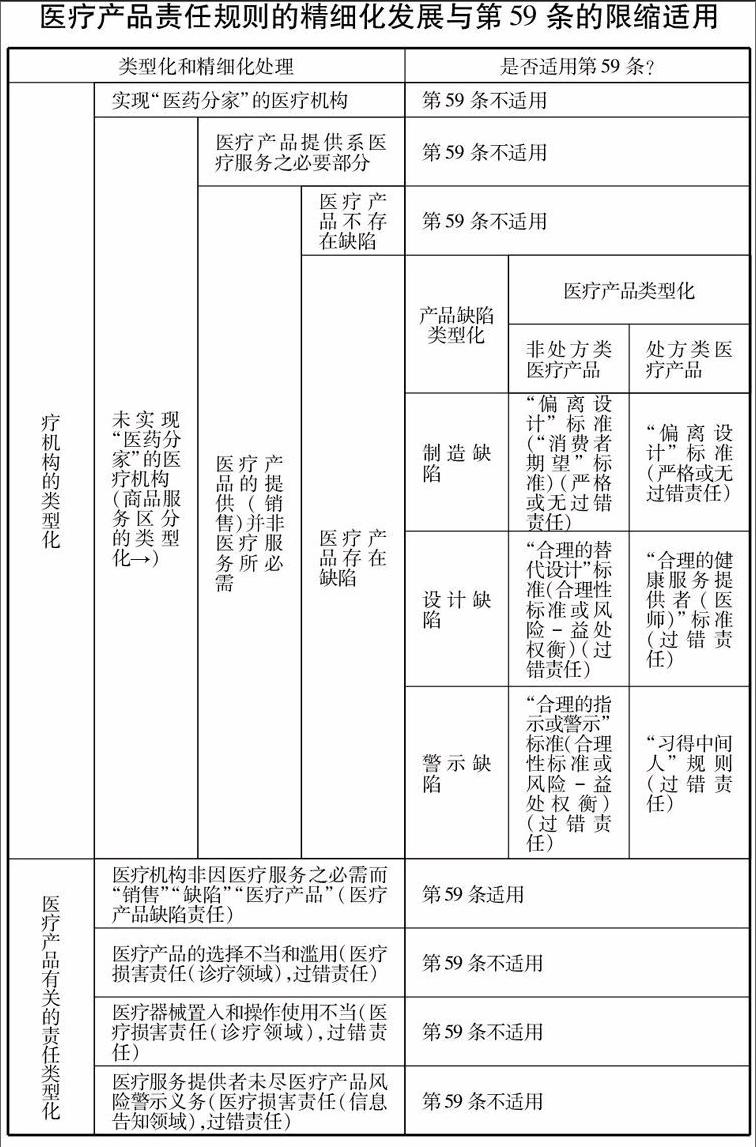
再次,在适用第59条时,应通过区别情形和类型化等技术手段,细腻地反映具体案情,将第59条适用于较为适宜的情境,尽量减少第59条对医疗服务提供的负面影响,让其服务于并促进新医疗改革大局。在这方面,应考虑到医疗机构的类型、商品销售在医疗机构中提供服务的必要程度、产品缺陷的类型、医疗产品的类型和与医疗产品有关的责任类型。医疗机构的类型不同、商品销售在医疗机构中提供服务的必要程度不同,适用第59条的可能性是不同的。医疗产品“缺陷”责任和与医疗产品有关的“医疗损害责任”也是不同的。产品缺陷的种类不同,医疗产品的种类不同,缺陷判定的标准和所适用的归责原则也是不同的,所传递的信息也是不同的。关于在医疗产品责任领域医疗机构的类型化和商品服务区分的类型化处理,我国学者已有涉及。有同仁主张在适用第59条时区分营利性医疗机构与非营利性医疗机构,并考虑医疗产品与医疗服务联系的紧密程度。(参见 杨立新, 岳业鹏. 医疗产品损害责任的法律适用规则及缺陷克服:“齐二药”案的再思考及《侵权责任法》第59条的解释论[J]. 政治与法律, 2012 (9): 120-121)本文在此略述。关于产品缺陷的类型化、医疗产品的类型化和与医疗产品有关的责任的类型化,我国鲜有系统的、详细的论述,本文将多着些笔墨。
(一)医疗机构的类型化
在适用第59条时区分公立医院和私立医院反映了我国的这样一个现实:我国的公立医院以非营利为运营宗旨、是我国新医疗体制改革(包括“落实政府办医责任”、 “扭转逐利行为”、 “推进医药分开,逐步取消药品加成政策”)的目标群体,而私立医院营利性和市场化较强,尚未纳入到以倡导公益性为主调的政府主导型医疗体制改革中来。但笔者认为,如果公立医院和私立医院均未实现医药分家和医疗产品零加价政策,仅从姓“公”姓“私”的名分上或从是否承载着基本医疗保障之重任上来区别对待公、私立医院而适用第59条,说服力并不强,尽管从公共政策上考虑法律似乎更不应将肩负重任的公立医院置于产品责任风险之下。但是,如果公立医院通过新一轮医疗改革已摆脱了产品销售者身份,而私立医院仍以销售医疗产品作为其获取利润的主要手段或手段之一,在适用第59条对二者进行区别对待的理由则较为充分。
不过,从长远考虑,笔者对此处的公、私立医院的区分提出点保留。尽管我国目前的医疗体制改革从政策文件表达上看只限于公立医院,但应该看到,“医药分家”这一要求具有明显的正面价值和普适性,它应是整个卫生事业发展的内在要求,因此,它应波及到所有医疗服务提供者,包括私立医院。其实,基于医疗资源的有限性,私立医院的发展会强夺有限的医疗资源,并加强贫富差距和不公平。如若想建立一个真正由政府主导的、以资源配置和成本控制为核心内容、以实现医疗服务提供的可及性和公平性为目标的基本医疗保障体系,大力发展针对大众的公立医疗服务和基本医疗保险制度而不是针对富人的私立医疗服务和商业医疗保险才应是发展方向。令人警觉的是,我国目前已经出现了在医疗服务的提供方面穷人利用不足(通过基本医疗保险制度)和富人过度利用(通过购买和享受各种补充医疗和商业医疗保险)的冲突和矛盾[3]。这影响了医疗服务提供的公平性。因此,在我国的新医疗体制改革中,应注重树立公立医疗服务的主导,甚至是绝对性主导地位,并通过第59条的适用使私立医院加入到“医药分家”的行列中来。
就公立医院来说,在适用第59条时,还应区分已经取消药品加价、彻底实现“医药分家”的公立医院和尚未摆脱“医药不分”、仍以“销售者”身份面世的公立医院。我国的“医药分家”改革是在试点和总结经验的基础上逐步推开的。公立医院也不是千人一面,在法律负担和待遇承受上也不应是铁板一块。就已实现“医药分家”的公立医院来说,有必要让其体验到第59条得以免除适用的轻松和益处,从而坚定其对新体制的信心;而对那些尚未实现“医药分家”的公立医院来讲,也应让其感受到因适用第59条而缠入医疗产品责任诉讼之累,从而产生“医药分家”的压力和动力。
(二)商品、服务区分的类型化
在适用第59条时考虑商品销售在医疗服务提供中的比重和必要程度有利于防止医疗机构滥用服务——商品区分理论,防止医疗机构以提供医疗服务为名行销售医疗产品之实。人们有理由认为,医疗机构的医疗产品销售在服务提供和商品销售的复合行为中的比重越大,将医疗机构视为销售者从而适用第59条的必要性越大,因为医疗机构有可能借助医疗服务大行医疗产品销售之道。但是,商品销售在医疗服务提供中的比重只能是考虑适用第59条的因素之一,不应是决定性因素。相较之下,司法者更应考虑医疗产品提供(销售)在医疗机构提供医疗服务中的必要性。如果产品提供是医疗服务必不可少的一部分,就有必要将医疗机构的行为定性为服务,从而排除第59条的适用。如果医疗产品的提供(销售)并非医疗服务所必需,或者说医疗机构是在提供医疗服务名义下销售医疗产品,那么医疗机构的行为便可定性为产品“销售”行为,可以适用第59条。此种区分有利于促使医疗机构将中心放在医疗服务的提供上,克服“医疗”活动“服务于产品销售”的趋向。
(三)产品缺陷的类型化
产品存在“缺陷”是产品责任,包括医疗产品责任的一个核心构成要件和责任追究的起始点。关于产品“缺陷”,我国《侵权责任法》并没有对其给出定义。不过,我国《产品质量法》(2000年)第46条提供了“缺陷”的定义。它系指“产品存在危及人身、他人财产安全的不合理的危险;产品有保障人体健康和人身、财产安全的国家标准、行业标准的,是指不符合该标准。” 具体到医疗器械缺陷,系指医疗器械在正常使用情况下存在可能危及人体健康和生命安全的不合理的风险。参见《医疗器械召回管理办法(试行)》第4条。判定产品缺陷的主导性标准是“不合理的危险”标准。产品“缺陷”通常分为制造缺陷/生产缺陷、设计缺陷和警示/指示缺陷。我国学术界对于上述分类已基本认可,但是我国立法未加以规定,我国产品缺陷的判定标准是一个单一的标准,没有区分产品缺陷的不同种类和产品的不同种类,没有灵敏地反映不同种类缺陷和不同种类产品的特点和需求,是一种单一化、一刀切的处理方式,需要改进和精细化。在此方面,美国《侵权法重述·第三次·产品责任编》很突出的一个特点是一改原先的一体化和一元化处理方式原有的美国《侵权法重述·第二次》第402A条实质上针对的只是制造缺陷,它不太适合于设计缺陷和警示缺陷领域。,将产品缺陷做了具体分类,并根据不同种类的缺陷给出了不同的认定标准。美国法对缺陷的分类和定义似乎对我国法学理论有重大借鉴价值比如,有学者在介绍产品缺陷的分类时,援引了美国《侵权法重述·第三次·产品责任编》中的分类和定义。(参见:高圣平.《中华人民共和国侵权责任法》立法争点、立法例及经典案例[M]. 北京: 北京大学出版社, 2010: 499-500.),有引鉴的必要。
美国《侵权法重述·第三次·产品责任编》第2条将产品缺陷分为制造缺陷(manufacturing defect)、设计缺陷(defective in design)和因为指示或警示不充分而产生的缺陷(defective because of inadequate instructions or warnings)。其中,“制造缺陷”是指“产品偏离了设计意图,即使在该产品的制备和营销过程中已经行使了所有可能的注意。”Restatement of the Law, Third, Torts: Products Liability, § 2 (a). 而如果一种产品所产生的可预见的损害风险(foreseeable risks of harm)可以通过一种合理的替代设计(a reasonable alternative design)得以减少或避免,而这种替代设计的缺失使得产品不具有合理安全性(not reasonably safe)时,那么该产品则存在“设计缺陷”。Restatement of the Law, Third, Torts: Products Liability, § 2 (b).这推出了判定“设计缺陷”的“合理的替代设计”标准。同样,如果一种产品所产生的可预见的损害风险可以通过提供合理的指示或警示(reasonable instructions or warnings)加以减少或避免,而这种指示或警示的缺失使得产品不具有合理安全性,那么该产品就存在“警示缺陷”。Restatement of the Law, Third, Torts: Products Liability, § 2 (c).这又简称为判定警示缺陷的“合理的指示或警示”标准。
制造缺陷是对产品设计标准或规格的背离,它通常会使“消费者的期望”落空Restatement of the Law, Third, Torts: Products Liability, § 2, Comment c.,因此使用传统的“消费者期望(consumer expectations)”标准判定制造缺陷也不存在问题。但是,在判定产品缺陷方面,“消费者期望”标准并不是一个确定性的标准。设计缺陷和警示缺陷有自己不同的判定标准。
设计缺陷的判定启用的是“合理性(reasonableness)”或“风险—益处权衡(risk-utility balancing)”标准。Restatement of the Law, Third, Torts: Products Liability, § 2, Comment d.它要看一个合理的替代设计是否能够以合理的成本减少产品中可预见的损害风险,以及这样一个替代设计的缺失是否使得产品成为不合理安全之物。这就需要将可替代设计和导致损害的设计做一比较,这一比较是以合理人的视角来进行的。这非常类似于过失侵权法中所启用的传统“合理性”标准。在决定是否存在一个合理的替代设计以及这样一个合理的替代设计是否会使产品不具有合理安全性时,需要考虑一系列相关因素,比如:(1)可预见的损害风险的严重程度和可能程度;(2)产品上的警示或指示;(3)消费者期望的性质和强度;(4)现有产品设计与可替代产品设计各自的优势和不足;(5)替代设计对生产成本、产品寿命、产品维持、产品维修和产品美观的影响;(6)消费者的产品选择范围大小。Restatement of the Law, Third, Torts: Products Liability, § 2, Comment f.
美国侵权法重述中警示缺陷的定义同样启用的是“合理性”标准和“风险—益处或成本—益处权衡”。在判定产品警示的充分性时,法院需要考虑一系列因素,如产品的目标用户群体的特性、语言表达的内容、可理解性和强度。Restatement of the Law, Third, Torts: Products Liability, § 2, Comment i.当存在一个“中间人(intermediary)”(即处于减少或避免损害风险之位置的人)时,关于产品的警示是通过中间人来转述还是需要直接向最终产品使用者做出这一问题,法律上并没有一般的规则,需要根据“合理性”标准来判断。这需要考虑以下因素:(1)产品风险的严重程度;(2)中间人将产品信息传送给最终用户的可能性;(3)直接向最终用户做出警示的可行性和有效性。Restatement of the Law, Third, Torts: Products Liability, § 2, Comment i.产品的警示既可以使消费者意识到产品风险的存在并通过妥善的使用或消费“减少”损害风险,也可以使消费者做出不购买或不使用产品的知情决定从而“避免”损害风险。在后一种情形中,可合理预见的产品用户和消费者在决定是否使用或消费该产品时合理地认为具有“实质性(material)”或“重要性(significant)”的风险信息即是需要警示的信息。Restatement of the Law, Third, Torts: Products Liability, § 2, Comment i.
从美国《侵权法重述·第三次·产品责任编》对产品缺陷的分类定义和相关评论来看,严格责任只无条件适用于制造缺陷,而不管生产者是否已尽了注意义务。对于设计和指示缺陷,生产者只对“可以预见的损害风险”负责,而这种风险是本可以通过采取“合理的替代设计”或“合理的指示”来避免的。三种缺陷中,只有“制造缺陷”彻底坚守了产品责任的“严格”性,它否定了生产者和销售者在产品的制备和营销过程中已经行使了所有可能的“注意”的相关性,是一个不考察当事人过错(注意义务之违反)的概念。但是,“设计缺陷”和“警示缺陷”定义中的逻辑则有所不同。“设计缺陷”和“警示缺陷”问题往往出现在产品并没有偏离“设计”(即没有制造缺陷),但是“设计”本身,或者产品的营销(没有警示或指示)本身,使产品不具有合理安全性这样一种场合。它的规则与适用于“制造缺陷”的规则是不一样的。尽管许多法院坚持认为“设计缺陷”和“警示缺陷”所适用的标准仍然是“严格”标准,这两种缺陷的定义实际上借用的是过失侵权法中的“合理性”测试标准。Restatement of the Law, Third, Torts: Products Liability, § 1, Comment a.这表明,在设计缺陷和警示缺陷领域,法律在向过错责任归责原则靠拢。只有制造缺陷领域才是严格坚守无过错责任原则或严格责任原则的一隅。
设计缺陷和警示缺陷之不同标准的建立是有原因的。相较于制造缺陷,设计缺陷和警示缺陷是一个相对较新的领域。传统的标准和严格责任适用于新领域也未必适宜。另外,在制造缺陷领域,消费者相对无助,适用严格责任较为妥当。但是,在设计和警示缺陷领域,消费者可以通过安全的使用和消费来降低产品风险,不同标准的建立有利于促进消费者安全地使用和消费产品。
实际上,美国《侵权法重述·第三次·产品责任编》对产品缺陷的定义和对产品缺陷责任的规定是功能性的(functional),它没有过分沉溺于对传统侵权法类型和原则的依附和纠缠。比如,美国《侵权法重述·第三次·产品责任编》第2条试图建立的是对不同产品缺陷类型的统一的、协调一致的定义。只要这些定义中的产品缺陷标准被满足了,原告就可以在任何侵权类型(如过失责任或严格责任)下,甚至可在“对适销性的默示担保(implied warranty of merchantability)”名目下提起诉讼。Restatement of the Law, Third, Torts: Products Liability, § 2, Comment n.
美国法中将严格责任只限于制造缺陷领域,而将设计缺陷和警示缺陷置于过错责任原则下考虑的景象会在其他法域重现。比如,欧盟的缺陷产品责任指令Council Directive of 25 July 1985 on the approximation of the laws, regulations and administrative provisions of the Member States concerning liability for defective products (85/374/EEC), Article 6.和英国的《消费者保护法案》Consumer Protection Act 1987 (Eng), Section 3 (1).在定义“缺陷”时均采用了类似“消费者期望”的标准,即产品缺陷指的是产品的安全没有达到人们通常有权期望的程度。但是,在判定产品缺陷时,会考虑到诸多情形,这包括:(1)产品投放市场的方式和目的;(2)产品的外包装;(3)是否存在指示或警示;(4)产品的可合理期望的用途;(5)产品投放市场的时间。Council Directive of 25 July 1985 on the approximation of the laws, regulations and administrative provisions of the Member States concerning liability for defective products (85/374/EEC), Article 6; Consumer Protection Act 1987 (Eng), Section 3 (2). 这些因素的考量很可能导致在设计缺陷和警示缺陷领域,法院会使用过失(negligence)侵权原则,进行成本—收益分析[29]。比如,如果一个产品的风险可以通过不同的设计减少或避免,在判定产品的设计缺陷时,法院定会将产品的风险与其益处做一权衡,最终的问题转换成了将含有某种设计的产品投放市场是否是“合理”的。这些导入的均是判定过失的规则。
在产品责任法(包括医疗产品责任法)精细化的过程中,我国有必要跟进这种区别不同缺陷类型适用不同判定标准的发展趋势。产品责任法所处的已经不再是严格责任一统天下的年代。制造缺陷与设计缺陷和警示缺陷不同判定标准的设置,特别是过错责任原则在设计缺陷和警示缺陷领域的浸入和渗透,对产品生产者和销售者来说无疑是一种利好。具体到我国现有的医疗产品责任法(第59条),这种产品缺陷种类上的区分以及区分的效果也会使得与产品生产者承担连带责任的医疗服务提供者的责任相应减轻。由此,此种区分有利于减轻机械地适用第59条对医疗机构所产生的负面影响。
(四)医疗产品的类型化
1医疗产品与血液
我国《侵权责任法》第59条所建立的规则,虽然名义上或出于方便的目的称之为“医疗产品责任”,但其实际上涵盖两类物品:一是医疗产品(药品、消毒药剂、医疗器械),二是血液。血液提供机构和医疗机构就“不合格的血液”所承担的侵权责任,是不是应该与医疗“产品”责任为伍,值得讨论。两者均为医疗所涉物品,但定性和规则并不相同。
美国法明确地将“人类血液和人类组织器官”(即使是属于商业性提供的)排除在“产品”概念之外Restatement of the Law, Third, Torts: Products Liability, § 19 (c).,从而远离了产品责任法和严格责任。“血液”的提供被视为一种“服务”,从而将对血液提供者的责任追究限定在了是否违反合理注意义务上。Restatement of the Law, Third, Torts: Products Liability, § 19, Comment c.在英国法中,尽管人体组织器官和人体血液似乎符合《消费者保护法案》中的“产品”构成要件要求,但是,在英国司法中,也存在着一种“服务/货物两分(service/goods dichotomy)”的概念,医疗机构的血液提供被认为是医疗和专业技能判断的一部分,从而被认为是一种“服务”而不是货物提供[30]。加拿大最高法院也传递出了人体组织不是商品的信息,认定医疗服务提供者实施人工授精的合同系一份医疗服务提供合同,而非精子销售合同[31]。这些对人体组织和血液的特殊对待多是基于其对社会具有巨大用益以及属于不可替代物和不可或缺物的考虑。
我国《侵权责任法》第59条虽然触及到了“不合格血液”所导致损害的责任承担,但此条并没有回答对于“合格”但仍存在污染的血液(比如因处于窗口期无法查出血液中所含病毒)所造成的患者损害如何赔偿的问题,即该条没有回应在血液提供机构和医疗机构均无过错的情况下因“合格”血液导致感染的情形。在此问题上,全国人大法工委在其对《侵权责任法》的解释中只谈到了在此种情形之下如何承担责任上学界与司法界的争议。(参见:全国人大常委会法制工作委员会民法室.《中华人民共和国侵权责任法》条文说明、立法理由及相关规定[M]. 北京: 北京大学出版社, 2010: 239-242.)因此,可以讲,我国法并没有在血液提供领域肯定无过错责任的适用。就血液提供机构的责任而言,它是建立在考察血液提供机构是否违反注意义务之上的过错责任。我国在侵权法中使用了“不合格”这个行政管理味道很浓的术语。“不合格”应指“不符合标准”。它是一个指向法律、法规、规范、质量标准和操作规程的概念,而不是看当事人是否违反合理注意义务。因“不合格血液”所产生的损害赔偿责任指向的是血站和医疗机构在血液采集和临床用血过程中“未按照有关法律、法规和规范的要求操作”而导致输血感染这一情形。(参见 全国人大常委会法制工作委员会民法室.《中华人民共和国侵权责任法》条文说明、立法理由及相关规定[M]. 北京: 北京大学出版社, 2010: 239-240.)这就产生了一个问题,即在过错认定中是绝对地以标准和操作规范为准,还是只将它们作为重要参考?也就是说,过失认定判准是“合理注意义务违反”标准还是“操作规范”标准?同样,关于医疗机构就输入“不合格的血液”所产生的民事侵权责任,也是围绕是否违反注意义务而展开的过错责任讨论。它们均不同于医疗产品责任以及严格责任或无过错责任在其中的运用。这与域外将血液提供视为“服务”从而适用过错责任的做法是一致的。这说明,人体的“血液”不同于通常的“医疗产品”。人体的“血液”上建立的侵权责任不同于产品责任,二者利益考量和归责原则不同。
2非处方类医疗产品与处方类医疗产品
非处方类医疗产品与处方类医疗产品在缺陷判定标准上的区分也见于美国法。美国《侵权法重述·第三次·产品责任编》第2条的适用范围是一般产品,包括非处方药。但是,对于处方类医疗产品,美国《侵权法重述》将其挑出来单独规定了不同的规则,即第6条。此时,对于处方类医疗产品,第2条将不再适用。对于处方类药品和医疗器械的制造缺陷,在界定上与一般的产品制造缺陷定义并无二致,制造缺陷责任的承担与其它产品也没有不同,无需再述。但是,对于设计缺陷和警示缺陷,处方类药品和医疗器械拥有其自己的定义。
(1)处方类医疗产品的设计缺陷
根据美国《侵权法重述·第三次·产品责任编》第6(c)条,处方类药品和医疗器械的“设计缺陷”指的是,“如果药品或医疗器械所产生的可预见的损害风险,相较于其可预见的疗效,系足够巨大,以致于合理的健康服务提供者在知道此种可预见的风险和疗效后不会向任何一类患者开处该药品或医疗器械,那么该处方药品或医疗器械将因设计缺陷而不具有合理安全性”。Restatement of the Law, Third, Torts: Products Liability, § 6 (c).也就是说,除非处方医疗产品的设计达到了一位合理的医师不会对“任何”种类的患者开处的程度,该类产品的设计不能认为具有缺陷。此定义推出的是测定处方医疗产品的设计缺陷的“合理的健康服务提供者”或“合理医生”标准。相对来说,此标准是比较容易满足的。
处方类医疗产品设计缺陷的认定也是一个风险和疗效权衡的过程。在此定义之下,生产者只需证明,对某一类患者来说,产品的益处大于损害,因此一位合理的医生会开处此药即可,而无需证明是否存在更好的替代设计使产品变得更合理地安全。因此,处方类医疗产品设计缺陷的界定标准(益处大于损害风险)不同于一般产品(包括非处方药)的设计缺陷的界定标准(是否存在更加安全的替代设计)。由此形成了非处方药与处方药分别适用不同的缺陷设定标准(即第2条和第6(c)条)的局面。
第6(c)条背后体现的政策考量是,应该保证一种处方药向那些在医生看来属于受益群体的某类患者群体的供应。Restatement of the Law, Third, Torts: Products Liability, § 6 (c) Comment f.只要某种处方药对某一类患者具有净益处,就应该向这些患者维持该药的可及性。应依靠医生(专业中间人)的判断来保证合适的药到达合适的患者人群当中。但是,如果在合理的专业中间人(医生)看来,某种处方药不会给任何群体的患者带来净受益,该种处方药就存在设计缺陷。
美国《侵权法重述·第三次·产品责任编》第6(c)条的前身是美国《侵权法重述·第二次》第402A条评论K——关于“不可避免地不安全产品(unavoidably unsafe products)”的评述。Restatement (2d) of Torts, § 402A, Comment K.“不可避免地不安全产品”主要是指在现有人类知识状态下就其用途来看不可能变得安全的产品。这类产品包括药品,特别是处方药、新药和试验性药物。根据评论K,对于此类产品,只要制备适当、警示适当,考虑到其带来的社会益处,不能仅因为存在风险(已知的但不可避免的风险)就认定其存在缺陷。“不可避免地不安全产品”的生产者和销售者应免于严格责任。评论K有鼓励创新之意。
在美国《侵权法重述·第二次》第402A条之下,认定一件产品是否存在设计缺陷的标准有两个:一是消费者期望标准。在美国的侵权法重述(第二次)中,“缺陷产品”是指具有“不合理危险的(unreasonably dangerous)”产品 (Restatement (2d) of Torts, Section 402A),而“不合理危险”则是指“危险程度超出了一位对产品特性拥有通常知识(ordinary knowledge)并购买产品的通常消费者(ordinary consumer)所料想的范围” (Restatement (2d) of Torts, Section 402A Comment i.)。即一个产品是否达到了一位通常的消费者所期望的安全程度。二是风险—益处(risk-utility)标准,即权衡产品的设计风险与益处。与上述两个标准相对,美国《侵权法重述·第二次》第402A条评论K给处方药的缺陷认定提供了不同的标准,并形成了一种保护。为了促进药物创新,评论K实际上为处方药提供了免责(免于严格责任)机制。
尽管二者的政策考量相近,在处方药的设计缺陷认定方面,相较于美国《侵权法重述·第二次》第402A条评论K,美国《侵权法重述·第三次·产品责任编》第6(c)条有以下改进:一是,在进行风险益处平衡时,它面向的不是所有种类的患者(all classes of patients),而是某一种类的患者(any class of patients)。这就避免了尽管某一种药对某一类患者有益,但因对所有患者不一定是益处大于风险而被认定为具有缺陷从而被逐出市场这样一种局面的产生,从而保证了某种药物对某类患者的可及性。二是,在第6(c)条下,这种风险益处平衡的主体是合理医生,而不是陪审团或法官。在判定是否存在设计缺陷时,第6(c)条依赖的是“合理医生(reasonable physician)”的判断。第6(c)条考察的中心内容是一位“合理医生”在知晓药物的风险和益处后是否会向任何一类患者开处此药。如果它会开处此药,则说明该药具有可以受益的患者群体,说明此药对该类患者来说比其它替代药物更为有益,就不应被认定为具有缺陷从而遭受被逐出市场之运。三是,在决定是否有比所涉药品设计更安全的替代设计上,评论K可能会允许陪审团或法院将所涉药品的设计与尚未得到药监部门许可、尚未上市的、试验性的、所谓“更安全的”替代设计相比较,从而认定药品存在缺陷,但是第6(c)条不允许做这种比较。第6(c)条聚焦的是一位合理医生是否会开处所涉医疗产品。医生在做决定时,当然会考虑到替代设计的风险和益处,但是含有这些替代设计的医疗产品须是已获药监部门许可的,因而是可以开处的。总之,相对于评论K,第6(c)条是一种对新药研发和上市更为有利的条款设计。
尽管遭遇到了一些批评,称其对既定规则的偏离过大,第6(c)条并没有形成对评论K严重的偏离,而是对其进行了改善以更好地实现评论K之主旨。首先,第6(c)条并没有抛弃传统的风险—益处分析方法,这种风险—益处分析被揉进了合理健康服务提供者对是否开处所涉药品的分析判断当中。第6(c)条所涉及的关键问题是,“客观来看,合理的健康服务提供者,在知道某一药品或医疗器械的可预见的风险和益处后,是否会向某一类患者开处此医疗产品”。Restatement of the Law, Third, Torts: Products Liability, § 6 (c) Comment f.其次,第6(c)条也没有拒绝“更安全的替代设计”标准。第6(c)条所涉及的风险—益处分析不是独立进行的,它要考虑有无其他更安全的替代医疗产品。第6(c)条更加明确了处方医疗产品的设计缺陷判定是个案认定,而不是地毯式的一概豁免。第6(c)条的好处在于它有利于鼓励对人类健康带来益处的处方产品的供应,保证其可及性。正如一位法官所言,“如果某一处方药因对某类患者有益而不被认定为缺陷产品从而被保留在了市场,这使得,在拒绝将此药提供给可能受害的患者的同时,让从中可获益的患者可以获得该处方药。”[32]关键的问题是,需要医生行使专业判断和把关让正确的药到达正确的人手中。
(2)处方医疗产品的警示缺陷
根据美国《侵权法重述·第三次·产品责任编》第6d条的规定,处方类药品和医疗器械的“警示缺陷”指的是,“如果有关可预见的损害风险的合理指示或警示未向下列人员提供,一处方药或医疗器械将因指示或警示不充分而被认为是不合理安全之物:(1)处方医疗人员和其他健康服务提供者,当他们处于根据指示或警示减少损害风险的位置时;或 (2)患者,当生产商知道或有理由知道健康服务提供者不处于依据指示或警示减少损害风险的位置时。”Restatement of the Law, Third, Torts: Products Liability, § 6 (d).根据对第6条的评论,Restatement of the Law, Third, Torts: Products Liability, § 6 (d), Comment a.6(d)(1)规定了传统的“习得中间人或专业中间人(learned intermediary)”还有翻译为“博学的中间人”者。 (参见:美国法律研究院. 侵权法重述第三版:产品责任[M]. 肖永平,龚乐凡, 汪雪飞. 译, 北京: 法律出版社, 2006: 207-208.)原则,即只有当生产商未能向健康照护的提供者警示产品的风险,它才对未尽产品风险警示义务负责。 根据该评论,6(d)(2)对该传统规则设置了有限的例外,要求生产商在特定情况下向患者尽警示义务。至于“习得中间人”的规则是否适用于处方药品的直接市场营销(direct marketing)或者直接面向消费者的广告宣传(direct-to-consumer (DTC) advertising)场合,重述则无明确规定。在司法实践中,有法院认为,在药品生产商面向消费者的直接促销和营销活动对消费者的药品选择产生了强有力的影响以致于处方医师作为风险评估和药物使用决定者的角色减弱或丧失殆尽时,“习得中间人”规则不再适用,药品生产商需要对消费者直接尽药品的危险警示义务。在Perez v. Wyeth Laboratories Inc., 161 N.J. 1, 734 A.2d 1245 (N.J. Aug 09, 1999)案中,新泽西州最高法院认为,直接面向消费者的药品广告改变了“习得中间人”原则的变量。适用“习得中间人”原则的理论根据和前提在向消费者的直接广告中几乎不存在。在生产商的市场营销旨在影响患者对药品的选择时,直接向消费者做药效承诺的药品生产商不应不受限制地免除其对产品的危险和副作用提供适当警示的义务。法院认为,在此种场合,医师选择决定处方药的角色已经变化,由于生产商面向消费者的直接广告的攻势以及其提供的信息的影响,患者对治疗方法的事先期望增强,有时医师不得不屈从于患者的选择和意志。因此,在适用“习得中间人”规则时,患者是否对专家(医疗服务提供者)的专业判断存在依赖是一重要考量因素。
习得中间人/专业中间人可能是开处方药的医师、指导患者用药的护士,或配方的药剂师,但通常是处方医师。法律之所以设置“习得中间人”规则,是因为:“处方药有可能是复杂的药物,在组方上使人难以理解,在效果上也千差万别。作为一位医疗方面的专家,处方医生可以考虑药物的特性和患者的过敏状况。这需要将药物的益处与潜在危险做权衡。他所做出的选择是知情下的选择,是一个个体化的医学判断,此判断是以对患者和疗法的认知为基础的。”[33]适用“习得中间人”原则的理论根据和前提在于:(1)法院不愿侵入医患关系,(2)医师在向患者传送有意义信息从而确保知情同意方面具有优势地位,(3)药品生产商在与患者直接交流方面缺乏有效的手段,(4)处方药风险信息具有复杂性。
一般认为“习得中间人”规则是药品生产者向用户尽警示义务这一般性原则的例外。它豁免的仅是药品生产商对最终消费者的警示义务,而不是对习得中间人的警示义务。“习得中间人”必须是“习得”的。因此,处方药的制造商有义务向处方医师尽药品危险的充分警示义务。 “习得中间人”规则在美国《侵权法重述·第三次·产品责任编》第6d条中是原则,在一般法中是例外。“原则”和“例外”的定性,只系因其所处的情景不同而已,规则本身并没有不同。
有理由相信,“习得中间人或专业中间人”规则在英美法系国家中会得到青睐和推广,因为它是古老的普通法原则——“中间审查(intermediate examination)”原则[34]——的逻辑延伸。这一规则一般适用于具有高度的专业性因而只能在专家指导下才可使用的产品。在这种情况下,消费者主要会依赖“专业中间人”的判断。这一规则已经在加拿大司法中被加拿大最高法院所采用[35]。它也受到了英国学者[25] 1617和新西兰学者[29] 292的垂青。
总之,由于处方类医疗产品相较于非处方类医疗产品风险较大、风险益处较为复杂,且需要医疗服务人员的专业判断的介入和干预,因此在设计缺陷和警示缺陷的判定上将二者加以区分是有正当性基础的,也是必要的和值得借鉴的。从美国法重述的文字表述看,特别是从“可预见”的损害风险、权衡“可预见”的“风险和疗效”、有关“可预见”的损害风险的“合理”指示或警示、“合理”的健康服务提供者等术语的启用来看,处方类医疗产品的设计缺陷和警示缺陷的判定运用的也是“过失”侵权法的思维,显现的也是向过错责任原则的回归。但是,相较于非处方类医疗产品,处方类医疗产品设计缺陷和警示缺陷的判定更多地邀请了处方者——医疗服务提供者(医生)——的参与。医疗服务提供者及其专业判断在处方类医疗产品设计缺陷和警示缺陷的判定中发挥着核心作用。具体讲,处方类医疗产品设计缺陷的判定有赖于医疗服务提供者对医疗产品风险益处和具体患者病情的判断和权衡,而在处方类医疗产品警示缺陷的判定中,由于医疗服务提供者往往处于从事风险和益处评估减少风险的专家位置和受信赖的位置,医疗服务提供者便成为了生产商警示义务的对象。总体来看,尽管具有一体性和相通性,相较于非处方类医疗产品,处方类医疗产品设计缺陷和警示缺陷的判定标准对产品的生产商和销售商更为有利。它充分考虑了处方类医疗产品的可及性、特性和复杂性。同样,这种医疗产品类型上的区分也会产生缓解在我国医疗产品责任法(第59条)下与生产商承担连带责任的医疗机构之责任的效果。
(五)与医疗产品有关的责任类型化
我国应区分医疗产品缺陷责任法和医疗损害责任法。此处的医疗损害责任法指的狭义上的(不包括医疗产品责任)、主要专注于诊疗领域和信息告知领域、以过错责任原则为主导原则的医疗损害责任法。医疗产品缺陷责任法和医疗损害责任法的区分可以使医疗服务提供者在某些情形之下免于产品缺陷责任的困扰。有三种情形,应当适用诊疗和信息告知领域的医疗损害责任法,而不是医疗产品责任法:
一是医疗产品的选择不当和滥用。在医疗服务中,医生应对,由于专业技术或专业判断欠佳,或出于经济利益驱动,所导致的医疗产品的选择不当和滥用承担责任。不过,这种责任不是产品缺陷责任,而主要是在诊疗领域医生因违反注意义务所产生的责任,是一种医疗服务提供方面的过错责任,可以适用我国《侵权责任法》第54条(过错责任原则)、第57条(过错判定和医疗水平论)和第63条(过度诊疗之禁止),而不是第59条。
二是医疗器械置入和操作使用不当。患者遭受医疗产品所害,既可能是产品缺陷的原因,也可能是医生的医疗技术失误,如医疗器械置入和操作使用不当。这里就要区分产品缺陷责任和医生因违反注意义务而产生的在诊疗中的过错责任。前者适用医疗产品责任法(第59条),后者可以适用《侵权责任法》第54条(过错责任原则)和第57条(过错判定和医疗水平论)。
三是未尽医疗产品风险警示义务。医生对医疗产品的风险还有一个信息告知或警示的义务,此项注意义务的违反所导致的也是一个过错责任,只不过发生在信息告知领域,可以适用《侵权责任法》第54条(过错责任原则)和第55条(信息告知义务),而不是第59条。此项医疗机构违反告知义务的责任(过错责任)不同于药品生产商的警示缺陷责任(适用产品责任法,比过错责任严格)。即使存在“习得中间人”这样一个规则,也并不意味着医疗服务提供人员应在处方药上承担警示缺陷责任。在“习得中间人”这一规则之下,医生是否开处了药品以及是否告知了药品的信息是在医生的“过失侵权”法律构架下讨论的[25] 1617。 “习得中间人”规则仅是药品生产商警示义务的一种例外。由于“习得中间人”的存在,药品生产商向“习得中间人”尽药品风险的警示义务即可。它处理的是药品生产商与“习得中间人”在警示义务上的一种关系。它并没有处理医疗服务提供者与患者之间的关系。医师针对患者的药品风险警示更宜在医师的告知义务或知情同意法则之下进行考察。对医师告知义务或信息披露义务之违反的考察适用的是同诊疗领域一样的过错责任原则。要判定医师是否违反了医疗服务提供领域的信息告知义务,要考虑医师是否有过错,既要考虑合理医生之所为和行业做法,更要考虑个体患者的信息需求。这是传统的知情同意法则的一部分。
医疗产品责任规则的精细化发展与第59条的限缩适用
类型化和精细化处理 是否适用第59条?医疗机构的类型化 实现“医药分家”的医疗机构未实现“医药分家”的医疗机构
(商品服务区分的类型化→) 医疗产品提供系医疗服务之必要部分医疗产品的提供(销售)并非医疗服务所必需 医疗产品不存在缺陷医疗产品存在缺陷 第59条不适用第59条不适用第59条不适用产品缺陷
类型化 医疗产品类型化非处方类医疗产品 处方类医疗产品制造缺陷 “偏离设计”标准(“消费者期望”标准)(严格或无过错责任) “偏离设计”标准(严格或无过错责任)设计缺陷 “合理的替代设计”标准(合理性标准或风险-益处权衡)(过错责任) “合理的健康服务提供者(医师)”标准(过错责任)警示缺陷 “合理的指示或警示”标准(合理性标准或风险-益处权衡)(过错责任) “习得中间人”规则(过错责任)与医疗产品有关的责任类型化 医疗机构非因医疗服务之必需而“销售”“缺陷”“医疗产品”(医疗产品缺陷责任)医疗产品的选择不当和滥用(医疗损害责任(诊疗领域),过错责任)医疗器械置入和操作使用不当(医疗损害责任(诊疗领域),过错责任)医疗服务提供者未尽医疗产品风险警示义务(医疗损害责任(信息告知领域),过错责任) 第59条适用第59条不适用第59条不适用第59条不适用六、结语《侵权责任法》第59条反映了我国“医药分家”尚未到位的实然状态,它体现了立法者对医疗产品双重性的考虑以及对被认为是“弱势”消费者(患者)和占信息和专业优势的医疗服务提供者的利益的权衡。但是,它对应然状态的反映不足。它过于注重医疗机构在“销售”医疗产品这一表征,而没有对医疗服务区别于商品销售的特性给予充分考虑。我国的“医药分家”改革具有艰巨性和长期性。在医药尚未分离的时代,第59条具有存留价值和现实正当性。在医疗机构走向“医药分家”的进程中,与其狭隘地、机械地、不加区分地适用第59条从而将其演化为旧体制的“固化剂”,不如全面地、辩证地、区分地分析医疗机构的责任归属、使第59条细微地反映不同情形,将其转化为新体制产生和建立的“压力阀”和“推动器”。
既然第59条产生于“医药不分家”的体制,并在利益取舍中充满了对医疗机构“销售者”身份的考量,它的适用范围就应限定在仍以医疗服务提供者和“销售者”双重身份面对患者和公众的医疗机构,不管其是公立医院还是私立医院,特别是适用于那种并非为医疗服务所必需的产品“销售”行为。对于已经实现“医药分家”的医疗机构和产品提供确系医疗服务必要组成部分的医疗活动,第59条不宜再适用。这种适用上的限制有利于重塑第59条,使其接近“服务—商品区分”理论意欲达到的效果。
此外,即使医疗机构被置于第59条之下也并不意味着医疗机构将面临承担无过错责任或严格责任的厄运。这有赖于我国产品责任法的精细化发展和类型化处理。在设计缺陷和警示缺陷领域(不管是处方类医疗产品还是非处方类医疗产品)过错责任分析方法的引入以及在处方类医疗产品的设计缺陷和警示缺陷判定方面对该类产品特性的特殊照顾都改变了严格责任归责原则一统产品责任领域的局面。将设计缺陷和警示缺陷与制造缺陷区分开来,将处方类医疗产品与非处方类医疗产品区分开来,将医疗产品缺陷责任与医疗产品相关的、诊疗和信息告知领域的损害责任区别开来,不仅是法律规则细微化发展的需要,而且会在客观上拓展过错责任原则适用的范围,大大压缩产品生产者和销售者,进而我国《侵权责任法》第59条下的医疗服务提供者,被置于无过错责任的可能和空间。ML
参考文献:
[1] 赵西巨. 我国《侵权责任法》中的医疗产品责任立法之反思:以商品与服务二分法为视角[J]. 东方法学, 2013,(2).
[2] 卫生部, 财政部, 国家劳动总局. 关于加强医院经济管理试点工作的意见的通知[(79)卫计字第579号][EB].1979.
[3] 梁鸿, 赵德余. 中国基本医疗保险制度改革解析[J]. 复旦学报: 社会科学版, 2007,(1): 128.
[4] 周幼曼. 对我国“新医疗改革”的几点思考[J]. 宏观经济, 2010,(1):3.
[5] 杨立新, 岳业鹏. 医疗产品损害责任的法律适用规则及缺陷克服:“齐二药”案的再思考及《侵权责任法》第59条的解释论[J]. 政治与法律, 2012,(9): 112-113.
[6] 王利明. 中国民法典学者建议稿及立法理由·侵权行为编[M]. 北京: 法律出版社, 2005: 269-272.
[7] 杨立新. 中华人民共和国侵权责任法草案建议稿及说明[M]. 北京: 法律出版社, 2007: 270-271.
[8] 王竹. 论医疗产品责任规则及其准用——以《中华人民共和国侵权责任法》第59条为中心[J]. 法商研究, 2013,(3): 61.
[9] Robert A. Sachs. Product Liability Reform and Seller Liability: A Proposal for Change [J]. Baylor Law Review, 2004,(55): 1032-1136.
[10] Hector v. Cedars-Sinai Med. Ctr., 225 Cal. Rptr. 595, 599–600 (Cal. Ct. App. 1986).
[11] Porter v. Rosenberg, 650 So. 2d 79, 82–83 (Fla. Dist. Ct. App. 1995).
[12] Goldfarb v. Teitelbaum, 540 N.Y.S.2d 263, 264 (N.Y. App. Div. 1989).
[13] Cafazzo v. Cent. Med. Health Servs., Inc., 635 A.2d 151, 154–55 (Pa. Super. Ct. 1993).
[14] James W. Poppell. When Is A Sale, and A Product A Product? Missouri Health Care Providers and Strict Product Liability Claims [J]. UMKC Law Review, 1994,(63): 283.
[15] Jackson v. Mulenberg Hospital, 96 N.J. Super. 314, 232 A.2d 879 (1967).
[16] Cheshire v. South-hampton Hospital Association, 53 Misc. 2d 355, 278 N.Y.S.2d 531 (Sup. Ct. 1967).
[17] Carmichael v. Reitz, (1971) 17 Cal. App. 3d 958.
[18] Perlmutter v. Beth David Hospital, (1954) 308 N. Y. 100.
[19] Cafazzo v. Central Medical Health Services, Inc., (1995) 668 A.2d 521.
[20] Royer v. Catholic Medical Center, (1999) 741 A. 2d 74.
[21] Budding v. SSM Healthcare System, (2000) 19 S. W. 3d 678.
[22] Russell v. Community Blood Bank, (1966) 185 So. 2d 749.
[23] McKenna v. Harrison Memorial Hospital, (1998) 960 P. 2d 486.
[24] Margin v. Krasnica, (1967) 227 A. 2d 593.
[25] Kennedy & Grubb. Medical Law[M]. 3rd ed. New York: Oxford University Press, 2005: 1613.
[26]富尔,考茨欧. 医疗事故侵权案例比较研究[M]. 丁道勤, 杨秀英, 译. 北京:中国法制出版社, 2012.
[27] 廖焕国. 医疗机构连带承担药品缺陷责任之质疑[J]. 法学评论, 2011,(4).
[28] 顾昕. 全球性医疗体制改革的大趋势[J]. 中国社会科学, 2005,(6): 121-128.
[29] Stephen Todd. The Law of Torts in New Zealand [M]. 5th ed. Wellington: Thomson Reuters, 2009: 301.
[30] Dodd v. Wilson [1946] 2 All ER 691.
[31] Ter Neuzen v. Korn (1995) 127 DLR (4th) 577.
[32] Bryant v. Hoffman-La Roche, Inc., 585 S.E.2d 723 (Ga. App.2003), 734, Judge Andrews.
[33] Reyes v. Wyeth Laboratories, 498 F 2d 1264 (5th Cir 1974), 1276, Wisdom J.
[34] Donoghue v. Stevenson [1932] AC 562.
[35] Hollis v. Dow Corning Corp (1995) 129 DLR (4th) 609 (Can Sup Ct).
Revisiting Article 59 of Chinas Tort Liability Law:
Contextualization, Categorization and Restrictive Application
ZHAO Xiju
(College of Humanities and Social Science, Shandong
University of Traditional Chinese Medicine, Jinan 250355, China)
Abstract:Article 59 of Tort Liability Law was born in a context where provision of health service is not separated from sale of medical products. It gives too much emphasis to the fact that medical institutions are involved in the affair of selling goods, lacking full consideration of the distinct nature of health care. In an era when provision of health service is still integrated with sale of medical products, there is room for Article 59. There is a need to view Article 59 in a context, to differentiate circumstances, and to transform Article 59 into a vehicle of promoting new health care reform, rather than applying it mechanically and uncritically and making it become an obstacle to new reform. There is also a need to categorize several key factors, such as medical institutions, servicegoods dichotomy, defects of products, medical products and liabilities relating to medical products, in order to alleviate the negative impacts that Article 59 has exerted on medical institutions.
Key Words: medical products liability; Tort Liability Act of China; Article 59
本文责任编辑:林士平
