2-羟基-4-甲氧基二苯甲酮稀土配合物的合成与表征
2014-03-27胡应喜冯艳艳徐子龙
胡应喜,盖 翔,冯艳艳,徐子龙
(北京石油化工学院化学工程学院,北京 102617)
2-羟基-4-甲氧基二苯甲酮(UV-9)作为一种优良的紫外线吸收剂,能强烈吸收290~400 nm的紫外光,广泛用于聚酯、聚氯乙烯、聚苯乙烯、聚甲基丙烯酸甲酯、ABS和纤维素树脂等多种塑料和油漆中[1],也广泛应用于化妆品、医药中间体等领域。但2-羟基-4-甲氧基二苯甲酮存在熔点低、易挥发、易抽出、热稳定较差等缺点,使用效率较低[2-3],光稳定性能一般。文献[4-5]报道,2-羟基-4-甲氧基二苯甲酮可与金属形成稳定的配合物,并且在波长为200~400 nm的范围内仍有强烈的紫外吸收作用,其分解温度在300 ℃以上,热稳定性增强,可延长其使用寿命。
作者以2-羟基-4-甲氧基二苯甲酮和稀土金属氯化物为原料,合成了6个2-羟基-4-甲氧基二苯甲酮稀土配合物,并通过元素分析、红外光谱分析、紫外光谱分析和热重分析对其结构进行表征。
1 实验
1.1 试剂与仪器
无水乙醇、氢氧化钠、乙二酸四乙酸二钠、六次甲基四胺、硝酸、盐酸,北京化工厂;氨水,北京恒业中远化工有限公司;RECl3·6H2O(RE=La、Nd、Sm、Eu、Gd、Dy),天津津科精细化工研究所。以上试剂均为分析纯。
2-羟基-4-甲氧基二苯甲酮:参照文献[6]自制,m.p.63~65 ℃,纯度99.9%。
FLASH EA1112型元素分析仪,美国热电公司;VERCTOR22型红外光谱仪,德国Bruker公司;HCT-1 型DTA-TG-DTG 同时分析仪(测量范围为室温~800 ℃;调温速率0.1~20 ℃·min-1,间隔0.1 ℃·min-1;使用α-Al2O3作为参比物,参比物质量39.8 mg;DTA 量程±50 μV,TG量程10 mg,DTG量程10 mV·min-1;升温速率10.0 ℃·min-1),北京恒久科学仪器厂;UV2300型紫外光谱仪(扫描波长190~450 nm,最低波长极限215 nm,扫描速率200 nm·min-1),上海天美科学仪器有限公司。
1.2 方法
1.2.1 2-羟基-4-甲氧基二苯甲酮稀土配合物的合成
将2 mmol RECl3·6H2O(RE=La、Nd、Sm、Eu、Gd、Dy,下同)溶于40 mL无水乙醇中,配成浓度为0.05 mol·L-1的溶液;将6 mmol 2-羟基-4-甲氧基二苯甲酮溶于30 mL无水乙醇中,并向其中加入6 mL1 mol·L-1NaOH溶液;搅拌下,将2-羟基-4-甲氧基二苯甲酮的乙醇溶液缓慢滴加到RECl3的乙醇溶液中,搅拌反应1.5 h生成沉淀,沉淀在室温下放置24 h后减压抽滤,滤饼用1∶1乙醇溶液洗涤3次,再于100 ℃烘至恒质量。
1.2.2 分析测试
采用元素分析仪、DTA-TG-DTG同时分析仪、红外光谱仪及紫外光谱仪对产物进行组成分析和结构表征。
稀土含量测定采用EDTA 容量分析法:称量一定质量的稀土配合物于250 mL锥形瓶中,加入5 mL 6 mol·L-1硝酸溶液和15 mL 6 mol·L-1盐酸溶液,于160~170 ℃加热溶解,冷却后用5 mol·L-1氢氧化钠溶液调节pH值为4~5,加10~15 mL六次甲基四胺缓冲溶液、1~2滴0.5%二甲酚橙指示剂,用EDTA标准溶液滴定,溶液由紫红色变黄色即为终点。
2 结果与讨论
2.1 元素分析(表1)
表12-羟基-4-甲氧基二苯甲酮稀土配合物元素分析结果/%

Tab.1 The elemental analysis results of rare earth complexes of UV-9/%
由表1可知,元素分析实测值与理论值基本吻合,表明所合成产物确为2-羟基-4-甲氧基二苯甲酮稀土配合物,其化学组成为RE(C14H11O3)3,稀土金属离子与配体配比为1∶3。
2.2 红外光谱分析
配体2-羟基-4-甲氧基二苯甲酮及6个稀土配合物的红外光谱的主要特征吸收峰数据见表2。
表22-羟基-4-甲氧基二苯甲酮及其稀土配合物的红外光谱吸收峰数据/cm-1
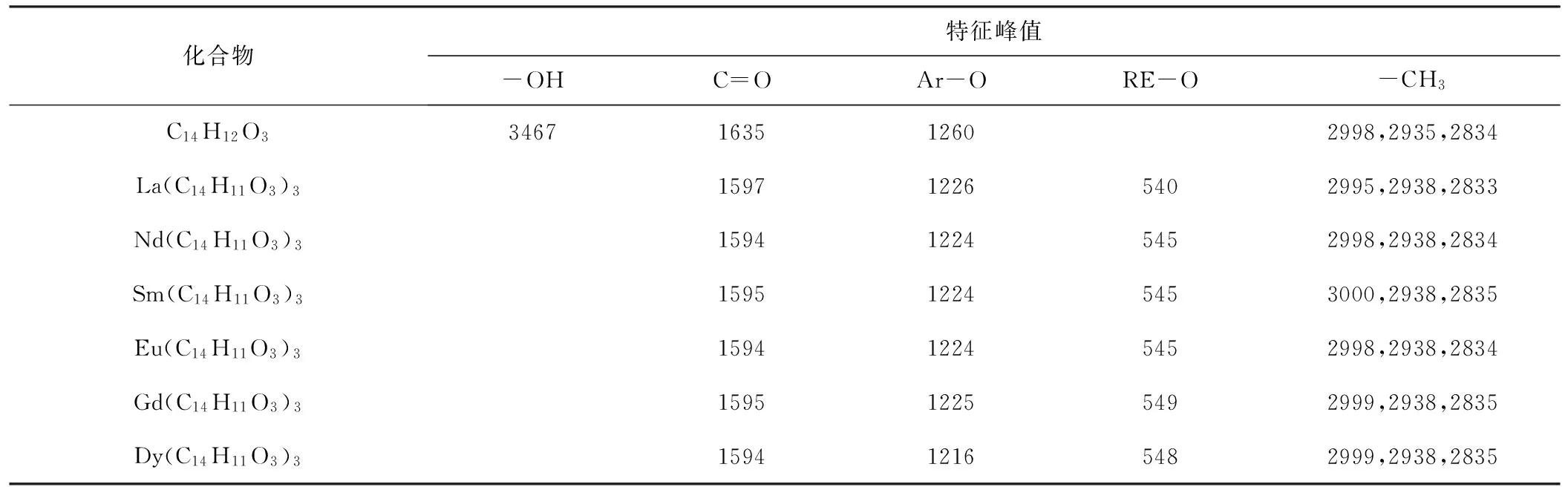
Tab.2 The IR absorption weak data of UV-9 and its rare earth complexes/cm-1
6个配合物的红外光谱十分相似,只是峰位稍有不同,表明它们具有相似的结构。由表2可知,配体2-羟基-4-甲氧基二苯甲酮位于3467 cm-1附近的吸收峰归属于羟基O-H的伸缩振动,该峰易受到溴化钾吸湿带入的水的弱峰的影响;2-羟基-4-甲氧基二苯甲酮位于1635 cm-1处的羰基伸缩振动峰在形成配合物后红移至1610 cm-1附近,为对应着双键伸缩振动的1595 cm-1附近的强宽吸收峰所覆盖;2-羟基-4-甲氧基二苯甲酮位于1260 cm-1处是苯环上碳与酚羟基氧(C-O)的伸缩振动吸收峰[7],在与稀土金属离子形成配合物后红移至1216~1226 cm-1,说明配体是以羰基氧(C=O)和酚羟基氧(C-O)与稀土金属RE配位[8];稀土配合物在540~549 cm-1的吸收峰,归属为金属氧键(RE-O)[9-10];2-羟基-4-甲氧基二苯甲酮在2998 cm-1、2935 cm-1、2834 cm-1处的吸收峰可归属为甲基上的C-H伸缩振动,形成配合物后移动程度不大。
2.3 紫外光谱分析
配体2-羟基-4-甲氧基二苯甲酮(UV-9)和样品La(C14H11O3)3的乙醇溶液的紫外光谱见图1。
由图1可知,2-羟基-4-甲氧基二苯甲酮的乙醇溶液在紫外区242 nm、287 nm、326 nm处出现3个吸收峰,可分别指认为苯环共轭体系及羰基的π-π*跃迁和羰基的n-π*跃迁产生的吸收峰;稀土配合物La(C14H11O3)3谱图中对应区域内自左向右第3个吸收峰几乎消失,且在这一区间的谱带较宽、强度中等,吸收几乎延伸至350 nm处。这可能是由于配体与镧离子配位成键后,改变了配位原子周围电子云的密度,发生电荷迁移而影响了相关共轭分子轨道的能级状态[7]。

图1 2-羟基-4-甲氧基二苯甲酮及配合物La(C14H11O3)3的紫外光谱Fig.1 The UV spectra of UV-9 and La(C14H11O3)3
由图1还可知,2-羟基-4-甲氧基二苯甲酮虽然与镧离子形成了配合物,但是并没有改变其性质,即配合物还具有吸收紫外线的能力,在紫外区242 nm附近、288 nm附近保留了2个吸收峰。
2.4 热重分析(表3)
表32-羟基-4-甲氧基二苯甲酮及其稀土配合物的TG/DTA分析结果
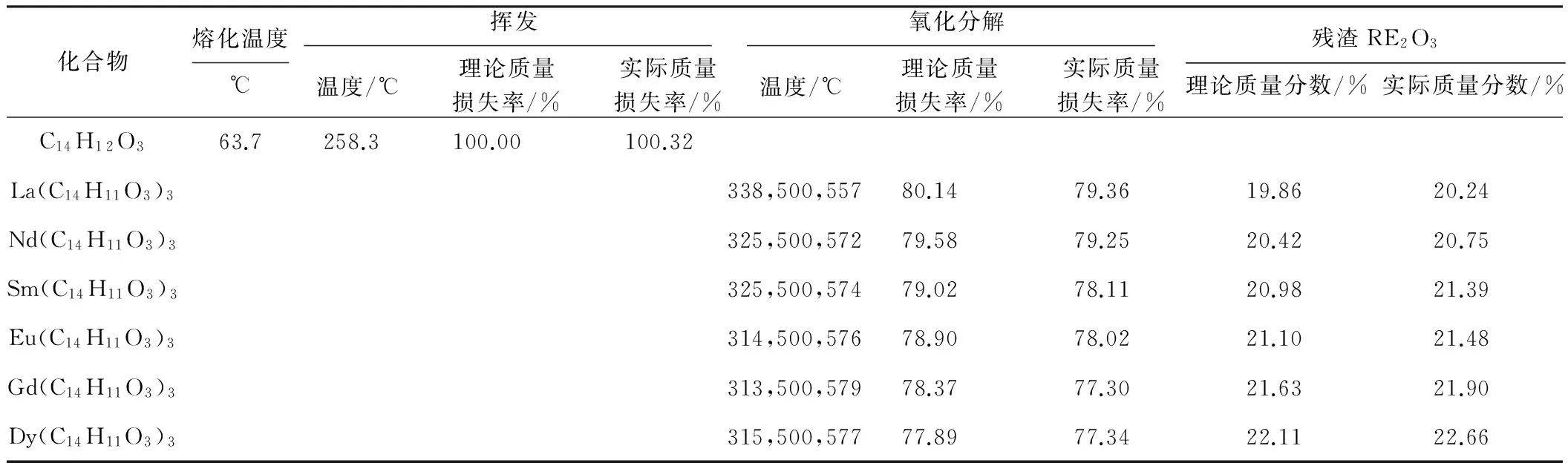
Tab.3 The TG/DTA data of UV-9 and its rare earth complexes
由表3可知,配体2-羟基-4-甲氧基二苯甲酮的DTA曲线在20~800 ℃范围内有2个吸热峰:一个是在63.7 ℃处,该峰为2-羟基-4-甲氧基二苯甲酮的熔化吸热峰,即为熔点,与文献值(62~63 ℃)基本一致[2];另一个吸热峰在258.3 ℃处,为蒸(挥)发吸热峰,并伴随明显的热质量损失现象,质量损失率为100.32%。这说明2-羟基-4-甲氧基二苯甲酮在260 ℃以前就挥发了,其热稳定性不好。而配合物RE(C14H11O3)3的DTA曲线在300~600 ℃范围内有3个放热峰,为氧化分解峰,不同配合物的放热峰位置略有不同,氧化分解过程伴随着质量损失,实际质量损失率与理论质量损失率基本一致;完全分解后,残渣为RE2O3,以镧配合物为例,实际质量分数为20.24%,与理论值(19.86%)接近。表明,所合成稀土配合物的热稳定性要优于配体2-羟基-4-甲氧基二苯甲酮。
2.5 配合物结构分析
基于上述分析结果,判断中心稀土金属离子与3个配体2-羟基-4-甲氧基二苯甲酮中的2个氧原子配位形成螯合物,配位数为6。由于配体与稀土离子形成的螯合环为六元环,张力较小,形成的配合物稳定性较好,配合物可能的结构式见图2。
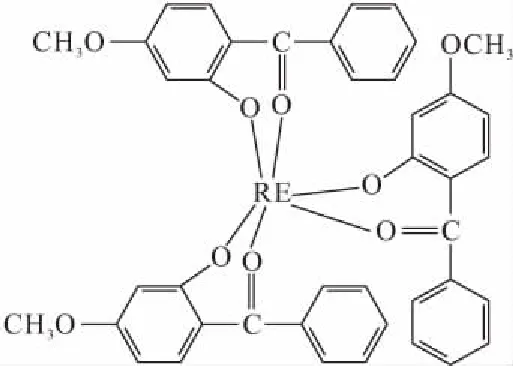
图2 配合物的结构示意图Fig.2 The structural formula of the complexes
3 结论
(1)以2-羟基-4-甲氧基二苯甲酮与稀土金属氯化物为原料、乙醇为溶剂,合成了6个2-羟基-4-甲氧基二苯甲酮稀土金属配合物,其组成为RE(C14H11O3)3(RE=La、Nd、Sm、Eu、Gd、Dy)。
(2)2-羟基-4-甲氧基二苯甲酮稀土金属配合物仍具有紫外线吸收能力,但热稳定性较配体得到了很大的提高。
[1] 陈宇.塑料助剂产供销指南[M].北京:化学工业出版社,2001:190.
[2] 孟波,柳玉英,周丽.紫外线吸收剂UV-9生产工艺的改进[J].山东理工大学学报,2003,17(5):61-62.
[3] 李杰,隋昭德,夏飞.抗氧剂、光稳定剂的基本功能、评价方法及选用原则[J].塑料助剂,2005,(3):30-34.
[4] 高洪福,于德成,江欣,等.2-羟基-4-甲氧基二苯甲酮合钴(Ⅲ) 的合成及光谱性质[J].黑龙江医药科学,2010,33(6):51-52.
[5] 江欣,吴谊群,贺春英.新型多氮杂环金属配合物的合成及其光谱研究[J].光谱学与光谱分析,2008,28(11):2511-2514.
[6] 焦林,朱良杰,樊如梅.紫外线吸收剂UV-9的合成与应用[J].印染助剂,2001,18(3):7-9.
[7] 陈洁,宋启泽.有机波谱分析[M].北京:北京理工大学出版社,1996:8-92.
[8] 陈德余,张平,史卫良.邻香草醛缩天冬氨酸铜、锌、镍配合物的合成[J].应用化学,1999,16(2):75-77.
[9] Misumi S,Iwasaki N.The infrared spectra and some properties of tirs-(acetylacetonato) lanthanide(Ⅲ) complexes[J].Bulletin of the Chemical Society of Japan,1967,40(3):550-554.
[10] Charette J,Neirynck G,Teyssie P.Structure dependence of absorption spectra ofβ-diketone chelates.Ⅱ.Ultraviolet[J].J Phys Chem,1961,65(5):735-739.
