麻疯油酯化衍生物的制备及其毒性研究
2014-08-14鲁栋梁许玉萍朱华龙吴润嘉
鲁栋梁,许玉萍,杨 斌,朱华龙,吴润嘉
(1.钦州学院,广西 钦州535009;2.中国海洋大学化学化工学院,山东 青岛266100;3.广西田园生化股份有限公司,广西 南宁530007)
麻疯树种子油(简称麻疯油)含有丰富的不饱和脂肪酸,应用于多种杀虫剂、除草剂、植物生长调节剂等。研究发现麻疯油还具有显著的抗肿瘤等活性,另有临床试验证明,麻疯油衍生物具有抗病毒作用[1-4]。因此,麻疯树作为一种新兴的资源植物,在新药开发方面具有巨大的应用价值[5-6]。
作者在此以麻疯油为原料,在碱催化条件下与乙醇反应合成麻疯油酯化衍生物,考察了反应时间、反应温度、催化剂用量及醇油比(体积比,下同)对酯交换率的影响,确定了最佳反应条件,并探讨了麻疯油酯化衍生物对鲤鱼幼苗的毒性影响。
1 实验
1.1 材料、试剂与仪器
鲤鱼幼苗。
广西钦州麻疯树种子油。
氢氧化钠,氢氧化钾,无水乙醇,冰醋酸,硫代硫酸钠,氮气。所用试剂均为分析纯。
HH-4型数显恒温搅拌装置,金坛科学分析仪器有限公司;RE-3000型旋转蒸发仪,上海亚荣生化仪器厂;FW-100型高速万能粉碎机,上海胜启仪器有限公司;EL204型分析天平,梅特勒-托利多仪器有限公司。
1.2 酯化方法
称取150mL麻疯油加入到500mL三颈瓶中,置于恒温水浴锅中,通入氮气搅拌,在一定温度下加入氢氧化钠的乙醇溶液反应4h,用旋转蒸发仪回收多余的乙醇,将反应液置于分液漏斗中静置分层,取上层用去离子水洗涤至中性,再经无水硫酸钠脱水处理,即得麻疯油酯化衍生物[7]。
1.3 麻疯油酯化衍生物对鲤鱼幼苗的毒性实验
取500mL烧杯6个,编号1#、2#、3#、4#、5#、6#,随机放入鲤鱼幼苗各10尾。每天定时喂食1次,每次每条喂食分别经过28.67mg·L-1、33.59mg·L-1、41.98mg·L-1、52.48mg·L-1、65.60mg·L-1、82.00mg·L-1不同浓度麻疯油酯化衍生物处理过的饲料2粒。每隔24h、48h、72h、96h观察鲤鱼幼苗的死亡情况并记录。
根据寇氏法处理实验数据。相关公式如下:

式中:XK为最大剂量的对数值;d为相邻两组比值的对数;Pi为各组死亡率;∑Pi为各组死亡率之和;sx50为logLD50的标准误差;n为每组动物数;c为安全浓度。
1.4 分析与测试
1.4.1 麻疯油性质测定
麻疯油酸值测定按GB/T 5530-2005《动植物油脂酸值及酸度的测定》进行。
麻疯油过氧化值测定按GB/T 5538-2005《动植物油脂氧化值测定》进行。
1.4.2 酯交换率的测定
酯交换反应中麻疯油质量记为W(g),反应脱水后的产物质量记为W1(g),向产物中加入1BV的正己烷,置于-20℃冰箱中放置20h,过滤去除甘油酯,滤液经旋转蒸发去除溶剂得到的样品质量记为W2(g)。按下式计算己酯交换率和乙酯交换率[8]:

2 结果与讨论
2.1 麻疯油的酸值和过氧化值
麻疯油中含有的游离态脂肪酸和酸败产生的过氧化物可使碱性催化剂中毒,因此酸值和过氧化值在碱催化反应过程中必须尽可能低(酸值<1),否则酯交换率低。实验测得原料麻疯油的酸值为0.178,过氧化值为1.66meq·kg-1,符合反应要求。
2.2 单因素实验结果与分析
2.2.1 反应温度对酯交换率的影响
在醇油比为6∶1、反应时间为100min、氢氧化钠用量为1.5%的条件下,考察反应温度对酯交换率(乙酯交换率,下同)的影响,结果如图1所示。
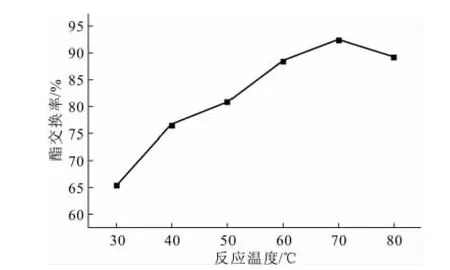
图1 反应温度对酯交换率的影响Fig.1 The effect of reaction temperature on esterification rate
由图1可知,酯交换率随着反应温度的上升而升高,当反应温度为70℃时达到最高,再升高反应温度时酯交换率反而下降。这是因为,反应温度过高时会加剧乙醇的挥发,导致反应程度降低,同时使得皂化反应加快,因而酯交换率降低。因此,认为70℃左右为最佳反应温度。
2.2.2 醇油比对酯交换率的影响
在反应温度为70℃、反应时间为100min、氢氧化钠用量为1.5%的条件下,考察醇油比对酯交换率的影响,结果如图2所示。
由图2可知,酯交换率随着醇油比的增大即乙醇用量的增加而升高,当醇油比为6∶1时达到最高,继续增加乙醇用量时酯交换率趋于平缓甚至略有下降。这是因为,过量乙醇会导致甘油极性溶解,使甘油与麻疯油酯化物难以分离而部分保留在麻疯油酯化物中,不仅增加了乙醇的回收成本,也会降低酯交换率。因此,认为6∶1左右为最佳醇油比。
2.2.3 反应时间对酯交换率的影响
在醇油比为6∶1、反应温度为70℃、氢氧化钠用量为1.5%的条件下,考察反应时间对酯交换率的影响,结果如图3所示。
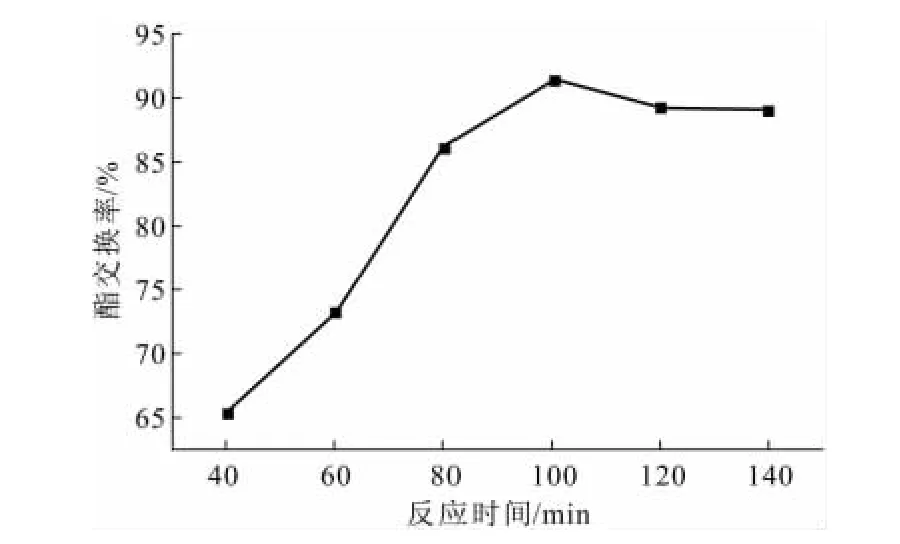
图3 反应时间对酯交换率的影响Fig.3 The effect of reaction time on esterification rate
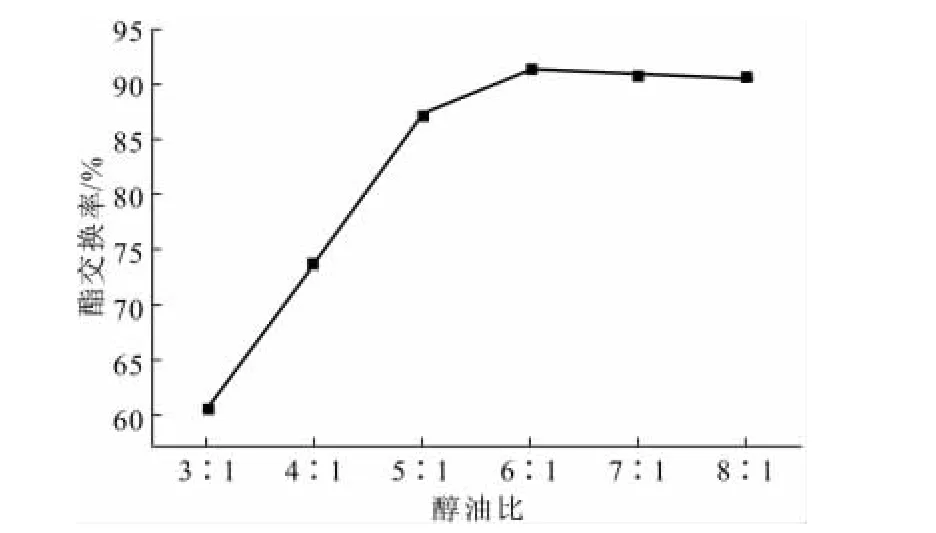
图2 醇油比对酯交换率的影响Fig.2 The effect of ethanol-oil ratio on esterification rate
由图3可知,酯交换率随着反应时间的延长而升高,当反应时间为100min时达到最高,随后有所降低。这是因为,100min之前反应没有达到平衡,所以酯交换率随着反应时间延长而升高,当酯化反应达到平衡后,再延长反应时间,部分麻疯油酯化物被皂化,酯交换率反而降低。因此,认为100min左右为最佳反应时间。
2.2.4 催化剂用量对酯交换率的影响
在醇油比为6∶1、反应温度为70℃、反应时间为100min的条件下,考察催化剂(氢氧化钠)用量对酯交换率的影响,结果如图4所示。
由图4可知,酯交换率随着催化剂用量的增加而升高,在催化剂用量大于1.5%之后趋于平缓,甚至略有下降。这是因为,过量的催化剂会加剧麻疯油酯化物的皂化反应,从而降低酯交换率。因此,认为1.5%左右为最佳催化剂用量。
2.3 正交实验结果及分析
根据单因素实验结果选取反应温度、醇油比、反应时间及催化剂用量为考察因素,以酯交换率为考察指标,采用L9(34)正交实验优化酯交换反应条件,正交实验的因素与水平见表1、结果与分析见表2。
由表2可知,各因素对酯交换率的影响大小依次为A>B>C>D,其最优组合水平为A2B2C2D2。随后进行最佳组合的验证实验,酯交换率为95.65%,高于正交实验中最高的93.18%。因此,确定最佳反应条件为:反应温度70℃、醇油比6∶1、反应时间100 min、催化剂用量1.5%。

图4 催化剂用量对酯交换率的影响Fig.4 The effect of catalyst dosage on esterification rate
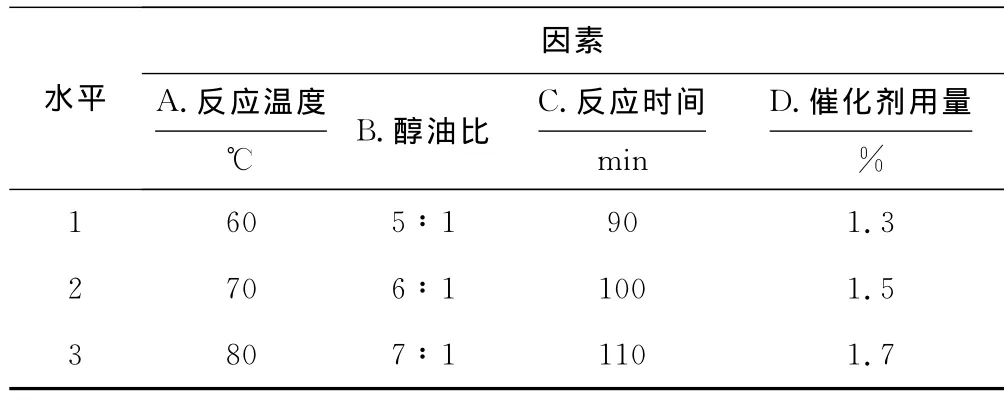
表1 正交实验的因素与水平Tab.1The factors and levels of orthogonal experiment
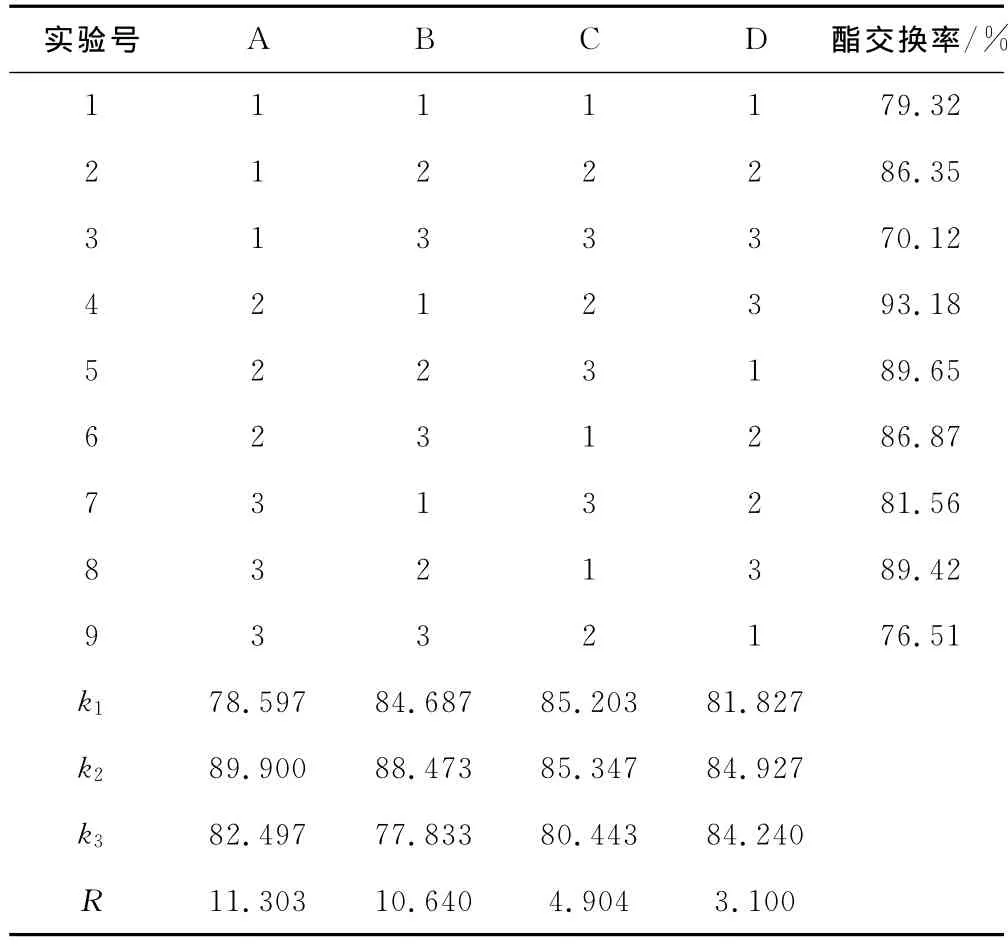
表2 L9(34)正交实验结果与分析Tab.2 The result and analysis of L9(34)orthogonal experiment
2.4 麻疯油酯化衍生物对鲤鱼幼苗的毒性分析
麻疯油酯化衍生物对鲤鱼幼苗毒性实验结果如表3、表4所示[9-10]。

表3 麻疯油酯化衍生物对鲤鱼幼苗的毒性Tab.3 Toxicity of esterification derivative of Jatropha curcas seed oil on carp juvenile
由表3和表4可知,麻疯油酯化衍生物对鲤鱼幼苗具有明显的胃毒作用,取食麻疯油酯化衍生物处理过的饲料后24h、48h、72h、96h的 LD50分别为72.44mg·L-1、48.98mg·L-1、41.69mg·L-1和38.02mg·L-1,LD50值随处理时间的延长而降低。导致鲤鱼幼苗死亡的原因是麻疯油酯化衍生物中含有萜醇等有毒物质。其毒性主要表现为胃毒作用。实验还发现供试鲤鱼对麻疯油酯化衍生物处理后的饲料的取食量明显低于对照组,表现出一定的拒食活性,取食量减少的原因可能是麻疯油酯化衍生物引起的消化系统中毒,甚至死亡。

表4 麻疯油酯化衍生物对鲤鱼幼苗的毒性回归方程及相关系数Tab.4 Regression equations and correlation coefficients for toxicity of esterification derivative of Jatropha curcas seed oil on carp juvenile
3 结论
(1)麻疯油酯化衍生物的最佳反应条件为:反应温度70℃、醇油比(体积比)6∶1、反应时间100min、催化剂用量1.5%,在此条件下酯交换率高达95.65%。
(2)麻疯油酯化衍生物对鲤鱼幼苗具有一定胃毒作用,处理后48h时的LD50为48.98mg·L-1,死亡率为100%。
(3)采用酯化、醚化、烷基化等方法对麻疯油进行改性,可以提高麻疯油衍生物的应用价值。
[1]傅红,裘爱泳.鱼油脂肪酸乙酯化工艺研究[J].粮食与油脂,2004,21(5):27-30.
[2]Meshram P B,Kulkarni N,Joshi K C.Antifeedant activity of Azadirachta indica and Jatropha curcas against Papilio demoleus Linn.[J].Environ Bio,1996,17(4):295-298.
[3]Huang F N,Zhu K Y,Lawrent L,et al.Comparison of midgut proteinases in Bacillus thruingiensis-susceptible and resistant European cornborer,Ostrinia nubilalis[J].Pestic Biochem Physio,1999,65(2):132-139.
[4]李金磊,胡兵,张智.磷钼钒杂多酸的制备及其催化合成乙酸乙酯[J].化学与生物工程,2012,29(1):56-59.
[5]Gupta M P,Monge A,Karikas G A.Screening of Panamanian medicinal plant for brine shrimp toxicity,crown gall tumor inhibition,cytotoxicity and DNA-intercalation[J].Internal J Pharma,1996,34(1):19-27.
[6]Rug M,Ruppel A.Toxic activities of the plant Jatropha curcas against intermediate snail hosts and larvae of schistosomes[J].Tropi Med and Internal Health,2000,5(6):423-430.
[7]蒋华梅,杨松,胡德禹,等.麻疯树Curcin蛋白农药和医用生物活性研究进展[J].农药,2007,46(1):10-13.
[8]周永欣,章宗涉.水生生物毒性试验方法[M].北京:农业出版社,1989:110-123.
[9]何亮华,梁志强,郑华杭.夹竹桃提取物对鲤科鱼类的毒性试验[J].内陆水产,2007,32(2):31-33.
[10]Solsoloy A D,Domingo E O,Bilgera B U,et al.Occurrence,mortality factors and within plant distribution of bollworm,Helicoverpa armigera(Hubn)on cotton[J].Philippine J Sci,1994,123(1):9-20.
