高地芽孢杆菌碱性蛋白酶酶学性质研究
2014-03-27陈复生丁长河李盘欣
李 文,陈复生*,丁长河,李盘欣
(1.河南工业大学 粮油食品学院,河南 郑州 450001;2.河南南街村集团有限公司技术中心,河南 漯河 462699)
0 引言
碱性蛋白酶是一类最适pH 值偏碱性、适用于在碱性条件下水解蛋白质肽键的蛋白酶,是一类非常重要的工业用酶,因其具有较强的水解能力、耐碱和耐热能力,在食品、洗涤剂和丝绸、皮革制造业等中都发挥了巨大作用[1-3].大部分碱性蛋白酶的最适pH 值为9~11,少数蛋白酶的最适pH 值更高,如克劳氏芽孢杆菌(Bacillus clausii)GMBE 22所产蛋白酶的最适pH 值为12[4].碱性蛋白酶的最适温度范围较广,由黄海底泥分离得到一株能够稳定高产蛋白酶菌株HW08,所产低温碱性蛋白酶的最适作用温度为30 ℃[5],而分离自嗜碱芽孢杆菌(Bacillus sp)B18 所产蛋白酶最适温度可以达到85 ℃[6].同时研究表明一些金属离子对碱性蛋白酶的活力有促进或抑制的作用,在对地衣芽孢杆菌(Bacillus licheniformis)弹性蛋白酶的研究中发现,低浓度金属离子Ca2+和K+对其酶活力有促进作用,而Mg2+、Mn2+、Zn2+和Al3+对其酶活力具有抑制作用[7].本实验室前期筛选了一株高产碱性蛋白酶的菌株,经鉴定为高地芽孢杆菌PY41[8],并进行了发酵产酶条件的优化.在前期研究的基础上,对高地芽孢杆菌所产碱性蛋白酶进行了分离与纯化,通过SDS-PAGE 凝胶电泳验证,得出该碱性蛋白酶的相对分子质量为29 500.而对该菌株所产碱性蛋白酶性质的研究在国内外尚未见报道,故作者对其酶学性质进行了研究,为其在食品及其他行业中的应用提供理论依据.
1 材料与方法
1.1 材料
菌株:高地芽孢杆菌PY41,本实验室自筛菌株.
发酵培养基(g/L):豆粕60、磷酸铵12、葡萄糖15、乳 糖 40、KCl 0.3、CaCl20.7、MgSO4·7H2O 0.2、pH 10[8].
1.2 仪器与设备
pHS-3C 型pH 计:上海仪电科学仪器股份有限公司;HH-2 型数显恒温水浴锅:国华电器有限公司;TGL-16G 型台式离心机:上海安亭科学仪器厂;UV-7504 型紫外-可见分光光度计:上海欣茂仪器有限公司.
1.3 方法
1.3.1 酶活力测定
采用Folin-酚法[9].取1 mL 酶液40 ℃预热2 min,加入预热5 min 的1 mL 1%酪蛋白溶液中,在40 ℃水浴中反应10 min.再加入2 mL 0.4 mol/L三氯乙酸,在40 ℃水浴中反应10 min,7 000 r/min离心10 min,取上清液.加入5 mL 0.4 mol/L Na2CO3中,再加入1.00 mL Folin 试剂混合均匀,在40 ℃水浴中显色20 min.空白对照中加入酪蛋白和三氯乙酸的顺序不同,其他相同.在680 nm 下测定吸光度值并计算酶活.
1.3.2 碱性蛋白酶最适反应pH 和pH 稳定性的研究
配制0.5 mol/L 的pH 4~6 的柠檬酸-柠檬酸钠缓冲液,pH 7、pH 8、pH 8.5 的Tris-HCl 缓冲液,pH 9、pH 9.5、pH 10 的Gly-NaOH 缓冲液,pH 11、pH 12 的Na2HPO4-NaOH 缓冲液.用缓冲液分别稀释纯化后的酶液至一定倍数,并用该缓冲液配制1 %的酪蛋白溶液.在50 ℃条件下,测定不同pH值的碱性蛋白酶活力.同时将不同pH 值的酶液在50 ℃恒温水浴下保温30 min,测定碱性蛋白酶活力.
1.3.3 碱性蛋白酶最适反应温度和温度稳定性的研究
在pH 9.5 的条件下,测定碱性蛋白酶在20℃、30 ℃、40 ℃、45 ℃、50 ℃、55 ℃、60 ℃、70 ℃恒温水浴下的酶活力.同时将该酶液分别置于40℃、50 ℃、60 ℃恒温水浴下保温1 h,测定该酶活力.
1.3.4 金属离子、EDTA 和SDS 对碱性蛋白酶酶活力的影响
配制含有Mn2+、Ca2+、Ba2+、Mg2+、Co2+、Fe2+、Fe3+、Pb2+、Cu2+、Hg2+、Ag+、Na+、Zn2+金属离子和EDTA、SDS 的缓冲液,分别用上述缓冲液稀释酶液,至终浓度为5 mmol/L[10].按照测定碱性蛋白酶酶活的方法测定酶活,以不加入上述缓冲液的蛋白酶酶活力为100%.
1.3.5 碱性蛋白酶动力学常数的测定[11]
配 制 浓 度 为1 mg/mL、2 mg/mL、3 mg/mL、6 mg/mL、10 mg/mL,pH 为9.5 的酪蛋白溶液,取1 mL 不同浓度的酶液与稀释到一定浓度的蛋白酶液在50 ℃时反应10 min,用Folin 法测活力,根据Lineweaver-Burk 双倒数作图法,得出Km值和vmax.
2 结果与分析
2.1 pH 对碱性蛋白酶活力的影响
pH 值对碱性蛋白酶酶活力的影响如图1 所示.在pH 值为5.0、6.0、12.0 时碱性蛋白酶相对酶活较低,均在15%以下.当pH 值小于9.5 时,蛋白酶酶活力随着pH 值的升高而升高;当pH 值大于9.5 时,蛋白酶酶活力随着pH 值的升高而降低.在pH 值为7.0~11.0 时,相对酶活较高,在75%以上,故该碱性蛋白酶在pH 7.0~11.0 内仍具有较高的酶活力.在pH 值为9.5 时,酶活最高,故该碱性蛋白酶的最适反应pH 值为9.5,与对黄海黄杆菌(Flavobacterium yellowsea)YS-80-122 所产海洋低温碱性蛋白酶的最适pH 值一致[12].Liang 等[13]研究报道了蜡状芽孢杆菌(Bacillus cereus)TKU 022所产碱性蛋白酶的最适pH 值为10.0,李红等[14]报道了普鲁兰短梗霉(Aureobasidium pullulans)N2-3所产碱性蛋白酶最适pH 值为9.0,与本试验中碱性蛋白酶的最适pH 值相近.Chellappan S 等[15]研究报道了白色侧齿霉菌(Engyodontium album)BTMFS 10 产碱性蛋白酶的最适pH 值为11,与本试验研究的碱性蛋白酶最适pH 值相差较大.根据碱性蛋白酶的定义[16],本试验蛋白酶有碱性蛋白酶的特征,为碱性蛋白酶.
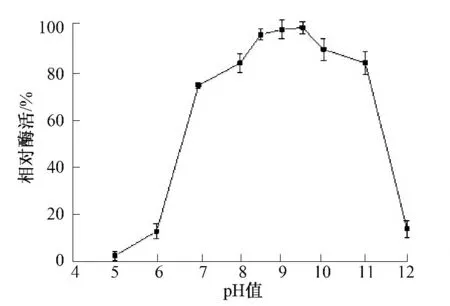
图1 pH 对碱性蛋白酶的影响
2.2 pH 对碱性蛋白酶活力稳定性的影响(图2)

图2 pH 对碱性蛋白酶稳定性的影响
从图2 可以看出,50 ℃水浴保温30 min 后,蛋白酶在pH 7~11 的范围内的稳定性较好,在pH 5、pH 6、pH 12 时,蛋白酶活力下降迅速.在pH 9时,蛋白酶的稳定性最好.综上所述,在碱性条件下,该蛋白酶的稳定性较好,具有较宽的pH 值区间;在酸性和极端碱性条件下,蛋白酶pH 值稳定性较差.Singh S K 等[17]报道的蜡状芽孢杆菌SIU 1来源碱性蛋白酶和Beg Q K 等[18]报道的莫海威芽孢杆菌(Bacillus mojavensis)来源碱性蛋白酶均在pH 7~11 的范围内稳定,与本试验研究的高地芽孢杆菌PY41 产碱性蛋白酶的pH 值稳定范围相同.
通过研究pH 值对高地芽孢杆菌所产碱性蛋白酶活力的影响,得出该酶在较宽的pH 值范围内(pH 7~11)表现出卓越的蛋白酶活力和稳定性,这些酶性质有利于该蛋白酶在碱性环境中和在洗涤剂中的应用.
2.3 温度对碱性蛋白酶活力的影响(图3)

图3 温度对碱性蛋白酶的影响
从图3 可知,在温度小于50 ℃时,蛋白酶活力随温度的升高而升高;在温度高于50 ℃时,蛋白酶活力随温度的升高而迅速降低;在50 ℃时,蛋白酶活力最高,为最适反应温度,与Annamalaia N等[19]和Abidi F 等[20]对碱性蛋白酶最适反应温度的研究结果一致.当温度小于40 ℃时,蛋白酶活力均在70%以下,且随着温度的下降,碱性蛋白酶的酶活力亦下降显著;在60 ℃时,酶活力则下降至30%左右;在40~55 ℃范围内,蛋白酶的酶活力较高,均在70%以上,故在实际应用中应选择此温度范围.
2.4 温度对碱性蛋白酶活力稳定性的影响(图4)

图4 温度对碱性蛋白酶稳定性的影响
从图4 可知.在40 ℃时,蛋白酶活力稳定性较好,保持在80%以上;在50 ℃时,蛋白酶活力下降至60 %左右;60 ℃水浴20 min 后,该碱性蛋白酶活力就下降至40 %左右,当水浴60 min 时,该碱性蛋白酶酶活力则严重下降至10%左右,影响其在实际中的应用.可以得出蛋白酶在小于50 ℃时稳定性较好,在大于60 ℃时稳定性较差.故该蛋白酶同其他碱性蛋白酶一样,耐热性不强.Bidochka M J 等[21]研究得出白僵菌(Beauveria bassiana)所产碱性蛋白酶的最适反应温度范围为37~42 ℃,在40 ℃水浴保温30 min 后,酶活力损失近40%,本试验纯化的碱性蛋白酶温度稳定性与该蛋白酶酶相比,稳定性相对较好.
结合温度对碱性蛋白酶的影响结果,在40~55℃蛋白酶酶活力较高,在40~50 ℃不仅酶的稳定性较好,同时还可使酶活力保持在一个较高的水平.
2.5 金属离子、EDTA、SDS 对碱性蛋白酶活力的影响(图5)

图5 金属离子、EDTA、SDS 对碱性蛋白酶酶活力的影响
有研究发现微生物碱性蛋白酶的来源不同,金属离子对蛋白酶的影响也不同[22].从图5 可以看出,Mg2+、Fe2+、Ca2+、Co2+、Ba2+、Na+、SDS 对蛋白酶的酶活力基本没有影响,Ag+、Hg2+、EDTA、Cu2+、Fe3+、Pb2+、Zn2+对蛋白酶均具有抑制作用,且Ag+和Hg2+对蛋白酶的抑制作用非常显著,蛋白酶酶活降低了约90%,说明该蛋白酶活性中心的氨基酸残基含有巯基[23].Ba2+、Ca2+、Mn2+对蛋白酶酶活具有激活作用,与金属离子对芽孢杆菌(Bacillus sp)B001 产蛋白酶的影响结果相似[24].其中Mn2+对蛋白酶酶活具有明显的激活作用,使蛋白酶活力提高了近18%,表明这些金属离子能帮助维持蛋白酶催化活性中心的构象.该酶对EDTA 较为敏感,所以此酶可能为金属离子蛋白酶[25].不同金属离子对蛋白酶活力的抑制作用由强到弱依次为Ag+、Hg2+、EDTA、Cu2+、Pb2+、Fe3+、Fe2+、Co2+、SDS、Na+、Mg2+、Ba2+、Ca2+、Mn2+.
2.6 碱性蛋白酶动力学参数
Km值是当酶反应速率达到最大反应速率一半时的底物浓度,Km值的大小只与酶的性质有关,而与酶浓度无关,Km值越小表明酶与底物的亲和力越大.根据Lineweaver-Burk 法测得的酶动力学常数如图6 所示,计算出该碱性蛋白酶的Km值为15.5 mg/mL,vmax为24.57 μg/(min·mL).

图6 Lineweaver-Burk 法测酶的Km值和vmax值
研究表明,有些蛋白酶的Km值较小,如Gupta A 等[23]研究的碱性蛋白酶以酪蛋白为底物时的Km值为2.0 mg/mL;地衣芽孢杆菌JF-U N122 所产碱性蛋白酶,以酪蛋白为底物时的Km值为5.26 μg/mL[11].而有些碱性蛋白酶的Km值较大,某菌株产碱性蛋白酶以酪蛋白为底物时的Km值为11 mg/mL[26];嗜热毛壳菌(Chaetomium thermophile)所产蛋白酶以酪蛋白为底物时的Km值为17.6 mg/mL[27].本试验纯化的碱性蛋白酶以酪蛋白为底物时的Km值较大,与酪蛋白的亲和力不高,故需在较高的酪蛋白底物浓度下进行酶解反应.
3 结论
蛋白酶在工业用酶中占据较大的比重,其中碱性蛋白酶因其独特的水解特性,成为蛋白酶研究中的热点.而寻找具有独特结构和功能,能够适应特别生产要求的新型碱性蛋白酶,具有重要的研究意义.高地芽孢杆菌为2006 年发现的芽孢杆菌新种,国内外对其研究较少,所以对高地芽孢杆菌的研究具有巨大的潜力.本文对高地芽孢杆菌所产碱性蛋白酶的性质进行了研究,表明该蛋白酶的最适反应pH 值为9.5,在较宽的pH 值范围内仍具有较高的酶活力,在pH 7~9 范围仍具有较好的稳定性.该碱性蛋白酶的最适反应温度为50℃,在40~55 ℃蛋白酶酶活力较高,在40~50 ℃不仅酶的稳定性较好,同时还可使酶活力保持在一个较高的水平.5 mmol/L 的Ag+和Hg2+对蛋白酶的抑制作用非常显著,蛋白酶酶活降低了约90%,5 mmol/L 的Mn2+对蛋白酶酶活具有明显的激活作用,使蛋白酶酶活力提高了近18%,而SDS 对该碱性蛋白酶的酶活基本没有影响.该碱性蛋白酶的Km值为15.5 mg/mL,vmax为24.57 μg/(min·mL),其Km值较大,与底物的亲和力较小,即在较高的底物浓度下,才能达到较好的酶解效果.
[1]邱并生.碱性蛋白酶[J].微生物学通报,2012(12):1859-1860.
[2]Maruthiah T,Esakkiraj P,Prabakaran G,et al.Purification and characterization of moderately halophilic alkaline serine protease from marine Bacillus subtilis AP-MSU6[J].Biocatalysis and Agricultural Biotechnology,2013(2):116-119.
[3]谢承佳,王雪.微生物碱性蛋白酶的性质研究进展[J].黑龙江科技信息,2009(34):70-71.
[4]Kazan D,Bal H,Denizci A A,et al.Studies on alkaline serine protease produced by Bacillus clausii GMBE 22[J].Prep Biochem Biotechnol,2009,39(3):289-307.
[5]杨成业,郝建华,孙谧.海洋细菌HW08 的鉴定及其所产低温碱性蛋白酶Ps5 的分离纯化[J].海洋湖沼通报,2011(2):107-114.
[6]Fujiwara N,Masui A,Imanaka T.Purification and propertes of the highly thermostable alkaline protease from Thermoplasma acidphilum by random mutagenesis[J].J Biotechnol,1993,30(2):245-246.
[7]傅明亮,刘晓杰,刘婧,等.地衣芽孢杆菌弹性蛋白酶纯化和性质研究[J].食品科学,2011,32(7):216-219.
[8]孙倩.高产碱性蛋白酶菌种的选育及发酵过程的优化[D].郑州:河南工业大学,2012.
[9]SB/T 10317—1999,蛋白酶活力测定法[S].
[10]Deng A H,Wu J,Zhang Y,et al.Purification and characterization of a surfactant-stable highalkaline protease from Bacillus sp.B001[J].Bioresource Technology,2010,101:7100-7106.
[11]袁铸,王忠彦,胡承.地衣芽孢杆菌JF-U N122 碱性蛋白酶的分离纯化与性质[J].工业微生物,2003,33(3):25-29.
[12]王宇婧,张曼平,孙谧,等.YS-80-122 海洋低温碱性蛋白酶的性质[J].海洋湖沼通报,2004(1):8-15.
[13]Liang T W,Hsieh J L,Wang S L.Production and purification of a protease,a chitosanase and chitin oligosaccharides by Bacillus cereus TKU022 fermentation[J].Carbohydrate Research,2012,362:38-46.
[14]李红,王惠,尼秀媚,等.普鲁兰短梗霉N2-3 菌株碱性蛋白酶的纯化及性质研究[J].安徽农业科学,2012,40(32):15588-15592.
[15]Chellappan S,Jasmin C,Basheer S M,et al.Production,purification and partial characteri -zation of a novel protease from marine Engyodontium album BTMFS10 under solid state fermentation[J].Process Biochemistry,2006,41(4):956-961.
[16]Anwar A,Saleemuddin M.Alkaline proteases:A Review[J].Bioresource Technology,1998,64:175-183.
[17]Singh S K,Singh S K,Tripathi V R,et al.Purification,characterization and secondary structure elucidation of a detergent stable,halotolerant,thermoalkaline protease from Bacillus cereus SIU1[J].Process Biochemistry,2012,47(10):1479-1487.
[18]Beg Q K,Gupta R.Purification and characterization of an oxidation stable,thiol-dependent serine alkaline protease from Bacillus mojavensis[J].Enzyme and Microbial Technology,2003,32(2):294-304.
[19]Annamalaia N,Rajeswarib M V,Balasubramanianb T.Extraction,purification and application of thermostable and halostable alkaline protease from Bacillus alveayuensis CAS 5 using marine wastes[J].Food and Bioproducts Processing,DOI,10.1016/j.fbp.2013.08.009.
[20]Abidia F,Chobertb J M,Haertlé T,et al.Purification and biochemical characterization of stable alkaline protease Prot-2 from Botrytis cinerea[J].Process Biochemistry,2011,46:2301-2310.
[21]Bidochka M J,Khachatourians G G.Purification and properties of an extracellular protease produced by the entomopathogenic fungus Beauveria bassiana[J].Appl Environ Microbiol,1987,53(7):1679-1684.
[22]伍先绍,贺雅非,刘琳,等.碱性蛋白酶产生菌株的筛选及其酶学性质研究进展[J].中国食品添加剂,2008(3):58-61.
[23]Gupta A,Roy I,Patel R K,et al.One-step purification and characterization of an alkaline protease from haloalkaliphilic Bacillus sp[J].Journal of Chromatography A,2005,1075(1-2):103-108.
[24]Deng A H,Wua J,Zhang Y,et al.Purification and characterization of a surfactant-stable highalkaline protease from Bacillus sp.B001 [J].Bioresource Technology,2010,101(18):7100-7106.
[25]王帅,林学政,黄晓航,等.印尼热泉中产嗜热碱性蛋白酶菌株筛选及酶学性质研究[J].海洋科学进展,2014,30(2):244-251.
[26]Shikha,Sharan A,Nandan S.Improved production of alkaline protease from a mutant of alkalophilic Bacillus pantotheneticus using molasses as a substrate[J].Darmwal Bioresource Technology,2007,98(4):881-885.
[27]李安娜.嗜热毛壳菌热稳定蛋白酶的纯化、基因克隆与表达[D].济南:山东农业大学,2007.
