异丙酚麻醉对大鼠海马各区c-fos、c-jun 基因及蛋白表达的影响
2014-03-27杨军,沈磊
杨 军,沈 磊
(长江航运总医院 武汉脑科医院麻醉科,武汉 430010)
近些年异丙酚已在各类型临床手术中得到广泛应用,其静脉全身麻醉在机体中枢神经系统的作用机制仍未完全明确[1-2]。c-fos和c-jun是即早基因中的两大重要基因族,两者共同参与脑神经元的可塑性变化,而这种可塑性在长期记忆形成过程中占有相当重要的地位。有研究报道认为,其在麻醉作用机制中也起着关键性作用[3-4]。本研究拟观察不同浓度异丙酚静脉全身麻醉对大鼠海马CA1区、CA3区和DG区c-fos、c-jun基因及蛋白表达的影响,进而了解异丙酚静脉全身麻醉的作用机制。
1 材料与方法
1.1实验动物 40只Wistar大鼠购自华中科技大学附属同济医学院实验动物中心,清洁级,均为2月龄,体质量平均为(150±20) g,雌雄不限。
1.2主要实验试剂 异丙酚购自天津泽森化工有限公司,兔抗大鼠c-fos,c-jun多克隆抗体购自北京中杉金桥生物技术有限公司,反转录-聚合酶联反应(reverse transcription polymerase chain reaction,RT-PCR)试剂盒购自大连TaKaRa公司,M-MLV反转录酶、三磷酸脱氧核苷为Sigma产品,DNA聚合酶为ABI产品,c-fos、c-jun及β-actin引物由上海生物工程技术有限公司合成。
1.3实验方法 40只实验大鼠按随机数字表法分为4组,对照组(A组,n=10):腹腔注射相同剂量生理盐水溶液(50 mL/kg);小剂量异丙酚组(B组,n=10):腹腔注射50 mg/kg异丙酚(意大利Astrazenea公司,批号CR766);中等剂量异丙酚组(C组,n=10):腹腔注射100 mg/kg异丙酚;大剂量异丙酚组(D组,n=10):腹腔注射150 mg/kg异丙酚。各组大鼠麻醉1 h后解剖海马CA1区、CA3区和DG区等脑组织。
1.4RT-PCR方法
1.4.1总RNA提取与鉴定 根据RT-PCR试剂盒操作步骤提取各组大鼠海马CA1区、CA3区和DG区脑组织总RNA,然后检测260/280 nm处的吸光度值。
1.4.2RTPCR两步法 cDNA合成方法:总2 μg RNA加入1 μL oligo(dT),5 μL 5×转录酶(AMV) buffer,2.5μL dNTP(10 mmol/L),l μL AMV-RT(10 U/μL),l μL 核糖核酸抑制剂(40 U/μL),焦磷酸二乙酯处理水补充至总体积为25 μL,完全混匀后在42 ℃温度条件下水浴处理60 min。PCR引物的序列和长度见表1。

表1 聚合酶链反应引物(由上海生物工程技术有限公司合成)
1.5蛋白印迹(Western blot)方法 称取各组大鼠海马CA1区、CA3区和DG区脑组织总蛋白40 μg,在94 ℃温度条件下加热处理10 min,然后使用分离胶对组织样品予以SDS-聚丙烯酰胺凝胶 电泳,然后从凝胶组织中将蛋白质物质转移至滤膜,电泳转印处理后行Western blot检测,一抗以1∶200予以稀释处理,二抗则以1∶750予以稀释处理,最后采用二氨基联苯胺试剂盒显色处理,如有蛋白质条带出现立即用大量磷酸盐缓冲液溶液冲洗以终止Western blot反应过程,实验结果采用专用扫描仪器分析和处理,其中c-fos、c-jun的相对分子质量分别为55×103和39×103。
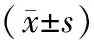
2 结 果
2.1各组大鼠海马各区c-fos mRNA、c-jun mRNA表达水平 大鼠海马CA1区和DG区c-fos、c-jun基因表达水平随着异丙酚麻醉药物作用浓度的增加而显著升高(P<0.05);海马CA3区未发现异丙酚对c-fos、c-jun基因表达水平的影响(表2)。
2.2各组大鼠海马各区c-fos、c-jun蛋白表达水平 大鼠海马CA1区和DG区c-fos、c-jun蛋白的表达水平随着异丙酚麻醉药物作用浓度的增加显著性升高(P<0.05);海马CA3区未发现异丙酚对c-fos、c-jun蛋白表达水平的影响(表3)。

表2 各组大鼠海马各区c-fos mRNA、c-jun mRNA表达水平

表3 各组大鼠海马各区c-fos、c-jun蛋白表达水平
3 讨 论
国内外较多研究报道认为,异丙酚静脉全身麻醉作用机制与受体-离子通道复合物之间存在着密切的联系[5],但上述研究仅限于离子型受体方面,其作用效应持续时间相对较短。而海马是机体脑组织边缘系统的重要部分,在情绪变化、感觉活动和学习记忆等方面起着相当重要的作用,与静脉全身麻醉的作用机制有着密切的相关性[6-7]。因此,本研究观察了c-fos、c-jun在异丙酚静脉全身麻醉大鼠海马各区域内的表达水平。
即早基因是可被第二信使诱导的原癌基因,可对各种类型的刺激因素做出相应反应并予以一定表达,在机体内充当核内第三信使的生理学作用,与学习记忆等功能的调控作用存在十分紧密的联系。而即早基因的两大基因族——c-fos、c-jun可有效偶联刺激和神经元内的基因表达,在脑神经元受到各类型刺激作用后可迅速表达和编码c-fos、c-jun蛋白[8-9]。由于两者可形成同源或异源二聚体活化蛋白转录因子1,进而改变其与神经元遗传物质DNA结合的特异性,增加活化蛋白转录因子1的生物学活性作用,参与各效应作用酶蛋白分子的信号转录过程,进而调控基因表达和靶蛋白合成等过程[10]。
本研究结果显示,大鼠海马CA1区和DG区c-fos、c-jun基因和蛋白的表达水平随着异丙酚麻醉药物作用浓度的增加而显著升高(P<0.05),提示异丙酚对大鼠海马神经元的突触适应性和可塑性均有一定程度的影响作用[8-9]。异丙酚可能通过影响c-fos、c-jun基因和蛋白的表达水平而发挥抑制中枢神经系统的药理学作用。而本研究还发现,在CA3区未发现异丙酚对c-fos、c-jun基因和蛋白表达水平的影响作用,提示异丙酚麻醉抑制中枢神经系统的作用部位存在明显的差异性,CA3区可能并不是异丙酚麻醉的作用位点。
[1] Ting CH,Angel A,Linkens DA,etal.Neuronal network modelling of the effects of anaesthetic agents on somatosensory pathways[J].Biol Cybern,2003,88(2):99-107.
[2] 许佩龙,刘健,李雪飞,等.丙泊酚麻醉对新生期大鼠海马BDNF及Trk-B的影响[J].中国药理学通报,2012,28(6):858-861.
[3] Nojima H,Simons CT,Cuellar JM,etal.Opioid modulation of scratching and spinal c-fos expression evoked by intradermal serotonin[J].J Neurosci,2003,23(34):10784-10790.
[4] 王凤丽.大鼠衰老过程中特定脑区c-fos、c-jun、Bcl-2、Bax基因表达的变化[J].南方医科大学学报,2010,30(5):1211-1213.
[5] Eghbali M,Gage PW,Birnir B.Effects of propofol on GABA(A) channel conductance in ra-t cultured hippocampal neurons[J].Eur J Pharmacol,2003,468(2):75-82.
[6] Dickinson R,Awaiz S,Whittington MA,etal.The effects of general anaesthetics on carbachol-evoked gamma oscillations in the rat hippocampusin vitro[J].Neuropharmacology,2003,44(7):864-872.
[7] 卢国林,陈小琳,宋一一,等.七氟烷吸入麻醉对新生大鼠海马神经发生和认知功能发育的影响[J].中国新药与临床杂志,2011,30(8):615-618.
[8] 何绘敏,王滨,马晓凯,等.Morris水迷宫训练后即早基因c-Fos及c-Jun在大鼠丘脑前核的表达[J].解剖科学进展,2012,18(3):255-258.
[9] Izzo AD,Suh E,Pathria J,etal.Selectivity ofneural stimulation in the auditory system:A comparison of optic and electric stimuli[J].J Biomed Opt,2007,12(2):1008 -1013.
[10] 徐晓东,张良成.异丙酚对学习记忆功能影响的实验研究[J].中国实用医药,2013,8(12):7-9.
