亲吻肽与促性腺激素抑制激素:调控生殖轴的新型RF酰胺肽
2014-03-27刘丽霞综述审校
刘丽霞(综述),殷 宏(审校)
(中国检验检疫科学研究院,北京 100123)
自Price等[1]从双壳类软体动物(Macrocallista nimbosa)中枢神经系统分离出一种兴奋心脏的多肽分子,苯丙氨酸-蛋氨酸-精氨酸-苯丙氨酸-NH2(Phe-Met-Arg-Phe-NH2,FMRFamide),大量C末端为精氨酸-苯丙氨酸-NH2(RFamide)的生物活性肽从多物种中被分离并鉴定。由于这些多肽的C末端都具有相同的结构:RFamide,故将其统称为RF酰胺肽。大约10年前,这个多肽家族又先后发现了两条新的神经肽,亲吻肽(kisspeptin)和促性腺激素抑制激素(gonadotropin-inhibitory hormone,GnIH)[2-4]。近年越来越多的证据证实,它们能够直接作用于促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)神经元,并对生殖轴的反馈调控起重要作用[5]。
由于GnRH神经元不具备性类固醇激素受体,生殖轴反馈调节研究中的一个重要课题就是性激素通过什么途径来调节GnRH的分泌。近年的研究发现,亲吻肽、GnIH及其受体与正常繁殖有密切的关系;亲吻肽与GnIH都是RF酰胺肽家族的成员,它们所在神经元接收来自性类固醇激素的信号,分泌的相关RF酰胺肽直接作用于GnRH细胞,对生殖轴互为拮抗进行调控[5]。本综述将从发现到表达分布及功能比较阐述亲吻肽和GnIH这对神经肽,探讨两者对生殖轴的拮抗性调节作用。
1 亲吻肽与GnIH的发现
2001年,现在被称为亲吻肽的RF酰胺肽,被证明是孤儿G蛋白偶联受体54(G protein-coupled receptor 54,GPR54)的内源性配体[2-3]。由于编码亲吻肽的基因Kiss 1最初被认为是一种抑制肿瘤转移的因子,该基因的产物起初也被称为肿瘤迁移抑制因子。2003年,亲吻肽调节生殖功能的作用首次被发现。人们在性腺功能低下的个体GPR54基因中发现有一个突变,并且在缺乏GPR54的人和小鼠的下丘脑不能促使垂体分泌足够的促性腺激素,而垂体对外源性GnRH的反应却不受影响[6]。基于这些初步的了解,一些实验室开始系统研究亲吻肽调节GnRH的神经通路及其细胞和分子的机制。
GnIH的发现则是应用抗C末端RF-NH2序列的抗体,通过高效液相色谱及竞争性酶联免疫吸附试验,从鹌鹑脑中被分离鉴定出来[4]。其为一条C末端为RFamide的十二肽:丝氨酸-异亮氨酸-赖氨酸-脯氨酸-丝氨酸-丙氨酸-络氨酸-亮氨酸-脯氨酸-亮氨酸-精氨酸-苯丙氨酸-NH2(SIKPSAYLPLRFamide)。这个新型的下丘脑RF酰胺肽迅速地、剂量相关地抑制鹌鹑垂体原代培养细胞释放促黄体激素。GnIH的受体(G protein-coupled receptor 147,GPR147),一条新型的G蛋白偶联受体,也已在日本鹌鹑脑内被克隆和鉴定[7]。之后,在多种生物(鱼类、两栖类、哺乳类动物,乃至人类)的脑内都发现了GnIH及其受体的同源类似物[8]。在鸟类,GnIH前体基因编码三条活性肽:GnIH、GnIH相关肽1(GnIH related peptide 1,GnIH-RP1)和GnIH相关肽2(GnIH related peptide 2,GnIH-RP2);而在哺乳类,其编码两条活性肽:GnIH-1和GnIH-3。遗传上的保守性提示该基因在进化中起重要作用。
2 亲吻肽与GnIH在脑内的分布
在哺乳动物的脑中具有两种亲吻肽细胞的主要类型,一种存在于弓形核,另一种存在于视前区。在啮齿类动物中,后一种细胞存在于前腹室旁核(anteroventral periventricular nucleus,AVPV)及视交叉前室旁核(preoptic periventricular nucleus,PeV)中。在AVPV/PeV的亲吻肽神经元表达雌激素受体(estrogen receptor-α,ERα),并且雌激素上调亲吻肽的表达。另外,雌激素还下调弓形核的亲吻肽神经元表达[9]。
GnIH神经元在鸟类被发现仅存在于下丘脑室旁核,而纤维则广泛地向脑内头侧投射到腹原纹状体、外侧和内侧隔、视前区,向尾侧投射到正中隆起、顶盖和脑干[10]。在啮齿类和灵长类动物脑内,GnIH末梢也在视前区、隔和布罗卡斜角带(diagonal band of Broca)有发现,而这些区域均有GnRH神经元存在。在羊脑内,具有GnIH免疫活性的扩张纤维存在于接近GnRH细胞的区域。和鸟类一样,在灵长类、羊、仓鼠、大小鼠脑中,40%~80%的GnRH细胞紧密接触有GnIH的免疫活性纤维,说明GnIH可通过直接或间接方式调控GnRH细胞[11]。
3 亲吻肽对生殖轴的正反馈调节作用
3.1亲吻肽细胞直接传递性类固醇反馈调控信号给GnRH细胞 关于雌激素的反馈,由原位杂交及免疫组织化学试验可知,在雌性小鼠脑的AVPV中60%以上的亲吻肽细胞表达ERα[12]。由免疫组织化学染色反应得知,在雌性大鼠脑的AVPV/PeV中,大约90%的亲吻肽细胞表达ERα。在羊脑的弓形核中,基本上所有亲吻肽细胞都表达ERα,而在外侧视前区中有50%细胞表达ERα(图1-3,见封三)。

图1 亲吻肽神经元参与雌激素对GnRH的正反馈调节 1-1:AVPV亲吻肽神经元表达ER(ERα:箭头所指;Kiss-1 mRNA阳性细胞:三角所指。免疫染色加原位杂交,标尺:25μm)[15];1-2:亲吻肽神经元末端投射到GnRH神经元(亲吻肽免疫反应阳性神经末梢:黑色;GnRH免疫阳性细胞体:棕色;箭头所指为接触点。双标记免疫组织化学染色,标尺:15 μm)[16];1-3:GnRH神经元表达GPR54的mRNA(GPR54 mRNA:银染颗粒,白色点群;GnRH mRNA:Vector Red标记,红色。双标记原位杂交,标尺:20μm)[17]
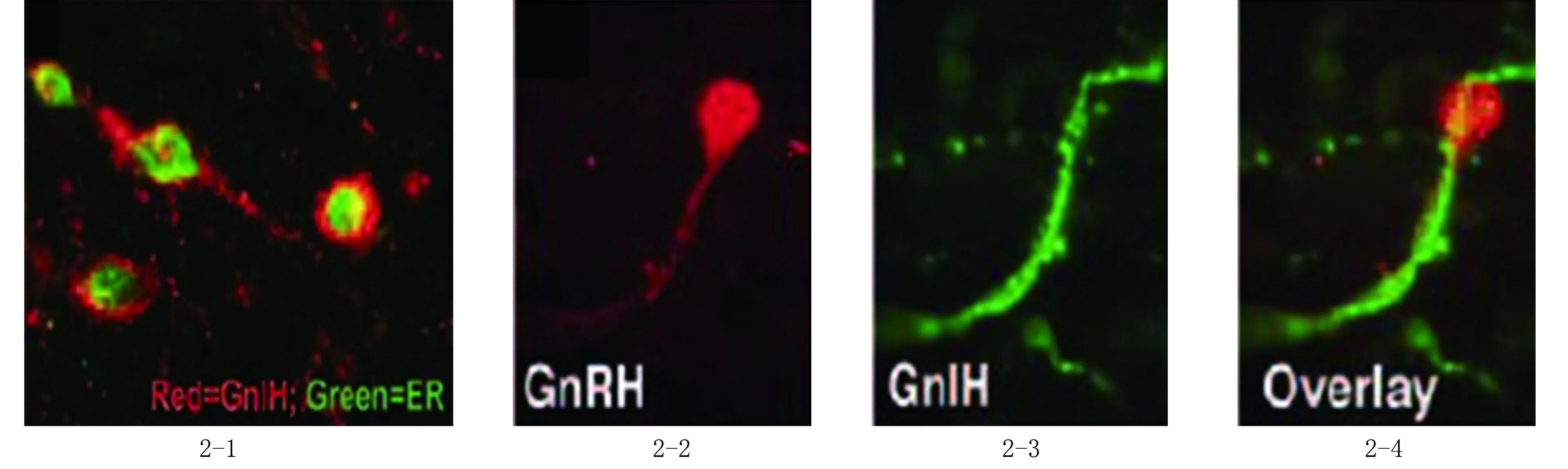
图2 GnIH神经元参与雌激素对GnRH的负反馈调节 2-1:GnIH神经元表达ER(双标记免疫荧光染色,×1000);2-2~2-4:GnIH神经元直接投射于GnRH神经元上(双标记免疫组织化学染色,×1000),其中2-2为GnRH神经元,2-3为GnIH免疫阳性神经纤维,2-4为2-2与2-3重合结果[19]
向脑室中注射亲吻肽10后,对脑脊液中GnRH的测量发现,亲吻肽的注射可引起GnRH的分泌。并且,所有这些GnRH细胞都表达亲吻肽的同源受体GPR54,以上证据说明亲吻肽可接收雌激素调控信号并直接作用于GnRH细胞[13]。
3.2亲吻肽细胞对雌激素的正反馈调控作用 按照一系列判断标准,包括Kiss1基因表达、免疫组织化学测定亲吻肽水平及通过基因剔除和置换模型等方法进行的研究,可知AVPV/PeV中亲吻肽细胞群在功能学上包含于雌激素的正反馈调节内,并且与啮齿类动物排卵前高峰的产生具有重要的联系[14]。在对小鼠及大鼠的研究中许多不同实验室得出一致结论,即在排卵前期(动情前期)大鼠及小鼠脑内AVPV/PeV中亲吻肽细胞上调,而在此时弓形核中亲吻肽细胞下调。因此,认为AVPV/PeV中的亲吻肽细胞对雌激素正反馈作用的传导起重要作用,这种正反馈作用诱导这类动物体内GnRH/促黄体激素在排卵前的释放。
4 GnIH对生殖轴的负反馈调节作用
在羊及非人灵长类中,GnIH神经元表达雌激素受体,具有GnIH免疫活性的扩张纤维存在于接近GnRH细胞的区域(图2-4,见封三)[18-19]。在这种解剖学的基础上,功能学证据证明GnIH对GnRH可发挥直接作用:向脑室内注射GnIH-3可降低去卵巢仓鼠及性腺完整大鼠血液中促黄体激素的分泌,脑室内注射GnIH的反义寡核苷酸链可使大鼠血液中促黄体激素的水平升高到发情期前[19-20]。这些功能学数据与观察到的GnIH细胞投射到GnRH细胞的结果一致,说明GnIH细胞能够被性类固醇激活,参与介导性类固醇激素的负反馈调控。
向切除卵巢的大鼠静脉注射GnIH 2 h之后,血液中促黄体激素的水平降低。向切除卵巢的羊体内连续注射GnIH-3可持续降低促黄体激素的脉冲性分泌,而对血液中其他垂体激素(如生长激素或催乳素)的水平却没有影响。在培养大鼠、羊及牛的垂体细胞中观察到,给予GnIH对GnRH刺激的促黄体激素分泌具有剂量依赖性降低作用,这一结果支持了GnIH对垂体促性腺细胞具有直接作用这一观点[21]。因此,GnIH可在下丘脑和垂体两个水平上抑制促性腺激素的产生和分泌。
5 小 结
作为神经生殖研究中重要的神经内分泌调节因子,亲吻肽与GnIH的发现,引发了人们对生殖轴反馈调控的知识结构性改变。这两个RF酰胺肽在生殖轴的反馈调控方面相互拮抗,亲吻肽主要表现为正反馈,GnIH则表现为负反馈调节作用。它们所在的神经元接收来自性类固醇激素的信息,分泌的多肽直接或间接作用于GnRH神经元,参与类固醇激素对生殖轴的反馈调控。
目前对于这两种RF酰胺肽相互之间的调节作用还了解甚少,亲吻肽能否作用于GnIH神经元以及GnIH对亲吻肽细胞的影响都尚属未知。由于GnIH免疫阳性神经纤维亦投射到弓形核,GnIH是否通过抑制在弓形核的亲吻肽神经元进而参与GnRH的分泌调节,是下一步应该阐明的问题之一。在研究这一组神经肽的相互作用过程中,尚可建立亲吻肽/GnIH双剔除动物模型,以研究双向缺失这两种直接调控GnRH细胞的神经肽,生殖系统可能出现的结果,进而评价两者对生殖调控的重要性。
[1] Price DA,Greenberg MJ.Structure of a molluscan cardioexcitatory neuropeptide[J].Science,1977,197(4304):670-671.
[2] Ohtaki T,Shintani Y,Honda S,etal.Metastasis suppressor gene KiSS-1 encodes peptide ligand of a G-protein-coupled receptor[J].Nature,2001,411(6837):613-617.
[3] Kotani M,Detheux M,Vandenbogaerde A,etal.The metastasis suppressor gene KiSS-1 encodes kisspeptins,the natural ligands of the orphan G protein-coupled receptor GPR54[J].J Biol Chem,2001,276(37):34631-34636.
[4] Tsutsui K,Saigoh E,Ukena K,etal.A novel avian hypothalamic peptide inhibiting gonadotropin release[J].Biochem Biophys Res Commun,2000,275(2):661-667.
[5] Clarke IJ.Control of GnRH secretion:one step back[J].Frontiers in Neuroendocrinology,2011,32(3):367-375.
[6] Seminara SB,Messager S,Chatzidaki EE,etal.The GPR54 gene as a regulator of puberty[J].N Engl J Med,2003,349(17):1614-1627.
[7] Yin H,Ukena K,Ubuka T,etal.A novel G protein-coupled receptor for gonadotropin-inhibitory hormone in the Japanese quail (Coturnix japonica):identification,expression and binding activity[J].J Endocrinol,2005,184(1):257-266.
[8] Smith JT,Clarke IJ.Gonadotropin inhibitory hormone function in mammals[J].Trends Endocrinol Metab,2010,21(4):255-260.
[9] Tomikawa J,Uenoyama Y,Ozawa M,etal.Epigenetic regulation of Kiss1 gene expression mediating estrogen-positive feedback action in the mouse brain[J].Proc Natl Acad Sci U S A,2012,109 (20):E1294-E1301.
[10] Ukena K,Ubuka T,Tsutsui K.Distribution of a novel avian gonadotropin-inhibitory hormone in the quail brain[J].Cell Tissue Res,2003,312(1):73-79.
[11] Clarke IJ,Qi Y,Puspita Sari I,etal.Evidence that RF-amide related peptides are inhibitors of reproduction in mammals[J].Front Neuroendocrinol,2009,30(3):371-378.
[12] Gottsch ML,Cunningham MJ,Smith JT,etal.A role for kisspeptins in the regulation of gonadotropin secretion in the mouse[J].Endocrinology,2004,145(9):4073-4077.
[13] Messager S,Chatzidaki EE,Ma D,etal.Kisspeptin directly stimulates gonadotropin-releasing hormone release via G protein-coupled receptor 54[J].Proc Natl Acad Sci U S A,2005,102(5):1761-1766.
[14] Wintermantel TM,Campbell RE,Porteous R,etal.Denition of estrogen receptor pathway critical for estrogen positive feedback to gonadotropin-releasing hormone neurons and fertility[J].Neuron,2006,52(2):271-280.
[15] Adachi S,Yamada S,Takatsu Y,etal.Involvement of anteroventral periventricular Metastin/Kisspeptin neurons in estrogen positive feedback action on luteinizing hormone release in female rats[J].J Reprod Dev,2007,53(2):369-380.
[16] Smith JT,Coolen LM,Kriegsfeld LJ,etal.Variation in kisspeptin and RFamide-related peptide (RFRP) expression and terminal connections to gonadotropin-releasing hormone neurons in the brain:a novel medium for seasonal breeding in the sheep[J].Endocrinology,2008,149(11):5770-5782.
[17] Han SK,Gottsch ML,Lee KJ,etal.Activation of gonadotropin-releasing hormone neurons by kisspeptin as a neuroendocrine switch for the onset of puberty[J].J Neuroscience,2005,25(49):11349-11356.
[18] Smith JT,Shahab M,Pereira A,etal.Hypothalamic expression of KISS1 and gonadotropin inhibitory hormone genes during the menstrual cycle of a non-human primate[J].Biol Reprod,2010,83(4):568-577.
[19] Kriegsfeld LJ,Mei DF,Bentley GE,etal.Identi cation and characterization of a gonadotropin-inhibitory system in the brains of mammals[J].Proc Natl Acad Sci U S A,2006,103(7):2410-2415.
[20] Johnson MA,Fraley GS.Rat RFRP-3 alters hypothalamic GHRH expression and growth hormone secretion but does not affect KiSS-1 gene expression or the onset of puberty in male rats[J].Neuroendocrinology,2008,88(4):305-315.
[21] Sari IP,Rao A,Smith JT,etal.Effect of RF-amide related peptide-3 on LH and FSH synthesis and secretion in ovine pituitary gonadotropes[J].Endocrinology,2009,150(12):5549-5556.
