脓毒症脂联素与白细胞介素6、C反应蛋白相关性研究
2014-03-27唐绍辉潘志国
唐绍辉,潘志国
(广州军区广州总医院 1.急诊科, 2.重症医学科 全军热区创伤救治与组织修复重点实验室,广州510010)
脂联素是近年来新发现的由脂肪组织特异性分泌的一种具有多种生物学效应的细胞因子,具有调节炎性反应、调节脂质代谢及改善胰岛素抵抗等多种生物学功能[1]。有研究显示,在冠状动脉粥样硬化性心脏病等慢性炎症疾病过程中脂联素能够显著抑制多种促炎因子,如肿瘤坏死因子α和白细胞介素(interleukin,IL)1β等的表达[2],脓毒症是感染因素引起大量炎性介质释放导致的组织细胞及器官功能的损伤,其脂联素水平及其与炎性因子大量释放的关系,目前国内外文献报道较少。本研究旨在探讨脓毒症患者中血清脂联素水平与炎性因子IL-6及C反应蛋白(C-reactive protein,CPR)之间的关系。
1 资料与方法
1.1一般资料 收集整理广州军区广州总医院2009年10月至2012年10月脓毒症患者病例41例,同时以单纯随机抽样的方式选取同时期住院非脓毒症患者病例作为对照。脓毒症组和非脓毒症组以1∶1配对。脓毒症诊断标准参照1991年美国胸病医师学会和美国危重病学会提出的脓毒症诊断标准[3]。两组患者在性别、年龄、体质量指数、血压、体温及血脂情况等方面差异无统计学意义,具有可比性(表1)。所有病例排除既往存在慢性心肺疾病、恶性肿瘤、风湿、肝硬化及糖尿病等疾病。

表1 脓毒症组与非脓毒症组一般资料比较
1.2方法 记录患者入院时的一般临床资料及实验室资料。清晨采集静脉血液约5 mL,血标本肝素抗凝,静置30 min后,在4 ℃条件下以离心半径13.5 cm、3000 r/min 离心10 min,分离血浆,置于-70 ℃冰箱冻存备检。用酶联免疫吸附法检测血浆脂联素和IL-6水平,用速率散射免疫比浊法检测CRP的水平。
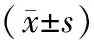
2 结 果
2.1脓毒症组与非脓毒症组脂联素、IL-6及CPR水平分析 脓毒症组血清脂联素水平显著低于非脓毒症组,而IL-6及CPR含量显著高于非脓毒症组,比较差异有统计学意义(P<0.05)(表2)。

表2 两组患者脂联素、IL-6及CPR水平比较
2.2脓毒症患者血浆脂联素水平与IL-6、CRP水平的相关性分析 脓毒症患者血浆脂联素与IL-6水平的相关性分析见图1,本组病例显示血浆脂联素与IL-6水平呈负相关(r=-0.726,P<0.01);脓毒症患者血浆脂联素与CRP水平的相关性分析见图2,研究对象血浆脂联素与CRP水平呈负相关(r=-0.883,P<0.01)。

图1 脓毒症患者血浆脂联素水平与IL-6水平相关性分析

图2 脓毒症患者血浆脂联素水平与CPR水平相关性分析
3 讨 论
脓毒症是严重感染、创伤、休克及大手术后等常见的剧烈全身性反应,进一步发展可引起脓毒性休克和组织器官继发性损伤,严重威胁患者生命健康[4]。目前已明确,炎性因子释放失控、爆发性增加在脓毒症病理过程中起着关键作用。作为目前研究比较多的炎性介质IL-6和CRP在本组病例脓毒症患者中呈显著上升,与王洪霞等[5]报道一致。脂联素是脂肪组织中表达量最丰富的脂肪因子,约占血浆蛋白总量的0.01%[1],被认为是脂肪组织特异的分泌产物,目前脂联素与脓毒症的相关关系的研究不多。Venkatesh等[6]研究发现,脂联素在脓毒症患者中表达下降,推测其在脓毒症的炎性反应中起作用,但其作用机制尚不明确。本研究也发现脓毒症患者脂联素水平显著下降,认为一方面与李莎等[7]的研究一致,因为脂联素属于拥有胶原结构域的蛋白质一族,可以与脓毒症导致的血管损伤后暴露的内皮下胶原结合,从而消耗机体内的脂联素;另一方面根据Tsuchihashi等[8]的研究,推测脂联素与脓毒症患者体内的脂多糖结合形成分子质量更大的蛋白复合物,从而导致脂联素的水平降低。
本组病例进一步研究发现,脓毒症患者脂联素水平下降与IL-6和CRP的表达呈显著负相关,提示脂联素具有降低脓毒症患者全身炎性反应的效应。脂多糖作为炎性因子的强烈诱导剂,是脓毒症炎性反应的关键,脂联素与脂多糖共孵育形成大分子蛋白复合物,直接中和脓毒血症的脂多糖,从而抑制脂肪细胞中脂多糖诱导的IL-6产生[8]。另外,有研究已发现联素不但可以促进单核/巨噬细胞从促炎表型向抗炎表型变化,而且可抑制环腺苷酸依赖性蛋白激酶A(Cyclic adenosine monophosphate-protein kinase A,cAMP-PKA)信号通路介导核因子κB的信号转导,单核/巨噬细胞及cAMP-PKA介导核因子κB的信号转导可促使炎性介质IL-6、肿瘤坏死因子α等炎性因子的产生,IL-6及肿瘤坏死因子α等炎性因子能在肝脏中对CRP的产生起调节作用[9-10],在脓毒血症病理过程中脂联素可能通过这两条途径减少炎性介质IL-6、CRP的产生。Kaplan等[11]研究发现,脓毒症大鼠过氧化物酶体增殖物激活受体γ活性与脂联素表达水平呈正相关,而氧化物酶体增殖物激活受体γ已证实可抑制炎性因子释放,脂联素降低脓毒症患者全身炎性反应还可能与此相关。
众多证据表明,脂联素可能参与了脓毒症相关的病理生理过程,但其具体作用机制还有待进一步阐明。脂联素与患者血清IL-6和CRP的表达呈负相关,提示脂联素在脓毒症病理生理过程中参与了炎性反应的调节,从而也提示,脂联素可作为脓毒症治疗的调控靶标,因此进一步阐明脂联素的具体抗炎机制,明确脂联素的作用时间窗,对脓毒症的临床防治意义重大。
[1] Ohashi K,Ouchi NY,Matsuzawa YJ.Anti-inflammatory and anti-atherogenic properties of adiponectin[J].Biochimie,2012,94(10):2137-2142.
[2] Cheng X,Folco EJ,Shimize K,etal.Adiponectin induces pro-inflammatory programs in human macrophages and CD4+T cells[J].J.Biol.Chem,2012,287(4):36896-36904.
[3] Bone RC,Balk RA,Cerra FK,etal.Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis.The ACCP/SCCM Consensus Conference Committee.American College of Chest Physicians/Society of Critical Care Medicine[J].Chest,1992,101(6):1644-1655.
[4] Pappachan JV,Coulson TG,Child NJ,etal.Mortality in adult intensive care patients with severe systemic inflammatory response syndromes is strongly associated with the hypoimmune TNF-238A polymorphism[J].Immunogenetics,2009,61(10):657-662.
[5] 王洪霞,陈兵.脓毒症早期诊断生化标志物的研究进展[J].医学综述,2011,17(15):2256-2258.
[6] Venkatesh B,Hickman I,Nisbett J,etal.Changes in serum adiponectin,concentrations in critical illness:a preliminary investigation[J].Crit Care,2009,13(4):R105.
[7] 李莎,鲍红光.脓毒症大鼠脂联素表达水平变化的实验研究[J].中华临床医师杂志,2011,5(1):125-129.
[8] Tsuchihashi H,Yamamoto H,Maeda K,etal.Circulating concentrations of adiponectin,an endogenous lipopolysaccharide neutralizing protein,decrease in rats with polymicrobial sepsis[J].J Surg Res,2006,134(2):348-353.
[9] Ohashi K,Parker JL,Ouchi N,etal.Adiponectin promotes macrophage polarization toward an anti- inflammatory Phenotype[J].J Biol Chem,Feb,2010,285:6153-6160.
[10] Ouchi N,Kihara S,Arita Y,etal.Adiponectin,an adipocyte-derived plasma protein,inhibits endothelial NF-kappa B signaling through a cAMP-dependent pathway[J].Circulation,2000,102(11):1296-1301.
[11] Kaplan JM,Hake PW,Denenberg A,etal.Phosphorylation of extracellular signalregulated kinase(ERK)-1/2 IsAssociated with the downregulation of peroxisome proliferator-activated receptor (PPAR)-γ during polymicrobial sepsis[J].Mol Med,2010,16(11/12):491-497.
