谷氨酰胺对饲喂高精料的奶山羊瘤胃上皮的保护效应研究
2014-03-26刘玉洁刘军花许婷婷朱伟云毛胜勇
刘玉洁,刘军花,许婷婷,朱伟云,毛胜勇
(南京农业大学动物科技学院,江苏 南京210095)
瘤胃酸中毒是一种在反刍动物生产中发生率较高的营养代谢病,尤以高产奶牛和育肥牛最为常见,其主要诱因为动物采食过多精饲料或饲料中精粗饲料搭配不合理导致[1]。瘤胃酸中毒可损伤瘤胃上皮屏障,增加肠道通透性,激发宿主炎症应答,诱发肠炎等营养代谢病,导致动物生产性能下降,给畜牧生产带来极大的经济损失。因此,探索有助于在高精料条件下保持瘤胃上皮屏障的正常生理功能的措施,对于保障动物生产性能的发挥及提高动物福利皆具有重要理论价值与应用意义。
谷氨酰胺(glutamine,Gln)是血液循环和组织内游离氨基酸池中含量最丰富的一种氨基酸,Gln可为上皮细胞提供能源物质,具有维持机体酸碱平衡、促进氮平衡、保持肠黏膜完整、维持紧密连接蛋白的完整性、促进免疫细胞的增殖和防止细菌移位和肠道毒素血症的功能[2]。在人和单胃动物肠道营养上的研究显示,Gln可改善患者全身免疫功能和营养代谢状态[3],降低大鼠炎症介质TNF-α、IL-6和内毒素水平[4],可快速逆转大鼠烧伤后紧密连接结构蛋白occludin、ZO-1表达下降,上调肠黏膜的屏障功能[5]。在反刍动物营养中的研究表明,Gln可为瘤胃上皮提供能量[6],可提高犊牛小肠黏膜中DNA、RNA及蛋白质的含量,提高小肠黏膜细胞的生长速度[7]。借鉴Gln在上述人、单胃和反刍动物胃肠道营养领域中的相关进展,本研究提出如下假说:日粮中添加Gln可降低高精料对瘤胃上皮生理结构的损伤,在一定程度上改善受损瘤胃上皮的屏障功能。由此,本试验拟利用饲喂高精料日粮的奶山羊为模型动物,研究添加Gln对山羊瘤胃发酵、瘤胃上皮形态结构、炎症因子及紧密连接蛋白表达的影响,以期为Gln在奶牛养殖中的应用提供科学依据,为调控瘤胃上皮屏障的生理功能提供新思路。
1 材料与方法
实验于2012年1-4月在南京农业大学动物房进行。
1.1 实验动物及日粮
选用12头健康、体重相近的2.5岁的经产萨能奶山羊母羊(41.5±0.8kg),统一驱虫、单栏饲养。日粮按NRC标准配制(表1),精粗比为7∶3。山羊的采食量预设为1.3kg干物质。每日饲喂两次(8:00和17:30),每次等量饲喂,自由饮水。按常规手术方法安装永久性瘤胃瘘管。
1.2 试验设计
采用随机区组实验设计,分别将12头奶山羊随机分为两组,即不添加Gln的对照组和添加过瘤胃Gln(50 g/d)的处理组,每处理设6个重复。实验期共29d,分别于第7,14,21,28天晨饲前(0h)和晨饲后(4h)采集瘤胃液。过瘤胃Gln由浙江康德全公司生产。

表1 日粮配方及营养水平Table 1 Ingredient and nutrient levels of the diets
1.3 样品采集
在上述各取样时间点,利用自制负压装置,分别从12头奶山羊瘤胃瘘管各采集150mL瘤胃液,所采瘤胃液经4层纱布过滤后,将滤液置于洁净的烧杯中,混合均匀后,立即测定瘤胃液pH,而后将瘤胃液转入离心管中,-20℃冻存,备测挥发性脂肪酸浓度。在实验期的第29天屠宰山羊后,迅速采集瘤胃腹囊部的上皮组织样,用冰磷酸缓冲液清洗干净后,将上皮组织分成3等份,第1份于液氮保存,用于RNA抽提;第2份用2.5%戊二醛固定,用于扫描和透射电镜观察;第3份用4%多聚甲醛固定,用于石蜡切片。
1.4 指标测定及方法
1.4.1 瘤胃发酵参数的测定 采用比色法测定瘤胃液乳酸浓度[8],采用气相色谱法(GC-14B气相色谱仪,日本,柱温110℃,气化室温度180℃,检测室温度180℃)测定挥发性脂肪酸浓度[9]。
1.4.2 组织切片的处理 用4% 多聚甲醛固定,洗涤、酒精梯度脱水、浸蜡、包埋、切片、帖片、脱蜡复水、苏木精-伊红染色、封固,在光镜下观察瘤胃上皮形态的变化。
1.4.3 电镜样品的处理 用冰磷酸缓冲液反复清洗样品,2.5% 的戊二醛固定后,磷酸缓冲液清洗,采用乙醇脱水后,冷冻干燥仪干燥样品,用离子溅射仪镀膜,扫描电子显微镜进行观察(S-3000N,日本,HITACHI)。透射电镜实验中的样品前处理与扫描电镜预处理一致,缀以1%的锇酸固定,乙醇梯度脱水,用丙酮置换后,浸渍、包埋、聚合,修块使样品表面积小于0.2mm×0.2mm,超薄切片,经铀染色与铅染色清洗后,透射电子显微镜(H-7650,日本,HITACHI)进行观察。
1.4.4 炎症因子及紧密连接蛋白表达量的测定 瘤胃上皮的总RNA的提取参照Chomczynski和Sacchi[10],采用微量分光光度计(NANODROP 1000)测定总RNA浓度和纯度。RNA反转录条件与引物参照Liu等[11]的文献,反转录产物于-20℃储存备用。采用实时荧光定量PCR仪(StepOnePlusTMReal-Time PCR System,Ap-plied Biosystems,美国)评估肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)、γ干扰素(interferon-γ,IFN-γ)、白介素-1β(interleukin-1β,IL-1β)、白介素-6(interleukin-6,IL-6)、白介素-10(interleukin-10,IL-10)、紧密连接蛋白occludin、claudin-1、claudin-4和ZO-1(zonula occludens-1)mRNA 的相对表达水平,基因表达量采用2-△△Ct法进行处理。
1.5 数据处理
瘤胃pH、挥发性脂肪酸(volatile fatty acid,VFA)和乳酸浓度采用SPSS(SPSS version 18.0,Chicago,IL)软件的混合模型统计,统计模型为:Xij=μ+Ti+Pj+T×Pij+eij,式中,μ为常数项,各自变量均为0时Xij的平均数,Ti为日粮处理(i=1~2),Pj为采样期(i=1~4),T×Pij为处理与采样期间(period)的互作效应,各采样时间点(Time)为重复因子,eij为随机效应。瘤胃上皮中炎症因子与紧密连接蛋白表达数据采用Independent T-test进行统计分析。将显著性水平置于P<0.05,0.05≤P<0.1表示处理间存在统计趋势。
2 结果与分析
2.1 高精料日粮中添加谷氨酰胺对奶山羊瘤胃发酵参数的影响
与对照组相比,添加Gln降低了瘤胃液中丙酸浓度(P=0.004),有降低乳酸(P=0.078)和提高丁酸(P=0.059)浓度的趋势,但对乙酸、异丁酸、戊酸、异戊酸和总挥发性脂肪酸浓度无显著影响(P>0.05),添加谷氨酰胺显著提高了乙酸与丙酸的比值(P<0.001)。除戊酸外(P=0.103),采样各期对挥发性脂肪酸有显著影响(P<0.01),除乙酸外(P=0.022),采样期与日粮间无显著的互作效应(P>0.05)(表2)。
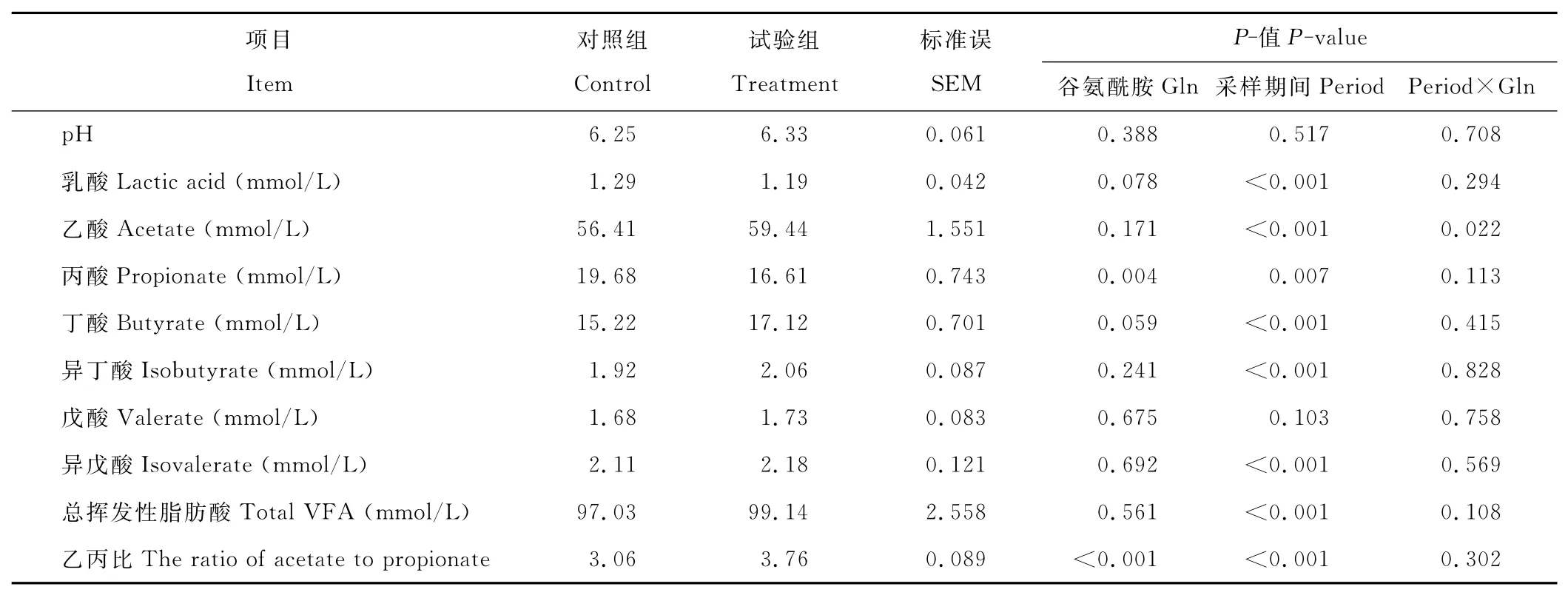
表2 高精料日粮中添加谷氨酰胺对奶山羊瘤胃发酵参数的影响Table 2 The effects of glutamine addition on ruminal fermentation parameters of dairy goats fed high grain diet
2.2 高精料日粮中添加谷氨酰胺对瘤胃上皮形态的影响
光学显微镜的结果表明,对照组角质层的边缘细胞发生破裂(图1A),而Gln组角质层的细胞完整(图1B);扫描电镜观察可见,对照组瘤胃上皮出现大面积的坍塌(图1C),Gln组角质层有更深更长的裂隙(图1D)。透射电镜观察显示,对照组细胞间的连接不紧密,呈弥散状(图1E),Gln处理组细胞间的连接紧密(图1H);对照组的颗粒层细胞核萎缩,甚至空泡无核(图1F),Gln组细胞核呈卵圆形,无空泡(图1I);对照组的基底层细胞萎缩,富含大量角质化颗粒(图1G),而Gln处理组的基底层细胞呈立方形,结构完整(图1J)。
2.3 高精料日粮中添加谷氨酰胺对奶山羊瘤胃上皮炎症因子基因表达的影响
由表3可见,添加谷氨酰胺显著降低了奶山羊瘤胃上皮TNF-αmRNA的表达量(P<0.05),但对瘤胃上皮内IFN-γ、IL-1β、IL-6和IL-10mRNA的相对表达量无显著影响(P>0.05)。
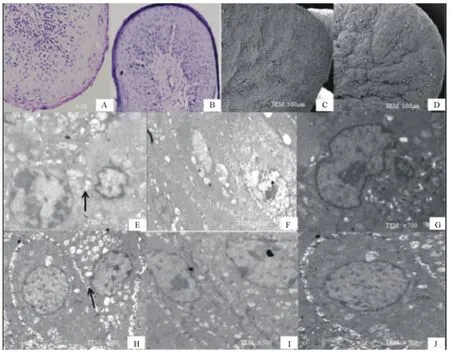
图1 谷氨酰胺对瘤胃上皮形态的影响Fig.1 The effect of glutamine addition on changes in histomorphology of rumen epithelia

表3 高精料日粮中添加谷氨酰胺对奶山羊瘤胃上皮中炎症因子mRNA相对表达量的影响Table 3 Effect of glutamine supplementation on the mRNA relative expression of inflammatory cytokine of rumen epithelium in dairy goats fed the high grain diet
2.4 高精料日粮中添加谷氨酰胺对奶山羊瘤胃上皮紧密连接蛋白mRNA表达量的影响
由表4可见,高精料日粮中添加Gln对紧密连接蛋白claudin-1、claudin-4、ZO-1mRNA 的表达量无显著影响(P>0.05),但添加Gln可显著提高瘤胃上皮occludin mRNA的表达量(P<0.05)。
3 讨论
瘤胃是反刍动物免疫系统的重要组成部分,瘤胃上皮屏障在维持离子吸收所必需的浓度梯度,以及在阻止瘤胃微生物、脂多糖和其他毒物因子的移位方面起着重要屏障作用[12],饲喂高精料可导致瘤胃上皮角质层出现坍塌[13],细胞间的连接受损,间隙变大,颗粒层的厚度减少[14],最终使瘤胃上皮屏障受损,瘤胃内的内毒素发生移位。内毒素进入血液循环系统后,通过致宿主炎症应答,导致动物生产性能下降,乳品质降低[15],给畜牧生产造成了极大的经济损失。在本研究中,对照组中瘤胃上皮紧密连接受损,胞内间隙变大,显示瘤胃上皮的正常屏障结构发生改变,该结果达到了预期实验目的,也与上述报道一致。
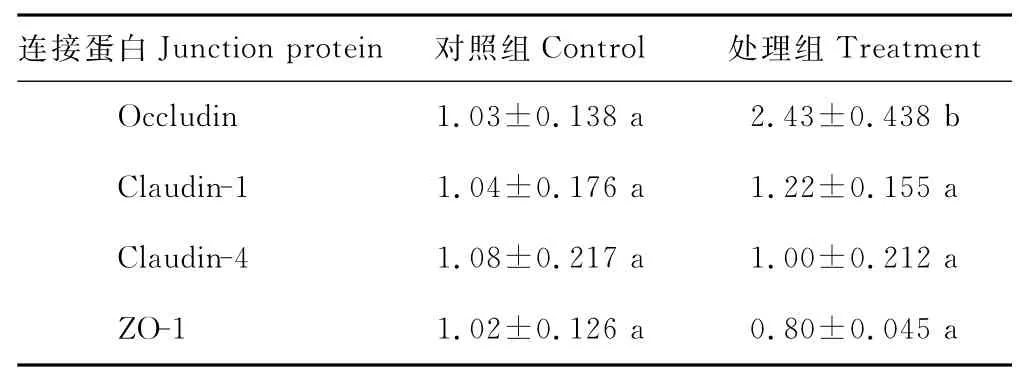
表4 高精料日粮中添加谷氨酰胺对奶山羊瘤胃上皮紧密连接蛋白mRNA相对表达量的影响Table 4 The effect of glutamine addition on the tight junction mRNA relative expression levels of rumen epithelium in dairy goats fed high grain diet
研究表明,当动物处于应激状态时,体内新合成的Gln不能满足机体的需要,Gln的不足会导致绒毛萎缩,黏膜溃疡,小肠细胞坏死,而添加Gln有利于维持肠上皮结构完整[2]。本研究中,对照组的瘤胃上皮连接受损;但添加Gln组的山羊瘤胃上皮超微结构完整,细胞间连接紧密、界限清晰,胞核完整。结果说明添加过瘤胃Gln可维持瘤胃上皮结构完整,本实验结果与单胃动物上的结果基本一致。
紧密连接是瘤胃上皮屏障中的重要结构,对维持上皮细胞极性、调节上皮屏障的通透性和阻止瘤胃细菌、内毒素和其他毒性大分子物质进入体内发挥着重要作用[16]。体外研究发现,caco-2细胞在缺乏Gln时,导致claudin-1和occludin的表达量下降,二者在细胞间重新排布[17];而采用Gln处理可显著减缓乙醛诱导的人结肠黏膜中细胞间连接的occludin和ZO-l重新分布[18]。本研究表明,补充Gln能逆转紧密连接蛋白occludin表达的下降,其机制可能与Gln降低了炎症因子的生成有关。在山羊上的研究显示,瘤胃上皮组织中炎性细胞因子TNF-α、IFN-γmRNA的表达量与紧密连接蛋白表达量呈显著相关[11]。对三硝基苯磺酸诱导结肠炎的小鼠给予Gln处理,发现Gln可减轻TNF-α的产生、释放[19]。此外,前人研究表明,通过皱胃灌注Gln,可提高奶牛血浆中Gln含量[20]。因此,本实验中,添加的过瘤胃Gln在肠道吸收后,通过血液循环可进入瘤胃上皮系统。在小鼠和猪上的研究表明,Gln可降低炎症反应[19,21]。在奶牛的研究显示,应用Gln可提高宿主的免疫应答[22-23]。由此,进入瘤胃上皮系统的Gln可通过降低上皮组织中的炎症反应,削弱炎症因子对上皮屏障的损伤,从而维持瘤胃上皮超微结构的功能。增强的上皮屏障可阻止病原菌及内毒素等致炎因子进入血液,从而进一步降低瘤胃内源性毒物因子导致的炎症反应,该推测也与实验结果一致。本研究中,促炎症因子TNF-αmRNA表达量显著降低,同时谷氨酰胺组瘤胃上皮结构完整。上述结果说明,高精料日粮中添加Gln可下调瘤胃上皮中部分炎症因子的表达,降低高精料日粮对瘤胃上皮屏障的损伤。
本研究中,添加Gln降低了瘤胃液中丙酸和乳酸浓度,提高了丁酸浓度,其结果可能与Gln间接影响了瘤胃内挥发性脂肪酸的排空、瘤胃上皮内VFA的代谢及瘤胃微生物区系平衡等有关。在瘤胃中,VFA的排空主要通过瘤胃上皮吸收与瘤胃向网胃的流动实现。瘤胃上皮的吸收主要有自由扩散及载体转运两种方式。在本研究中,丙酸含量降低可能与瘤胃上皮的吸收加快有关。在正常生理下,丙酸是反刍动物体内的主要糖前体物,机体可能通过加快对其的吸收来满足机体的正常代谢,结果导致瘤胃内丙酸浓度下降。丁酸作为一类重要的细胞能源物质,能够抑制瘤胃上皮的凋亡,促进瘤胃上皮的增殖[24-25]。在正常生理条件下,瘤胃上皮细胞内丁酸浓度是非常稳定的,但在病理条件下,机体常通过补偿代谢以最大程度的维持细胞的完整性[14]。本实验中,对照组的上皮结构被破坏,瘤胃上皮的凋亡速度加快,机体为最大程度的维持上皮结构的稳定,需要大量的能量以促进瘤胃上皮细胞的生长,这可能引起瘤胃中丁酸的吸收速度加快,从而导致对照组中瘤胃内丁酸浓度低于Gln组。本研究中,乳酸含量的变化可能与瘤胃内的微生物群体变化相关,但由于本研究未进一步研究瘤胃中乳酸利用菌的变化,该方面的具体机制尚不清楚。但本研究结果显示,添加Gln可改变瘤胃内部分VFA的浓度和发酵方式(乙丙比发生改变),其机制可能与Gln间接影响了瘤胃上皮生理功能及瘤胃内环境等有关。
4 结论
在饲喂高精料的奶山羊日粮中添加过瘤胃Gln可维持瘤胃上皮形态结构完整,降低瘤胃上皮的炎症反应,改善紧密连接,并在一定程度上影响瘤胃内VFA的组成。结果说明,日粮中应用过瘤胃Gln有助于降低高精料对瘤胃上皮屏障功能的损伤。
[1] 邓露芳,卜登攀,王加启,等.饲用微生物缓解瘤胃酸中毒机理的研究进展[J].中国奶牛,2008,(3):16-18.
[2] Rao R K,Samak G.Role of glutamine in protection of intestinal epithelial tight junctions[J].Journal of Epithelial Biology and Pharmacology,2012,5(1):47-54.
[3] 马晓菁,马兵,谢东珊,等.谷氨酰胺对严重烧伤后肠黏膜和机体免疫功能保护作用的临床观察[J].西安交通大学学报,2009,30(3):359-362.
[4] 谷俊朝,马涛,张忠涛,等.谷氨酰胺对腹腔感染肠黏膜屏障的保护作用[J].北京医学,2006,28(9):540-543.
[5] 邓志云,郭光华,杨毅.早期肠内谷氨酰胺补给对烫伤大鼠肠黏膜细胞紧密连接的影响[J].世界华人消化杂志,2009,(20):2031-2036.
[6] Rémond D,Ortigues I,Jouany J P.Energy substrates for the rumen epithelium[J].The Proceedings of the Nutrition Society,1995,54(1):95-105.
[7] 周玉香,张培松,卢德勋,等.谷氨酰胺对犊牛骨骼肌和小肠黏膜蛋白质及其DNA和RNA含量的影响[J].畜牧与兽医,2010,42(1):17-20.
[8] 张龙翔,张庭芳,李玲媛.生化试验方法和技术(第二版)[M].北京:高等教育出版社,1997.
[9] 秦为琳.应用气相色谱测定挥发性脂肪酸方法的研究改进[J].南京农业大学学报,1982,5:110-116.
[10] Chomczynski P,Sacchi N.Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction[J].Analytical Biochemistry,1987,162(1):156-159.
[11] Liu J H,Xu T T,Liu Y J,etal.A high-grain diet causes massive disruption of ruminal epithelial tight junctions in goats[J].American Journal of Physiology-Regulatory,Integrative and Comparative Physiology,2013,305(3):232-241.
[12] Penner G B,Steele M A,Aschenbach J R,etal.Ruminant nutrition symposium:Molecular adaptation of ruminal epithelia to highly fermentable diets[J].Journal of Animal Science,2011,89(4):1108-1119.
[13] Steele M A,AlZahal O,Hook S E,etal.Ruminal acidosis and the rapid onset of ruminal parakeratosis in a mature dairy cow:a case report[J].Acta Veterinaria Scandinavica,2009,51:39.
[14] Steele M A,Croom J,Kahler M,etal.Bovine rumen epithelium undergoes rapid structural adaptations during grain-induced subacute ruminal acidosis[J].American Journal of Physiology-Regulatory,Integrative and Comparative Physiology,2011,300(6):1515-1523.
[15] Khafipour E,Krause D O,Plaizier J C.A grain-based subacute ruminal acidosis challenge causes translocation of lipopolysaccharide and triggers inflammation[J].Journal of Dairy Science,2009,92(3):1060-1070.
[16] Graham C,Simmons N L.Functional organization of the bovine rumen epithelium[J].American Journal of Physiology-Regulatory,Integrative and Comparative Physiology,2005,288(1):173-181.
[17] Li N,Lewis P,Samuelson D,etal.Glutamine regulates Caco-2cell tight junction proteins[J].American Journal of Physiology Gastrointestinal and Liver Physiology,2004,287(3):726-733.
[18] Basuroy S,Sheth P,Mansbach C M,etal.Acetaldehyde disrupts tight junctions and adherens junctions in human colonic mucosa:protection by EGF and L-g1utamine[J].American Journal of Physiology Gastrointestinal and Liver Physiology,2005,289(2):367-375.
[19] Ameho C K,Adjei A A,Harrison E K,etal.Prophylactic effect of dietary glutamine supplementation on interleukin 8and tumour necrosis factoráproduction in trinitrobenzene sulphonic acid induced colitis[J].Gut,1997,41(4):487-493.
[20] Doepel L,Lessard M,Gagnon N,etal.Effect of postruminal glutamine supplementation on immune response and milk production in dairy cows[J].Journal of Dairy Science,2006,89(8):3107-3121.
[21] Ewaschuk J B,Murdoch G K,Johnson I R,etal.Glutamine supplementation improves intestinal barrier function in a weaned piglet model of Escherichia coli infection[J].The British of Journal of Nutrition,2011,106(6):870-877.
[22] Caroprese M,Albenzio M,Marino R,etal.Immune response and milk production of dairy cows fed graded levels of rumenprotected glutamine[J].Research in Veterinary Science,2012,93(1):202-209.
[23] Caroprese M,Albenzio M,Marino R,etal.Dietary glutamine enhances immune responses of dairy cows under high ambient temperature[J].Journal of Dairy Science,2013,96(5):3002-3011.
[24] Mentschel J,Leiser R,Mulling C,etal.Butyric acid stimulates rumen mucosa development in the calf mainly by a reduction of apoptosis[J].Archiv für Tierernaehrung,2001,55(2):85-102.
[25] Sakata T,Tamate H.Rumen epithelial cell proliferation accelerated by rapid increase in intraruminal butyrate[J].Journal of Dairy Science,1978,61(8):1109-1113.
