铅胁迫对三种暖季型草坪草生长和生理特性的影响
2014-03-26李西吴亚娇孙凌霞
李西,吴亚娇,孙凌霞
(四川农业大学风景园林学院,四川 成都611130)
随着人类社会的不断进步和工业化进程的加快,环境污染成了日益突出的重要生态问题之一,由于重金属在环境中只存在价态的转化,而且不能被微生物降解,具有隐蔽性、长期性、滞后性和不可逆性的特点,因此,土壤重金属污染已成为当前环境科学界普遍关注的重大环境问题[1-3]。其中在土壤重金属污染中,铅污染尤其突出,污染土壤中的铅不仅会对植物、动物及微生物造成机体损害,而且也严重影响了整个生态系统的进行[4-6]。
国内外研究发现,在铅胁迫下,植物在形态学上的反应表现为根系生物量的减少及形态的变化,地上部生长速度减缓,植物失水萎蔫[7-9],而在生理生化方面表现为根系活力的降低[10],叶绿素含量的降低[11],细胞膜透性急剧增加[12],体内的保护酶系统修复功能减弱降低[13-14]。目前的研究认为植物防御铅胁迫通过3种机制:第1种是通过细胞壁对铅进行沉淀、区隔化,从而阻止铅离子进入原生质伤害细胞[15-16];第2种耐性机制是通过激活自身的抗氧化系统来抵御活性氧对细胞的伤害[17-18]。第3种耐性机制是利用植物体内的螯合肽或根系分泌物如柠檬酸同铅形成的无毒的可溶性络合物,从而通过抑制铅的跨膜运输,来降低铅的活性及移动性[19-20]。为降低铅污染物质的危害,不少学者利用各种植物的特殊功能在净化和改良受污染环境方面已做了大量的研究工作。目前铅污染土壤植物修复技术一个主要措施是通过外施螯合剂如EDTA,进而提高植物从土壤中转移铅的效率[20]。
草坪和地被植物具有生长速度快、生物量大、再生能力强、易于种植等特点,可以迅速覆盖和绿化受铅污染的区域,因此筛选耐铅性强或有铅富集能力的草坪植物对铅污染区域的生态恢复具有重要的意义[21]。假俭草(Eremochloaophiuroides)、狗牙根(Cynodondactylon)和结缕草(Zoysiajaponica)是我国草坪绿化常用的草坪植物,因其具有植株低矮、质地纤细、色泽好等优点,被国内外广泛用于建植运动场、公园、墓地及固土护坡。目前这3种草在铅胁迫下的生理反应还未见报道。基于以上背景,本试验以该3种暖季型草坪草——假俭草、狗牙根、结缕草为研究对象,采用盆栽控制法,研究不同浓度的铅对3种草坪草生理过程的影响,进而分析与比较3种草坪草的抗铅能力,为受铅污染区域的草坪绿地建设规划、生物修复提供一定的参考依据。
1 材料与方法
1.1 试验材料
供试的草坪材料分别为假俭草品种 “Common”,狗牙根品种“百慕大”和结缕草品种“美依一代”,草种购于江苏新泰种业批发有限公司。2013年4月播种于直径37.5cm圆形塑料花盆中,栽培基质为混合沙土(V土∶V沙∶V营养土=2∶2∶1),每盆装15kg基质土壤,人工除去盆中的杂草。待草坪草正常生长2个月并成坪后,设定草坪草修剪高度为10cm,进行盆栽控制试验。
1.2 试验设计
土壤铅污染处理设置6个浓度梯度,分别为0,250,500,1000,2000和4000mg/kg,每个处理水平重复3次。所用花盆直径为37.5cm,按每盆土壤15kg重(干重),计算各Pb2+浓度所需的Pb(NO3)2质量,配成Pb(NO3)2溶液一次性浇灌,同时采用NH4NO3溶液平衡对照与各处理的氮素营养。自处理后,根据每盆土壤水分状况,每隔3~5d等量浇入去离子水,底部渗出水分倒回盆内,以避免Pb2+的流失。除根系和地上部生物量外,其余各项生理指标分别于处理后0,5,10,15,20,25和30d测量。
1.3 测定项目与方法
1.3.1 草坪外观质量评定 目测法[21],参照美国 NTEP的标准(1~9),最好质量为9.0级,最差为1.0级,6.0级为最低可接受的草坪质量。以草坪的色泽、密度、质地、均一性进行综合评分。
1.3.2 草坪根系和地上部生物量测定 用于生物量测定的3种草坪草于2014年2月份进行了铅胁迫处理。将培养在以蛭石为基质,用Hoagland营养液浇灌的3种草坪草(生长期为1个月)为试验材料,按上述5个胁迫浓度加入营养液中,整个试验期间营养液每24h换1次,以免营养液浓度和处理的重金属离子浓度稀释淡化。铅胁迫15d后对整个花盆(花盆直径为37.5cm)中的草坪草进行地上部和根系的生物量测定。地上部采用刈割法[22]齐地面刈剪,取地上部材料,在65℃烘箱内烘干至恒重,并称量。根系生物量测定时将花盆中的蛭石洗掉,取出所有根系,在65℃烘箱内烘干至恒重,并称量。与地上部生物量测量同时进行。
1.3.3 测定的生理指标及其测定方法 叶片相对含水量(RWC):参照张志良[23]的方法并改进,随机剪取草坪叶片,吸干表面水分,称其鲜重(Wf);然后去离子水中浸泡5h,称其饱和重(Wt);最后在105℃的烘箱中杀青30 min,80℃烘干24h后称其干重(Wd)。计算公式:叶片相对含水量(%)=[(Wf-Wd)/(Wt-Wd)]×100。
叶片电导率:每个处理分别称取等量叶片0.2g,用去离子水冲洗干净,剪成1cm的小段置于试管中,用已测初电导率值(E0)的去离子水10mL在黑暗条件下浸泡24h后,测外渗液的电导率(El),之后封口沸水浴15min,冷却至室温测电导率(E2),计算公式:相对电导率(%)=100×(E1-E0)/(E2-E0)。
叶绿素含量:采用分光光度计法,用95%无水乙醇浸提[24],于波长663,646和470nm下测定吸光值。
过氧化物酶(peroxidase,POD)活性:采用愈创木酚法[25],将每分钟 OD(optical density,光密度)增加0.01定义为1个酶活力单位。
过氧化氢酶(catalase,CAT)活性:采用紫外分光光度法[26],将每分钟OD降低0.1为1个酶活力单位。
超氧化物歧化酶(superoxide dismutase,SOD)活性:采用氮蓝四唑法[25],以抑制氮蓝四唑光化还原50%的酶量为1个酶活单位。
1.4 数据分析
采用Excel 2010和SPSS(12.0版)进行One-way ANOVA方差分析和绘图。
2 结果与分析
2.1 铅胁迫对3种草坪草草坪目测质量的影响
草坪目测质量是衡量草坪植物生长状态最直观的指标,3种草坪草在铅胁迫下的目测质量变化如图1。随着铅胁迫浓度的升高,3种草坪草目测质量都逐步下降。在低浓度铅250mg/kg胁迫下,在整个实验阶段期间,3种草坪草的目测质量同对照相比轻微下降,在500mg/kg胁迫下,同对照相比,处理后第10天结缕草和假俭草的目测质量下降显著,而狗牙根在处理后第20天时才呈现下降(P<0.05)。在铅处理浓度1000,2000和4000 mg/kg下,同对照相比,在胁迫后整个实验期间,3种草的目测质量比对照显著下降(P<0.05)。在1000和2000 mg/kg下,3种草的目测质量下降趋势基本相同,在铅胁迫后第20天目测质量最差,随后目测质量有所回升。而在4000mg/kg的浓度处理下,3种草的目测质量都急剧下降,同对照相比差异显著(P<0.05),其中假俭草的下降幅度最大,其次是结缕草和狗牙根。假俭草目测质量在处理25d后目测质量下降到6级以下,而结缕草和狗牙根目测质量仍然都在6级以上。
2.2 铅胁迫对3种草坪草生物量的影响
不同浓度的铅胁迫对3种草中根系和地上部茎叶的影响如图2所示。随着胁迫浓度的增加,3种草中根系生物量都在逐步下降,下降幅度最大的为假俭草,其次为结缕草,狗牙根下降幅度最小(图2A)。在假俭草、结缕草和狗牙根中,在铅胁迫为250mg/kg下,根系生物量同对照相比骤然下降,但是随着胁迫浓度的增加,生物量下降缓慢,假俭草和结缕草在胁迫浓度为4000mg/kg时降到最低值,分别比对照下降了29.8%和24.2%,而狗牙根在浓度为2000mg/kg时降到最低值,比对照下降了17.2%,随着浓度的增加,略有回升,方差分析同对照差异显著(P<0.05)。同根系相比,随着浓度的增加,地上部生物量也逐步减少,但是下降幅度小于根系中的变化(图2B)。在最大胁迫浓度4000mg/kg时,结缕草、假俭草和狗牙根中地上部生物量分别比对照下降了16.4%,20.0%和9.0%,方差分析同对照差异显著(P<0.05)。这些结果表明铅胁迫对根系的影响程度高于对地上部。

图1 不同浓度铅胁迫对3种草坪草目测外观质量的影响Fig.1 Change of visual quality among three turfgrasses under the different lead concentrations
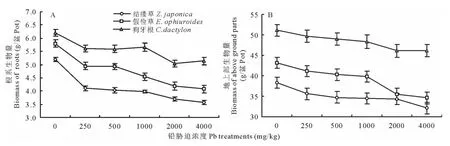
图2 不同浓度铅胁迫对3种草坪草根系(A)和地上部生物量(B)的影响Fig.2 Biomass of root(A)and parts above ground(B)changes among three turfgrasses under the different lead concentrations
2.3 铅胁迫对3种草坪草叶绿素含量的影响
在各个铅胁迫浓度下,3种草种叶片叶绿素a和b含量如图3所示。随着铅胁迫浓度的增加,3种草坪草的叶绿素a和b的含量均逐渐下降。假俭草在5个铅浓度胁迫下,在所有胁迫时间段内,同对照相比,叶绿素a和b均显著下降(P<0.05),其中在4000mg/kg浓度下处理30d后,叶绿素a和b降到最低值,分别比对照下降了69%和63%,方差分析显示同对照差异显著(P<0.05)(图3)。结缕草中叶绿素a和b的变化也同假俭草中的趋势相同,但是下降幅度要小一些,在各个胁迫浓度下,处理后第5天时同对照相比差异不显著,在4000mg/kg浓度下处理30d后,结缕草中叶绿素a和b也降到最低值,同对照相比分别下降了55%和60%(图3)。随着铅胁迫浓度的增加,狗牙根中叶绿素a和b含量逐渐下降,叶绿素a在铅浓度4000mg/kg处理后第30天时达到最低值,比对照下降了50%,而叶绿素b在处理后第25天降到最低值,比对照下降了51%,方差分析显示同对照差异显著(P<0.05)。

图3 不同浓度铅胁迫对3种草坪草叶绿素a(A)和叶绿素b(B)的影响Fig.3 Changes of Chl a(A)and Chl b(B)among three turfgrasses under the different lead concentrations
2.4 铅胁迫对3种草坪草叶片相对含水量的影响
从图4可以看出,随着铅浓度的增加,结缕草、假俭草和狗牙根的叶片相对含水量均呈现逐渐下降趋势。结缕草在铅浓度2000和4000mg/kg水平下,处理后第10,15,20,25,30天时叶片相对含水量同对照相比下降显著。随着时间的延长,相对含水量持续下降,在浓度为4000mg/kg处理25d时达到最低值,同对照相比,下降了33.2%,方差分析显示同对照差异显著(P<0.05)。同结缕草相比,同等铅浓度和时间处理下,假俭草的相对含水量的变化趋势同结缕草类似,但是下降的幅度比结缕草的要低一些。在4000mg/kg浓度下处理后第15天时达到最低值,同对照相比下降了25.8%(P<0.05),随后保持在这个水平。随着浓度的增加,狗牙根中叶片相对含水量也呈现逐渐下降趋势,在最高浓度4000mg/kg胁迫下,在处理后第25天时达到最低值,比对照下降了30.5%,随后有所回升。
2.5 铅胁迫对3种草坪草叶片电导率的影响
不同浓度和时间铅胁迫下结缕草、假俭草和狗牙根中叶片电导率如图5所示。假俭草中在短时间的5,10和15d胁迫内,随着胁迫浓度的增加,叶片中的相对电导率逐渐上升,在较长时间的20,25,30d的胁迫内,叶片中的相对电导率也呈现上升趋势,但是当胁迫浓度增加到4000mg/kg时,叶片电导率骤升,在胁迫30d后达到最大值,比对照增加了311%,方差分析极显著(P<0.01)。结缕草和狗牙根中铅胁迫下叶片电导率同假俭草中类似,在最高胁迫浓度下30d后分别比对照增加了303%和315%(P<0.01)。3种草中增幅最快的为狗牙根,其次为假俭草和结缕草。

图4 不同浓度铅胁迫对3种草坪草叶片中相对含水量的影响Fig.4 Changes of relative water content among three turfgrasses under the different lead concentrations
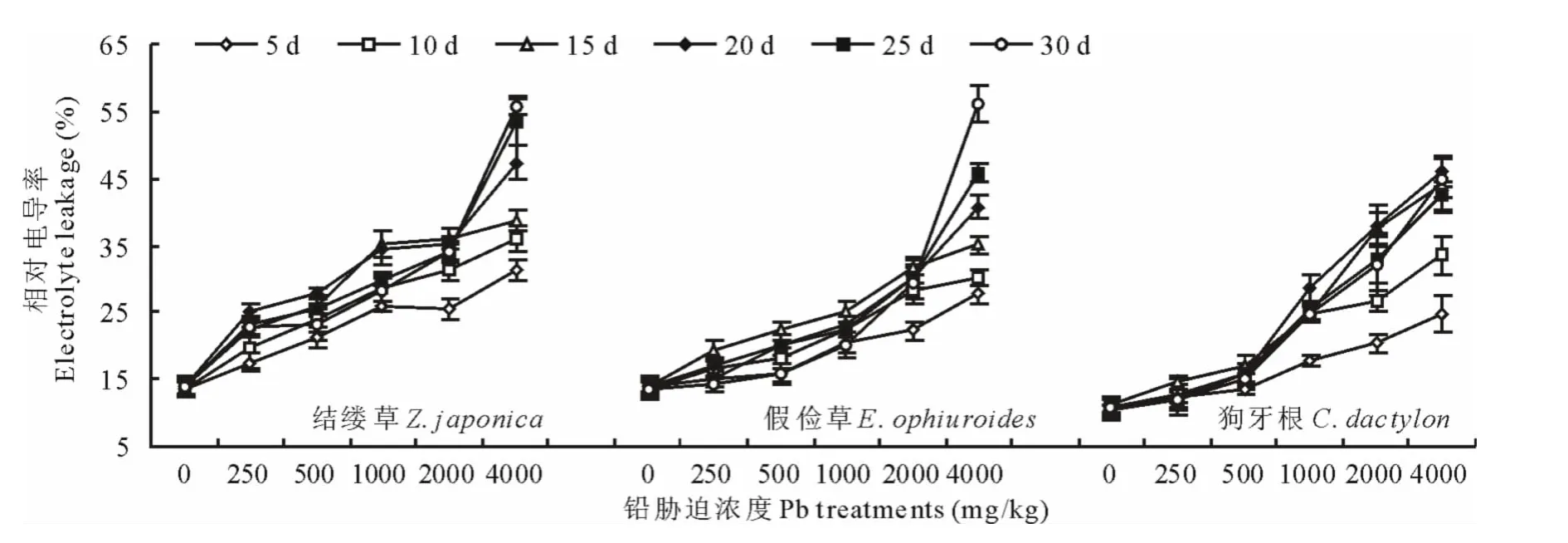
图5 不同浓度铅胁迫对3种草坪草叶片中相对电导率的影响Fig.5 Changes of relative electrolyte leakage among three turfgrasses under the different lead concentrations
2.6 铅胁迫对3种草坪草叶片酶活性的影响
2.6.1 铅胁迫对3种草坪草SOD活性的影响 不同浓度和时间铅处理下,3种草坪草SOD活性变化如图6所示(图6A)。结缕草中随着胁迫浓度的增加和处理时间的延长SOD活性持续上升。在处理后5,10,15d内,在低于2000mg/kg浓度下,随着胁迫浓度的增加,SOD活性缓慢上升,而当浓度上升到4000mg/kg时,SOD活性骤升,在处理后第15天时达到最大值,与对照活性水平比较,上升了192%。在处理后25d时,随着浓度的增加,SOD活性先上升后下降,在1000mg/kg胁迫浓度下,达到最高值,随后下降,但仍然明显高于对照。随着铅胁迫浓度的增加,假俭草中SOD活性持续上升,但是呈现快-慢-快的趋势。在各个处理时间段内,250mg/kg浓度下,假俭草中的SOD活性快速上升,随着处理浓度的增加,在500和1000mg/kg浓度处理下,增幅比较缓慢,在处理浓度高于2000mg/kg,SOD活性又急剧上升,在4000mg/kg处理后第20天时,达到最大值,比对照增加了125.6%,方差分析差异显著(P<0.05)。狗牙根中随着铅胁迫浓度的增加,SOD活性呈现先升高后下降的趋势。在处理后5,10,15和20d天内,SOD活性在2000mg/kg浓度下达到峰值,随后下降,但是仍旧明显高于对照,而在处理后25和30d内,SOD活性在1000mg/kg时达到最大值,随着浓度的增加,其活性略微下降。在处理后25d时比对照增加了221.2%。
2.6.2 铅胁迫对3种草坪草POD活性的影响 不同浓度和时间铅胁迫下,3种草坪草POD活性变化如图6所示(图6B)。3种草中POD活性都比对照显著增加,其中增幅最快的为结缕草,其次为狗牙根和假俭草。在假俭草中,随着胁迫浓度的增加,胁迫5d内,POD活性持续上升,4000mg/kg胁迫下达到峰值,而在胁迫后20,25,30d时间段内,POD活性持续上升,在2000mg/kg时达到最大值,分别比对照增加了156.2%,187.7%和139.2%,随后略微下降或保持不变。结缕草中在胁迫后5和10d时,随着胁迫浓度的增加,POD活性持续上升,但是增长幅度比较缓慢,在胁迫后15和20d时,250mg/kg低浓度诱导了POD的骤升,随着浓度的增加,增幅比较缓慢,而在胁迫后25d时,随着浓度的增加,POD活性持续大幅度上升,在4000mg/kg浓度下达到峰值,比对照增加了392%,方差分析差异显著(P<0.05),胁迫30d时,在250mg/kg低浓度时,POD活性也骤然升高,随着浓度的增加,在1000mg/kg达到峰值,然后下降,接近低浓度的水平。狗牙根在铅胁迫5和10d时,随着胁迫浓度的增加,POD活性呈现先升后降的趋势,在1000mg/kg胁迫浓度下,达到峰值,随后活性水平下降到接近500mg/kg下的活性。在铅胁迫15d后的几个时间段内,250mg/kg的低浓度诱导了POD活性的骤增,随着胁迫浓度的增加,POD活性持续增加,但增幅缓慢一些,在铅胁迫4000mg/kg处理后30d时达到最大值,同对照相比增加了188.8%。

图6 不同浓度铅胁迫对3种草坪草叶片中SOD(A)、POD(B)、CAT(C)活性变化的影响Fig.6 Changes of activities of protective enzymes SOD(A),POD(B)and CAT(C)among three turfgrasses under the different lead concentrations
2.6.3 铅胁迫对3种草坪草CAT活性的影响 不同浓度和时间铅胁迫下,3种草坪草CAT活性变化如图6所示(图6C)。假俭草在铅胁迫后各时间段内,随着浓度的升高,CAT活性缓慢上升,在胁迫浓度4000mg/kg下处理20d后CAT活性达到最大值,同对照相比增加了49.2%。结缕草在胁迫后10,15,20,25,30d内,随着胁迫浓度的增加,CAT活性先升高后降低,在浓度4000mg/kg下达到最大值,随后下降,接近250mg/kg低浓度下的水平。在最高胁迫浓度下胁迫后20d时比对照增加了84%(P<0.05)。狗牙根中随着铅胁迫浓度的增加,CAT活性先上升后下降。在胁迫浓度2000mg/kg下处理20d后达到峰值,比对照增加了57.7%(P<0.05)。
3 讨论与结论
前人的研究表明一定浓度的铅胁迫导致草坪草失绿和分蘖减少[10]。我们的研究表明高浓度的铅胁迫导致3种草坪草的目测质量下降,目测质量评价中主要用到的指标是草坪的色泽、密度、质地及均一性,这些结果说明在高浓度的铅胁迫下,3种草坪草的生长及形态组织受到伤害。这一结果同前人研究草坪草在铅胁迫下的伤害相一致[27]。在最高铅浓度胁迫下处理30d后假俭草目测质量下降到6级以下,结缕草介于6和7级之间。而狗牙根在此浓度胁迫下处理20d后目测质量为最低,但仍然高于7级。从这些结果我们可以推断狗牙根具有较其他草种更强的铅适应能力。
铅胁迫对植物的另一种形态伤害表现为根系受损伤及地上部生长减缓[28]。我们的研究结果表明随着铅胁迫浓度的增加,根系和地上部的生物量都逐步减少,只是根系生物量的下降幅度比地上部更大一些,这可能是由于根系作为植物和土壤的重要界面,是重金属与植物直接接触的首要部位,其受到的伤害症状比地上部更明显一些,这也与前人在铅胁迫对地上部和根系生物量的变化结果相一致[29]。3种草中根系生物量同对照相比下降最快的为假俭草,其次为结缕草,狗牙根下降幅度最小,这一结果可以推断出在铅胁迫下狗牙根根系的适应能力强于前面两者。
光合生理的变化可以衡量植物对重金属的耐受性[30]。叶绿素作为植物进行光合作用的主要色素,其含量高低可直接反映光合作用能力的强弱。本研究表明,随着铅胁迫浓度的升高,同对照相比,3种草坪草的叶绿素a、b含量均显著下降。这也和前人对铅胁迫可显著降低叶片叶绿素含量的研究相一致[31-32]。3种草中叶绿素降低幅度最大的为假俭草,其次为结缕草,狗牙根中叶绿素降低的幅度最小,这一结果同铅胁迫下目测质量的结果相一致,可以推断假俭草对铅胁迫的适应能力较其他两种草弱一些。
铅胁迫对植物的伤害机理之一是通过破坏植物细胞膜,使膜透性增加,细胞内含物大量外渗,同时外界物质进入细胞,导致植物体内生理生化反应发生紊乱,破坏正常的新陈代谢,从而使生长活动受抑制[15]。本研究中3种草坪草在铅胁迫下叶片电导率上升,且上升幅度随处理浓度的增大而增大,这与铅破坏植物细胞膜,使膜透性增加的结论相一致[33]。与假俭草、结缕草细胞膜被破坏后保持高膜透性不同,狗牙根的叶片电导率在后期有所回落,这很可能是狗牙根对铅胁迫导致的细胞膜伤害进行了修复,或者通过其他适应性的调节来缓解细胞膜伤害。
前人研究表明,高浓度的铅可引起植物严重的水分亏缺,木质部水位以及相对含水量减少[34]。本研究中随着铅胁迫处理浓度的增加和处理时间的延长,3种草坪草中叶片相对含水量都逐步下降。不同的是,狗牙根与结缕草的叶片相对含水量相对于假俭草,在下降后出现回升过程,狗牙根在低浓度处理下叶片相对含水量能回升至对照水平。推测狗牙根在铅胁迫后可能生成了渗透调节物质,以缓解铅污染引起的水分胁迫。
前人研究表明,重金属胁迫会导致植物大量的活性氧类物质(ROS)产生,而其能损伤生物大分子,引起膜脂过氧化[27]。在正常情况下,植物细胞内自由基的产生与清除处于动态平衡,而当植物长期处于胁迫下,植物产生的ROS含量超出活性氧解毒系统的能力时,动态平衡就会被打破,造成细胞的破坏、氧化损伤甚至死亡[34-35]。POD、CAT和SOD是植物体内参与淬灭活性氧过程的3种重要活性酶。POD能有效清除氧代谢中产生的H2O2以及由此产生的有机过氧化物,在生物体内的抗氧化代谢中有重要的作用[17-18],CAT主要清除植物光呼吸中产生的H2O2,催化细胞内过氧化氢发生歧化反应,使之转化为对植物无毒的O2和H2O,防止细胞的过氧化[36],SOD作为膜保护的第一道防线,能以O2-为基质进行歧化反应,将毒性较强的O2-转化为毒性较轻的H2O2[37]。
本研究中,3种草坪草SOD活性均随胁迫时间的延长先升高后降低。其原因可能是Pb2+进入植物体内后绝大部分积累在根部[15],而硝酸根离子的加入却提高了草坪草的肥力,因此导致了适应性的增加,但随着胁迫时间的延长,草坪草体内累积过多Pb2+,高浓度铅使得H2O2后续分解无法继续,导致H2O2积累抑制O2-的转化,进而SOD活性降低。3种草坪草在铅污染下POD活性均显著增加,其中狗牙根POD活性随胁迫时间的延长而增大,可见狗牙根对铅胁迫的耐性较高;假俭草与结缕草在高浓度铅处理下,POD活性先增大后降低,可能是因为活性氧浓度达到一定临界值导致酶活性相应减弱。3种草坪草CAT活性均有所增加,其中假俭草CAT活性随铅浓度的增加而增加,随胁迫时间的延长先升高后缓慢降低,结缕草CAT活性则呈现先升高后降低的趋势,其原因可能是草坪草对铅胁迫产生应激反应,但随着铅浓度的增加和胁迫时间的延长,超过植物所能忍受的极限时,作为防御体系的酶活性也相应减弱,符合植物对胁迫的典型特征[9]。而狗牙根CAT活性变化较为平缓,处理后5d时被诱导升高,此后基本维持在同一水平,表明不同草坪草的自身保护酶体系不同,其CAT活性对铅胁迫反应也是完全不同的。这些结果同前人在其他植物中铅胁迫下保护酶的变化相一致。
通过上述分析和讨论,我们可以看出3种草坪草对铅胁迫的响应具有差异,假俭草与结缕草对铅的敏感程度明显大于狗牙根。可能的原因是狗牙根进行了缓冲、修复铅胁迫伤害等适应性调节,从而提高了对铅的耐性,而假俭草的适应性调节能力较弱,从目测质量上即可观察到明显伤害。综合分析各项指标可以得出3种草坪草对铅抗性能力依次排序为:狗牙根>结缕草>假俭草。狗牙根在铅胁迫下与其他两种草坪草相比,表现出了更好的抗性能力,因此更适合用于受铅污染地区的绿化和生态修复。
[1] Ameh E G,Akpah F A.Heavy metal pollution indexing and multivariate statistical evaluation of hydrogeo chemistry of River Pov in Itakpe Iron-Ore mining area,Kogi State,Nigeria[J].Advances in Applied Science Research,2011,2(1):33-46.
[2] 李瑞琴,于安芬,白滨.甘肃中部高原露地菜田土壤重金属污染及潜在生态风险分析[J].农业环境科学学报,2013,32(1):103-110.
[3] Bissenbaev A K,Ishchenko A A,Taipakova S M,etal.Presence of base excision repair enzymes in the wheat aleurone and their activation in cells undergoing programmed cell death[J].Plant Physiology and Biochemistry,2011,49(10):1155-1164.
[4] Tanhan P,Kruatrachue M,Pokethitiyook P.Uptake and accumulation of cadmium,lead and zinc by Siam weed(Chromolaena odorataL.King & Robinson)[J].Chemosphere,2007,68(2):323-329.
[5] 丁继军,潘远智,刘柿良,等.土壤重金属镉胁迫对石竹幼苗生长的影响及其机理[J].草业学报,2013,22(6):77-85.
[6] 闵焕,祖艳群,李元.Pb胁迫对圆叶无心菜(ArenariarotumdifoliaBieberstein)生长和生理特征的影响[J].农业环境科学学报,2010,29(B03):15-19.
[7] 张小艾,李名扬,汪志辉,等.重金属及盐碱对二月兰幼苗生长和生理生化的影响[J].草业学报,2013,22(2):187-194.
[8] 侯晓龙,陈加松,刘爱琴,等.Pb胁迫对金丝草和柳叶箬生长及富Pb特征的影响[J].福建农林大学学报(自然科学版),2012,41(3):286-290.
[9] Estrella G N,Mendoza C D,Moreno S R,etal.The Pb-hyperaccumulator aquatic fernSalviniaminimaBaker,responds to Pb(2+)by increasing phytochelatins via changes in SmPCS expression and in phytochelatin synthase activity[J].Aquatic Toxicololy,2009,91(4):320-328.
[10] 王慧忠,何翠屏.重金属离子胁迫对草坪草根系生长及其活力的影响[J].中国草地,2002,24(3):55-63.
[11] 朱启红,夏红霞.铅胁迫对蜈蚣草抗氧化酶系统和叶绿素含量的影响[J].贵州农业科学,2012,40(4):56-58.
[12] 赵钢,邹亮,彭镰心,等.铅胁迫对苦荞生理特性的影响[J].江苏农业科学,2012,40(7):98-100.
[13] 王慧忠,张新全,何翠屏.Pb对匍匐翦股颖根系超氧化物歧化酶活性的影响[J].农业环境科学学报,2006,25(3):644-647.
[14] 王志勇,廖丽,袁学军.重金属铅对草坪植物的毒害研究进展[J].草原与草坪,2010,(2):8-15.
[15] 黄化刚,李廷轩,杨肖娥,等.植物对铅胁迫的耐性及其解毒机制研究进展[J].应用生态学报,2009,(3):696-704.
[16] 薛亮,刘建锋,史胜青,等.植物响应重金属胁迫的蛋白质组学研究进展[J].草业学报,2013,22(4):300-311.
[17] Nehnevajova E,Lyubenova L,Herzig R,etal.Metal accumulation and response of antioxidant enzymes in seedlings and adult sunflower mutants with improved metal removal traits on a metal-contaminated soil[J].Environmental and Experimental Botany,2012,76(2):39-48.
[18] Anjum N A,Ahmad I,Mohmood I,etal.Modulation of glutathione and its related enzymes in plants’responses to toxic metals and metalloids[J].Environmental and Experimental Botany,2012,75(1):307-324.
[19] 杨刚,伍钧,唐亚.铅胁迫下植物抗性机制的研究进展[J].生态学杂志,2005,24(12):1507-1512.
[20] Hernández-Allica J,Garbisu C,Barrutia O,etal.EDTA-induced heavy metal accumulation and phytotoxicity in cardoon plants[J].Environmental and Experimental Botany,2007,60(1):26-32.
[21] 王恺.假俭草和海滨雀稗对土壤Pb、Cd、Zn污染胁迫的响应及耐受阈值研究[D].上海:上海交通大学,2010.
[22] 孙吉雄,张志豪.几种草坪草地上和地下植物量的比较研究[J].草业科学,1996,13(2):57-60.
[23] 张志良.植物生理学实验指导[M].北京:高等教育出版社,2001.
[24] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:134-261.
[25] 熊庆娥.植物生理学实验教程[M].成都:四川科学技术出版社,2003:72.
[26] 郝再彬,苍晶,徐仲.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2004:111-114.
[27] 朱燕华.草坪植物对铅的耐性及富集特性研究[D].扬州:扬州大学,2007.
[28] 侯晓龙.铅超富集植物金丝草对Pb胁迫的响应机制研究[D].福州:福建农林大学,2013.
[29] 王慧忠.匍匐翦股颖和多年生黑麦草对镉、铅胁迫的响应及部分基因表达调控机理研究[D].雅安:四川农业大学,2006.
[30] 刘俊祥,孙振元,勾萍,等.镉胁迫下多年生黑麦草的光合生理响应[J].草业学报,2012,21(3):191-197.
[31] 何冰,叶海波,杨肖娥.铅胁迫下不同生态型东南景天叶片抗氧化酶活性及叶绿素含量比较[J].农业环境科学学报,2003,22(3):274-278.
[32] 陶玲,郭永春,李萍,等.铅胁迫对3种豆类作物生理特性的影响[J].中国农学通报,2012,33:78-83.
[33] Parys E,Romanowska E,Siedlecka,etal.The effect of lead on photosynthesis and respiration in detached leaves and in mesophyll protoplasts ofPisumsativum[J].Acta Physiologiae Plantarum,1998,20(3):313-322.
[34] Verma S,Dubey R S.Lead toxicity induces lipid peroxidation and alters the activities of antioxidant enzymes in growing rice plants[J].Plant Science,2003,164(4):645-655.
[35] Schützendübel A,Polle A.Plant responses to abiotic stresses:heavy metal-induced oxidative stress and protection by mycorrhization[J].Journal of Experimental Botany,2002,53:1351-1365.
[36] Hodge M,Rew C J,Johnson D A,etal.Antioxidant compound responses to chilling stress in differentially sensitive inbred maize lines[J].Physiology Plant,1996,98(4):685-692.
[37] 孟晓霞,龙巍,郑超,等.铅胁迫对西南山梗菜生长及逆境生理指标的影响[J].四川农业大学学报,2012,(3):336-341.
