早期肠内营养对胃癌根治术后患者机体恢复及免疫功能的影响
2014-03-26史和平
史和平,刘 韬
(渭南市中心医院普外科,陕西 渭南 714000)
胃癌患者因肿瘤影响常无法维持足够的营养摄入而多伴有不同程度的营养不良和免疫防御能力下降,加上手术刺激,术后禁食较长,也会使营养状况及免疫功能进一步降低。临床和试验表明,恶性肿瘤患者术后进行早期营养支持对于降低感染发生率、维持机体免疫功能、加速伤口愈合和缩短住院时间具有重要意义[1-3]。本研究主要分析早期肠内营养对胃癌根治术后患者机体恢复及免疫功能的影响,现报道如下。
1 资料与方法
1.1一般资料 选择2012年3月至2013年3月陕西省渭南市中心医院行胃癌根治术(D2)的胃癌患者41例。所有患者术前无明显营养不良,可正常进食,无代谢性疾病。排除标准:①术前接受过肠内或肠外营养支持者;②术前未接受放、化疗者;③未能控制的糖尿病和失代偿性甲状腺功能亢进者。采用随机数字表法将患者分为两组:观察组21例,男15例、女6例,年龄31~73(54.3±3.1)岁;对照组20例,男15例、女5例,年龄32~73(55.1±2.8)岁。两组患者的性别、年龄等一般资料比较差异无统计学意义(P>0.05),具有均衡性。
1.2方法 对照组术后给予静脉滴注葡萄糖、氨基酸等,补充每日必需能量、矿物质及维生素。观察组术后行早期肠内营养支持治疗,术中置鼻肠管至空肠上段;术后 24 h内给予早期的肠内营养支持。术后12 h经鼻肠管缓慢输入等渗盐水500 mL,24 h起选用肠内营养乳剂和等渗盐水按1∶1 比例混合,由喂养泵24 h均匀输入,辅以加热器控制温度38~41 ℃。第1日的速度为30 mL/h,以后逐日增加20 mL/h,最快调速至120 mL/h,同时能量不足部分辅以肠外营养。
1.3观察指标 观察记录两组患者干预前后的营养状态指标,包括血清白蛋白、前白蛋白、转铁蛋白,手术前后免疫学指标,包括CD3+、CD4+、CD8+,CD4+/CD8+。

2 结 果
2.1两组患者肛门排气率和并发症发生情况的比较 观察组术后<24 h 及 24~36 h 的肛门排气率均高于对照组,并发症发生率低于对照组(23.81比50.00%) ,差异均有统计学意义(P<0.05)(表1)。

表1 两组胃癌患者肛门排气率和并发症 发生情况的比较 [例(%)]
观察组:行早期肠内营养支持治疗;对照组:行静脉营养支持治疗
2.2两组患者手术前后营养状态指标的比较 两组患者经营养治疗后血清白蛋白、前白蛋白及转铁蛋白均较术前显著提高(P<0.05) ,但组间比较差异无统计学意义(P>0.05) (表2)。
2.3两组患者手术前后免疫学指标比较 观察组患者术后CD3+、CD4+、CD8+和CD4+/CD8+均较术前显著增高(P<0.05),且与对照组比较,差异有统计学意义(P<0.05)(表3)。

表2 两组胃癌患者手术前后营养状态指标的比较

组别例数血清白蛋白(g/L)术前术后tP前白蛋白(mg/L)术前术后tP转铁蛋白(mg/L)术前术后tP观察组2134.1±1.439.0±2.17.7410.038214±22298±2810.7700.011137.2±30.5167.3±30.83.1820.033对照组2034.2±1.539.2±2.08.9450.035212±23296±2710.7940.027135.7±34.1160.8±33.42.3520.029t0.2210.3120.1820.2430.1480.648P0.8311.0400.7220.7010.6220.572
观察组:行早期肠内营养支持治疗;对照组:行静脉营养支持治疗
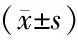
表3 两组胃癌患者手术前后免疫学指标比较

组别例数CD3+(%)术前术后tPCD4+(%)术前术后tP观察组2159.7±5.364.1±5.42.6650.03037.5±4.942.1±4.83.0730.048对照组2059.6±5.460.2±5.20.3580.05138.0±4.738.9±5.30.5680.562t0.0602.3550.3332.477P0.5130.0370.6290.011组别CD8+(%)术前术后tPCD4+/CD8+(%)术前术后tP观察组28.6±4.223.9±4.73.4180.0281.39±0.271.61±0.342.3160.014对照组28.5±4.527.8±4.20.5090.8131.38±0.381.41±0.420.2360.553t0.0742.8000.0971.993P0.6250.0040.6220.026
观察组:行早期肠内营养支持治疗;对照组:行静脉营养支持治疗
3 讨 论
治疗早期和中期胃癌行胃全切除术是一种有效的根治性的方法,但行胃全切除术必然会对消化系统产生很大的不良影响,会严重损害患者正常的胃肠功能[4],所以探讨胃癌根治术对患者免疫功能的影响是很有意义的。本研究结果显示,两组患者经营养治疗后血清白蛋白、前白蛋白及转铁蛋白营养指标均较术前有显著改善(P<0.05) ,说明两组方式都有利于促进内脏蛋白的合成,促进患者营养状况的恢复。
自然杀伤细胞是一类不需要特异性抗体参与即可杀伤肿瘤细胞的淋巴细胞,发挥免疫监视的作用,是机体防御肿瘤的天然屏障。而根据T细胞表面分化抗原将成熟的T细胞分为CD4+和CD8+两大亚群,CD4+为辅助/诱导T细胞,具有协助体液免疫及细胞免疫的功能,CD8+为抑制性杀伤T细胞。CD4+协调B细胞分化产生抗体,CD8+则抑制抗体的合成、分泌及T细胞的增殖,两者的稳态维持着机体正常的免疫应答,比值降低说明机体免疫功能低下[5-6]。本研究结果显示,观察组患者各项指标均不同程度恢复,CD3+、CD4+、CD8+和CD4+/CD8+比值均较术前显著改善(P<0.05),且优于对照组,说明强化的免疫成分对细胞免疫功能的改善具有积极意义。总之,早期肠内营养较全肠外营养支持的患者不仅肛门排气时间方面更具优势,且并发症控制也较佳,另外,患者的营养与免疫指标也更快恢复,这些均与早期肠内营养较早地对胃肠道功能进行了有效促进有关[7-8],说明早期肠内营养具有促进机体胃肠道适应的效果,机体更易于吸收,效果也更好。
[1] 王琦三,鲁英,尹东,等.不同营养方式对老年胃癌患者术后细胞免疫和肝肾功能的影响[J].新疆医科大学学报,2010,33(1):56-59.
[2] 龙训辉,王齐国.老年胃癌全切术后肠内营养与肠外营养的对比研究[J].现代预防医学,2012,39(23):6331-6332,6335.
[3] 刘骅,凌伟,曹晖.免疫强化肠内与肠外营养对老年胃癌患者全胃切除术后营养和免疫功能的影响[J].上海交通大学学报:医学版,2011,31(7):1000-1004.
[4] 黄国强,于吉人,冯永生,等.老年胃癌患者术后早期肠内与肠外营养的比较[J].中国老年学杂志,2012,32(9):1839-1840.
[5] 周东,刘胜,应敏刚,等.肝癌病人术后早期肠内与肠外营养支持治疗的比较[J].肠外与肠内营养,2012,19(1):50-51.
[6] Yachida S,Sasako M,Tobinai K,etal.Successful treatment of a primarygastricT-cell lymphoma lacking the human T-cell leukemia virus type 1[J]. Hepatogastroenterology,2010,57(98):383-387.
[7] 孙金利,祝国莲.早期肠内营养支持对胃癌术后患者营养状况和临床结局的影响[J].中国实用医刊,2013,40(4):55-56.
[8] 黄邵洪,林继宗,严淑红,等.早期肠内营养联合免疫微生态支持对肝癌肝切除患者的影响[J/CD].中华普通外科学文献:电子版,2013,7(5):25-28.
