FAK在COPD呼吸道平滑肌细胞增殖中作用机制的研究进展
2014-03-26综述林春龙审校
杨 慧(综述),林春龙(审校)
(南华大学岳阳市二人民医院呼吸内科,湖南 岳阳 414000)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种常见的慢性呼吸系统疾病,也是导致患者死亡的主要原因之一。世界卫生组织预计到2020年,COPD将由第12位常见病上升为第5位,由第6位死亡原因上升为第3位死亡原因,它将带来极大的疾病负担[1]。COPD患者存在不同程度的呼吸道重构。而慢性呼吸道炎症性疾病呼吸道重构的显著特征是呼吸道平滑肌细胞增生和肥大,其直接后果是造成呼吸道壁的增厚,进行性加重的不可逆气流阻塞以及呼吸道高反应性,从而加重呼吸道的狭窄[2]。有研究表明,黏着斑激酶(focal adhesion kinase,FAK)对细胞的黏附、伸展、迁移、增殖和凋亡具有调节作用[3]。因此,FAK对于阻止COPD呼吸道平滑肌细胞增殖也可能发挥重要作用。
1 呼吸道平滑肌细胞在COPD呼吸道重构、呼吸道高反应中的作用过程
1.1呼吸道平滑肌细胞与呼吸道重构 呼吸道平滑肌细胞有收缩功能,当呼吸道平滑肌收缩35%时阻塞性呼吸道腔内将比正常呼吸道面积减少36%,呼吸道阻力增加1.87倍[4]。此外,它还能产生炎性细胞因子、蛋白酶和生长因子,从而导致重构过程[5]。近年来研究表明,呼吸道平滑肌细胞不仅是神经递质和炎性因子的靶组织,而且也能分泌细胞因子及表达黏附分子,在呼吸道黏膜下层炎症的调节中起重要作用[6]。各种细胞因子及环境刺激因素可作用于呼吸道上皮细胞,后者分泌内皮素1及基质金属蛋白酶,并活化各种生因子,特别是转化生长因子β,以上因子共同作用于上皮下成纤维细胞和平滑肌细胞,使之增殖而引起呼吸道重构[7]。
1.2COPD呼吸道重构的特点 呼吸道重构不仅与哮喘患者相关,也可以影响COPD患者[8]。COPD中呼吸道重构包括以下几个方面的变化:支气管上皮改变、支气管腺体增生以及平滑肌增生和肥大[9]。其中支气管平滑肌增生和肥大起着重要作用,这些改变均与慢性呼吸道炎症和吸烟所致的炎症刺激有关[10-11]。有学者通过反转录聚合酶链反应及免疫组织化学技术对吸烟者肺组织进行研究,证实了小气道中存在炎症因子转化生长因子β1(transforming growth factor β1,TGF-β1)的表达,且TGF-β1水平与一秒用力呼气容积呈负相关[12],而之前研究所知TGF-β1可促进呼吸道平滑肌增殖,进而加重COPD气流受限[7]。另有研究显示,肿瘤坏死因子α对烟雾引起的炎性反应和结缔组织的破坏发挥着关键的作用,除了致炎症外,肿瘤坏死因子α还可促进支气管平滑肌的再生,并改变平滑肌的功能[13]。
1.3COPD中呼吸道平滑肌与呼吸道高反应的关系 呼吸道高反应性是指在吸入少量刺激物或变应原后,正常人的呼吸道并不发生收缩反应或仅发生微弱的反应,而某些患者的呼吸道则可发生异常的过度收缩反应,引起呼吸道的管腔狭窄和呼吸道阻力的明显增加。越来越多的呼吸流行病学证据表明,呼吸道高反应是COPD的一个风险因子,且它可以作为COPD病死率的一个预测因素[14]。20%~60%的COPD患者存在呼吸道高反应,其原因主要由于管腔狭窄及呼吸道平滑肌增生、肥厚且常合并感染引起呼吸道黏膜上皮破坏,对非特异性刺激反应增强[14]。
综上可见,呼吸道重构、呼吸道高反应是COPD发病及病情严重程度的重要因素,而呼吸道平滑肌在呼吸道重构和呼吸道高反应中起到了重要作用。FAK及其相关信号通路参与了细胞发育、生长、存活、凋亡、黏附、骨架重组、转化、扩散和迁延等多种过程,研究FAK及其相关通路对呼吸道平滑肌的增殖作用,可对COPD的治疗和防治提供新方向。
2 FAK及其相关信号通路概述
FAK由Schaller等[15]在转染的V-Src鸡胚成纤维细胞中首次发现,它是一种进化上高度保守的蛋白质,在体内分布广泛。FAK是细胞内多条信号通路的交汇点,与细胞内其他信号转导通路存在crosstalk(细胞串话)。整合素或生长因子受体接受细胞外配体发出的信号后,激活FAK,引发其他细胞骨架蛋白的信号蛋白的酪氨酸磷酸化[16]。了解人FAK结构图及其相关信号通路图将对防治COPD呼吸道平滑肌细胞增殖带来新途径(图1、图2)[17]。
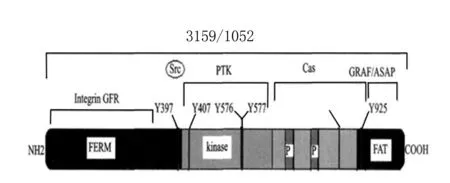
Integin:整合素;GFR:生长因子受体;FAT:黏着斑定位区;PTK:激酶结构域;kinase:激酶;NH2:氨基端;COOH:羧基端;src:Src基因鸡肉瘤病毒;SRV:基因组中的基因N-末端的FREM结构域是与整合素、生长因子受体等相互作用的位点;中段为PTK结构域,是具有催化活性的激酶结构域;其FERM可以与激酶结构域环化结合,使FAK发生自抑制而失活;C-末端是蛋白相互作用段,包括与Cas、GRAF和ASAP相互作用的位点等;Y397是主要的自磷酸化氨基酸及与Src相互作用的位点,其他5个酪氨酸位置也已示出;FAT是黏着斑靶向结构域,它与桩蛋白相互作用
图1人FAK结构域示意图
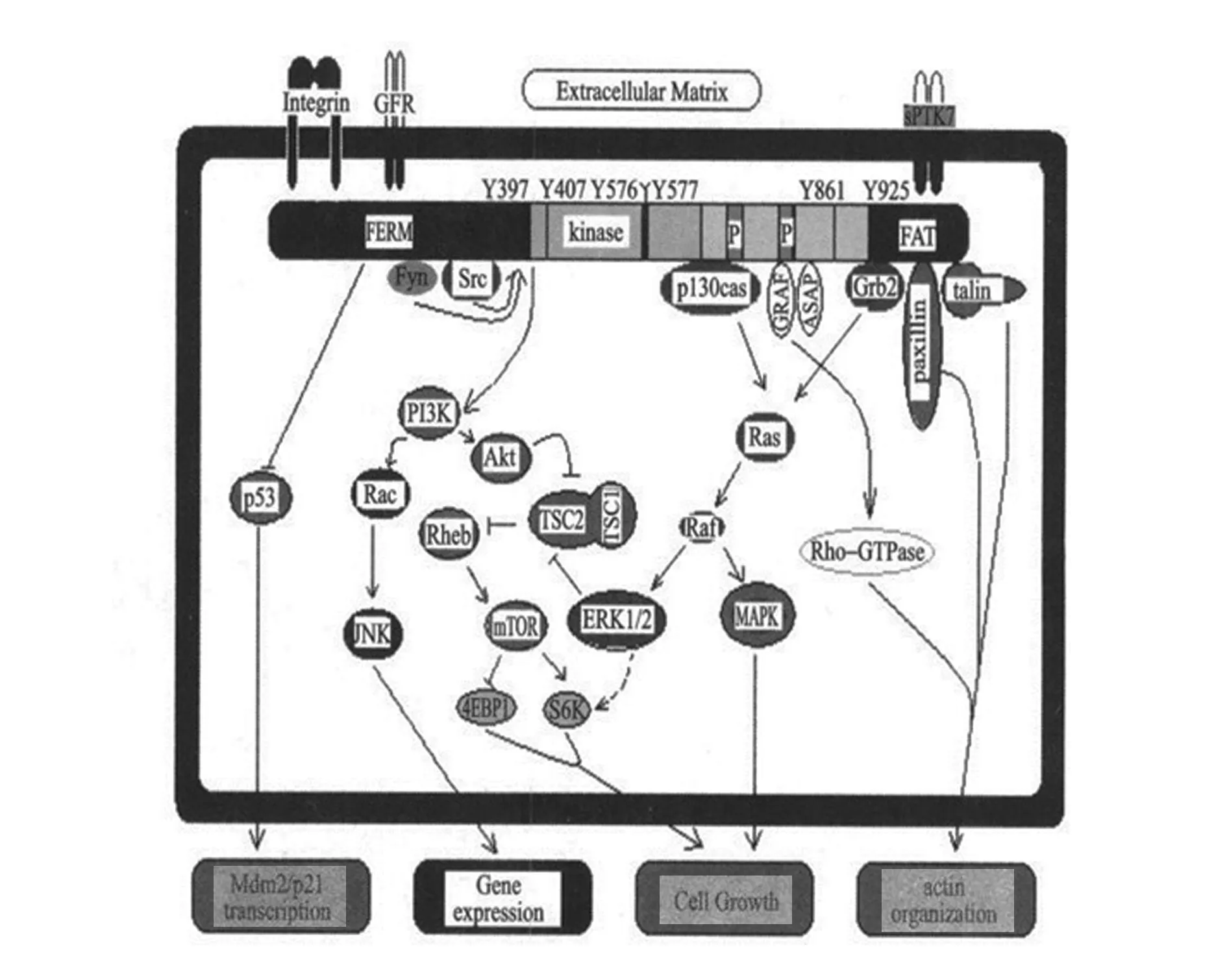
Paxillin:桩蛋白;talin:裸蛋白;cell growth:细胞生长;gene expression:基因表达;actin organization:肌动蛋白组织下图从左至右侧分别代表FAK与p53、RIP等的相互作用通道,它能促进细胞内Mdm2/p21的转录; FAK-Rac-JNK通路,它能促进细胞内各基因的表达;中间为FAK-Src-PI3K/Akt通路和 FAK-MAPK通路,它们两者可以促进细胞的生长;FAK-GTPase通路及最右侧为FAK-actin通路。图中标出的各种细胞活动并不是孤立的。当信号传递到细胞核并引起基因表达时,某些基因的产物的作用是负反馈抑制,具体作用机制还需今后在实验过程中进一步验证
图2FAK相关信号通路示意图
3 FAK及其相关通路诱导COPD呼吸道平滑肌增殖的相关机制
3.1整合素和细胞外基质对FAK在呼吸道平滑肌细胞增殖中的作用机制 整合素是一类重要的细胞表面受体家族,主要介导细胞与细胞外基质(extracellular matrix,ECM)的黏附,使细胞得以附着而形成整体,故称整合素。整合素介导的黏附作用调节着多种细胞功能,包括细胞凋亡、细胞增殖、细胞黏附与迁移、淋巴细胞归巢等。整合素可将胞外的ECM分子与细胞内的骨架蛋白连接起来形成焦点黏附物。在COPD和哮喘中,ECM和呼吸道平滑肌的改变对呼吸道重构起着重要的作用,而ECM在一定程度上能影响呼吸道平滑肌的增殖及其功能的表达[18],细胞需要黏附于ECM才能存活,一旦与ECM脱离将发生凋亡,细胞黏附于ECM时伴有FAK磷酸化的增加,是抑制细胞凋亡的关键因素[19]。整合素与ECM 结合后在生长因子的共同作用下激活FAK,通过Ras-有丝分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)或磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)促进细胞增殖[20]。
3.2FAK-MAKP、FAK-PI3K-Akt与TGF-β1信号通路在呼吸道平滑肌中的作用机制 FAK-MAPK、PI3K是细胞增殖过程中重要的信号转导调控分子。COPD中被激活的巨噬细胞释放TGF-β1可促使小气道平滑肌的增殖以及细胞外基质合成,导致呼吸道重构[21]。TGF-β1主要通过MAPK途径促进平滑肌细胞的增生[22]。Horowitz等[23]发现由TGF-β1介导的PI3K-Akt途径依赖于p38 MAPK的早期快速激活,尤其是PI3K使Bad(Bcl-2家族成员,是Akt作用的直接底物)磷酸化,阻止了Bad的促凋亡作用,同时抑制了细胞周期依赖性蛋白激酶抑制剂p27KIP1的转录。因此,PI3K的激活对于平滑肌细胞周期进展也极其重要。
3.3FAK-Ras-MEK-ERK信号通路在呼吸道平滑肌细胞增殖中的作用机制 细胞外信号调节激酶(excellar signal-regulated protein kinase,ERK)是传递丝裂原信号的信号转导蛋白。Ras-Raf-MEK-ERK信号通路的传递途径中Ras作为上游激活蛋白,Raf作为MAPK激酶的激酶(MAPKKK),MAPK/ERK激酶(MEK)作为MAPK激酶(MAPKK),ERK即MAPK(ERK1/ERK2,也称为p44/42 MAPK)。该途径参与多种细胞增殖、细胞周期的调节,其也可能参与了呼吸道平滑肌增殖的信号转导。有研究表明,烟熏可以刺激大鼠呼吸道平滑肌慢性炎症和平滑肌增殖,ERK1/2是COPD呼吸道平滑肌增殖信号转导的主要途径[24]。TGF-β1参与了ERK1/2信号系统对呼吸道重构平滑肌增殖的调控,TGF-β1、内皮素1蛋白表达增高和ERK1/2蛋白磷酸化可能是大鼠呼吸道平滑肌增殖的上游机制[25]。阻止FAK的活化,能够降低ERK1/2的表达,表明FAK是ERK1/2信号分子的上游途径,因此通过抑制FAK间接减少ERK1/2相关通路活化可以减少呼吸道平滑肌细胞的迁移与增殖[26]。由上述研究可以看出,FAK作用于呼吸道平滑肌细胞增殖方式是通过多条信号通路介导的,各信号通路之间串话的作用机制还有待进一步研究。
4 小结与展望
目前FAK与呼吸道平滑肌细胞增殖作用机制的研究大部分集中在动物水平,且目前暂未见直接研究FAK与人呼吸道平滑肌相关性的报道。当前研究较成熟的是在人血管平滑肌上,有研究证明FAK是Rac基因和血管内皮细胞增殖磷酸化调控的抑制剂[27],血管内皮细胞能促进血管平滑肌的增殖和活化。也有研究显示,FAK可以促进人肺动脉平滑肌细胞增殖,反义寡核苷酸促进其凋亡,两者在肺动脉高压形成中具有重要的病理生理学意义[28-29],有助于研究者了解肺动脉高压的机制,为肺心病的治疗提供新方向。研究FAK在COPD呼吸道平滑肌细胞的作用,开发新的FAK及其抑制人呼吸道平滑肌细胞增殖的拮抗剂,将为防治和治疗COPD提供一个新途径。
[1] Yao H,de Boer WI,Rahman I.Targeting lung inflammation:novel therapies for the treatment of COPD[J].Curr Respir Med Rev,2008,4(1):57-68.
[2] Bergeron C,Boulet LP.Structural changes in airway diseases:characteristics,mechanisms,consequences,and pharmacologic modulation[J].Chest,2006,129(4):1068-1087.
[3] Li S,Hua ZC.FAK expression regulation and therapeutic potential[J].Adv Cancer Res,2008,101:45-61.
[4] Opazo Saez AM,Seow CY,Pare PD.Peripheral airway smooth muscle m echanics in obstructive airways disease[J].Am J Respir Crit Care Med,2000,161(3 Pt 1):910-917.
[5] Postma DS,Timens W.Remodeling in asthma and chronic obstructive pulmonary disease[J].Proc Am Thorac Soc,2006,3(5):434-439.
[6] Panettieri RA Jr.Airway smooth muscle:an immunomodulatory cell[J].J Allergy Clin Immunol,2002,110(Suppl 6):S269-S274.
[7] Beckett PA,Howarth PH.Pharmacotherapy and airway remodelling in asthma?[J].Thorax,2003,58(2):163-174.
[8] Kosciuch J,Krenke R,Gorska K,etal.Comparison of airway wall remodelingin asthma and COPD:biopsy findings[J].Respir Care,2012,57(4):557-564.
[9] Kosciuch J,Krenke R,Gorska K,etal.Relationship between airway wall thickness assessed by high-reolution computed tomography and lung function in patients with asthma and chronic obstructive pulmonary disease[J].J Physiol Pharmacol,2009,60,(Suppl 5):71-76.
[10] Gorska K,Krenke R,Korczynski P,etal.Eosinophilic airway inflammation in chronic obstructive pulmonary disease and asthma[J].J Physiol Pharmacol,2008,59(Suppl 6):261-270.
[11] Domagala-Kulawik J.Effects of cigarette smoke on the lung and systemic immunity[J].J Physiol Pharmacol,2008,59(Suppl 6):19-34.
[12] Churg A,Tai H,Coulthard T,etal.Cigarette smoke drives small airway remodeling by induction of growth factors in the airway wall[J].Am J Respir Crit Care Med,2006,174(12):1327-1334.
[13] Chung KF.Cytokines as targets in chronic obstructive pulmonary disease[J].Curr Drug Targets,2006,7(6):675-681.
[14] Vestbo J,Habsen EF.Airway Hyperresponsiveness and COPD Mortality[J].Thorax,2001,56(Suppl 2):ii11-ii14.
[15] Schaller MD,Borgman CA,Cobb BS,etal.PP125FAK,a structurally distinctve protein tyrosine kinase associated with focal adhesions[J].Proc Natl Acad Sci U S A,1992,89(11):5192-5196.
[16] Mitra SK,Hanson DA,Schlaepfer DD.Focal adhesion kinase:in command and control of cell motility[J].Nat Rev Mol Cell Biol,2005,6(1):56-58.
[17] 李树裕,王志钢.粘附斑激酶(FAK)及其信号通路研究进展[J].生物技术通报,2009(12):6-10.
[18] Dekkers BG,Schaafsma D,Nelemans SA,etal.Extracellular matrix proteins differentially regulate airway smooth muscle phenotype and function[J].Am J Physiol Lung Cell Mol Physiol,2007,292(6):L1405-L1413.
[19] Hui AY,Meens JA,Schick C,etal.Src and FAK mediate cell-matrix adhesion-dependent activation of Met during transformation of breast epithelial cells[J].J Cell Biochem,2009,107(6):1168-1181.
[20] Boosani CS,Nalabothula N,Munugalavadla V,etal.FAK and p38-MAPK kinase-dependent activation of apoptosis and caspase-3 in retinal endothelial cells by alpha1(Ⅳ) NC1[J].Invest Ophthalmol Vis Sci,2009,50(10):4567-4575.
[21] Busse W,Elias J,Sheppard D,etal.Airway remodeling and repair[J].Am J Respir Crit Care Med,1999,160(3):1035-1042.
[22] Chen G,Khalil N.TGF-beta1 increases proliferation of airway smooth muscle cells by phosphorylation of map kinases[J].Respir Res,2006,7:2.
[23] Horowitz JC,Lee DY,Waghray M,etal.Activation of the pro-survival phosphatidylinositol 3-kinase/AKT pathway by transforming growth fact or-beta1 inmes enchymal cells is mediated by p38 MAPK-dependent induct ion of an autocrine growth factor[J].J Biol Chem,2004,279(2):1359-1367.
[24] Rahman MS,Yamasaki A,Yang J,etal.IL-17A induces eotaxin-1/CC chemokine ligand 11 expression in human airway smooth muscle cells:role of MAPK(Erk1/2,JNK,and p38) pathways[J].J Immunol,2006,177(6):4064-4071.
[25] 唐永江,邱婷,徐治波,等.ERK1/2与实验性慢性阻塞性肺疾病大鼠模型气道平滑肌增殖的分子机制研究[J].陕西医学杂志,2009,38(1):3-6.
[26] Kuo PL,Huang MS,Huang SK,etal.Signalling pathway of isophorone diisocyanate-responsive interleukin-8 in airway smooth muscle cells[J].Eur Respir J,2011,37(5):1226-1236.
[27] Bryant PW,Zheng Q,Pumiglia KM.Focal adhesion kinase is a phospho-regulated repressor of Rac and proliferation in human endothelial cells[J].Biol Open,2012,1(8):723-730.
[28] Lin CL,Zhang ZX,Xu YJ,etal.Focal adhesion kinase antisense oligodeoxynucleotides inhibit human pulmonary artery smooth muscle cells proliferation and promote human pulmonary artery smooth muscle cells apoptosis[J].Chin Med J(Engl),2005,118(1):20-26.
[29] 林春龙,张珍祥,徐永健.黏着斑激酶促进人肺动脉平滑肌细胞增殖[J].基础医学与临床,2007,27(4):414-420.
