二倍体马铃薯叶肉细胞原生质体培养的研究
2014-03-25袁华玲金黎平黄三文屈冬玉
袁华玲, 金黎平, 黄三文, 李 颖, 屈冬玉
(1.中国农业科学院 蔬菜花卉研究所,北京 100081; 2.合肥师范学院 生命科学系,合肥 230601)
植物原生质体是开展遗传理论研究良好的试验材料,以原生质体为材料可以从遗传学、分子生物学、细胞生物学、植物生理学角度对细胞起源、细胞壁的生物合成、细胞膜的结构与功能、细胞核质关系以及植物激素作用机理等方面进行研究。原生质体还是遗传转化研究的理想受体,没有细胞壁的原生质体比较容易摄取外源的DNA、细胞器、病毒、质粒等,可以有目的地转入特定基因,改良作物的产量、品质、抗逆性等。原生质体培养再生植株过程中,往往会产生无性系变异,同时原生质体也可以通过理化因素诱变得到突变体,经适当筛选可选出有利用价值的变异体。利用原生质体融合技术能够克服杂交不亲和,进行远缘的体细胞杂交,创造新种质,因此植物原生质体在改变植物遗传性、改良作物品种的应用研究以及生物学的基础理论研究中有着广泛的用途[1, 2]。
马铃薯是原生质体培养研究较多的物种,有不少成功的报道[3-6],涉及的材料有四倍体栽培种、双单倍体品系和野生种,供体材料有叶片、块茎、芽、实生苗子叶及下胚轴游离细胞,其中以叶片游离细胞来源的居多,但是马铃薯原生质体分离和培养的程序多样,多数只是经验的总结,未能使技术达到系统化、程序化,存在着重复性和通用性较差的问题,有待于进一步研究。
中国马铃薯原生质体培养起步晚,培养成功的二倍体和双单倍体的基因型较少,本研究选用抗青枯病二倍体材料、炸片颜色好的二倍体材料以及具有优良农艺性状的双单倍体,对马铃薯叶肉原生质体培养进行研究,以期为利用体细胞杂交技术选育马铃薯新品种奠定基础。
1 材料和方法
1.1 试验材料
以马铃薯抗青枯病二倍体材料ED13和CE171、炸片颜色好的二倍体材料HS66以及优良性状双单体材料DH401和DH405为供体材料。其中ED13和CE171来源于马铃薯ED和CE分离群体,ED分离群体的亲本为E(772102.37)、D(USW7859)、C(USW5337),其中E来源于二倍体抗青枯病原始栽培种S.phureja.和S.vernei, 其遗传背景见文献[7]。HS66引自美国,DH401和DH405引自加拿大。供体材料培养在含2% 蔗糖和1 mg/L STS 固体MS培养基上,试管苗培养在25℃±1℃的培养室中, 光照强度54~60 μmol/ m2/s,每天16 h光照。
1.2 方法
1.2.1 预处理方法
叶片悬浮黑暗预培养是在无菌条件下剪取试管苗上部叶片约1 g,按Haberlach等人方法[3]进行。植株黑暗处理是将苗龄3周的试管苗连同三角瓶置于25℃黑暗中48 h。
1.2.2 原生质体分离、纯化和培养
原生质体分离纯化程序参照按周宇波方法[8]略修改,酶解液基本组成为CPW,附加PVP、甘露醇、BSA、MES、纤维素酶和离析酶,酶解后纯化,用血球计数板计算原生质体产量,FDA染色后荧光显微镜下观察生活原生质体数,计算原生质体活力。纯化后的原生质体密度调整为5×105个/mL,取600 μL加6 mL培养基培养于培养皿中。25℃黑暗培养1周后,逐渐转入光下培养,在15 d左右用稀释培养基稀释8~10倍,继续光下培养。培养室内培养条件为,温度25℃ ± 1℃, 光照强度54~60 μmol/ m2/s,每天16 h光照。
原生质体在液体培养基中生长成1 mm大小的愈伤组织时,将其转移到愈伤组织生长培养基中。2周后,将生长到3~4 mm的愈伤组织转移到芽诱导培养基中,当诱导出的芽生长到1 cm长时,将芽切下接种到固体MS培养基中,植株生长并生根。
2 结果与分析
2.1 不同预处理对原生质体产量和活力的影响
植物细胞的生理状态以及细胞是否耐受损伤具有较强的修复能力影响原生质体培养。预处理是在酶解前通过对材料的处理,改变细胞和细胞壁的生理状态,增加细胞膜的耐受度,减少原生质体损伤,提高酶解效率。以ED13为材料,用叶片悬浮黑暗预处理和试管苗黑暗预处理两种不同的方法对供体材料进行预处理,预处理后取约1 g叶片进行酶解分离,酶解液CPW附加2%PVP、0.5 mol/L甘露醇、0.2%BSA、3 mmol/L MES、0.3%纤维素酶和0.1%离析酶,酶解12 h。结果见表1。由表1可以看出,两种预处理方式对原生质体活力无显著影响。从减少操作环节、降低污染的可能性的角度来说,试管苗黑暗预处理方式要优于叶片悬浮黑暗预处理方式。

表1 预处理方式对原生质体产量和活力的影响
注:表中英文字母相同的数值间差异不显著(P>0.05)。
2.2 酶解液组成及酶解时间对原生质体分离的影响
2.2.1 酶解液中渗透压对原生质体膜稳定性的影响

图1 酶解液中不同浓度甘露醇对电导率的影响
由于原生质体本身稳定性差,很容易破碎,为保持释放出的原生质体具高活力,酶解液中常加入渗透剂以维持一定的渗透压,应用最广泛的是甘露醇和山梨醇。当细胞膜受到伤害时,细胞的通透性增大,细胞膜内的电解质外渗,细胞浸提液的电导率增大,因此电导率可反映细胞膜伤害的强度。以ED13为材料,甘露醇为渗透压稳定剂,探讨渗透压对原生质体膜稳定性的影响。酶解液CPW,附加2%PVP、0.2%BSA、3 mmol/L MES、0.3%纤维素酶、0.1%离析酶和不同浓度甘露醇,酶解12 h。结果见图1。由图1可以看出,叶片25℃酶解12 h时,电导率随着甘露醇浓度的提高先降后升,在甘露醇浓度为0.5 mol/L时,电导率最低,表明细胞内电解质渗漏最少,细胞受到的伤害最小。
2.2.2 酶解时间对原生质体膜稳定性的影响
以ED13为材料,酶解液CPW,附加2%PVP、0.2%BSA、3 mmol/L MES、0.3%纤维素酶和0.1%离析酶,研究酶解时间对电导率的影响。结果表明,与完整叶片相比,叶片切割后溶液中电导率增加,表明细胞破碎或受到伤害,电解质外渗。随着酶解时间的增加,电导率逐渐提高,表明酶解时间越长,细胞内的电解质外渗的越多,细胞受到的伤害越大。因此在能获得足够数量的原生质体前提下,酶解的时间越短越好。
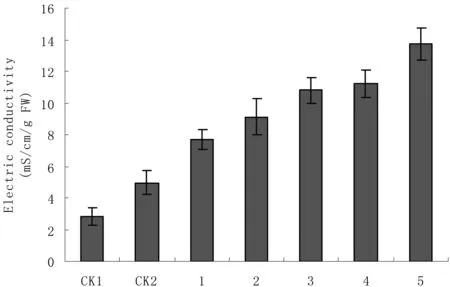
CK1:完整叶片;CK2:叶片切条;1: 4 h;2: 8 h;3:12 h;4: 16 h;5: 20 h
2.2.3 基因型、酶浓度对原生质体产量和活力的影响
酶的种类和浓度是影响原生质体活力和产量的最主要因素。以ED13为材料,酶解液CPW,附加2%PVP、0.2%BSA、3 mmol/L MES以及不同浓度纤维素酶和离析酶,酶解叶片12 h,研究酶浓度对原生质体分离的影响,结果见表2。由表2可知,纤维素酶浓度过低(0.1%),游离的单细胞少,且呈不规则形状,表现为细胞壁不完全降解的特征;随着纤维素酶浓度的提高,游离的单细胞增多,细胞呈圆球形;纤维素酶的浓度过高(1%),细胞破碎现象较为严重,细胞碎片多。离析酶浓度低(0.01%),叶片组织不能充分解离;随着离析酶浓度的增加,叶片组织解离,游离的单细胞增多;离析酶浓度过高(0.5%),叶肉细胞破碎,单细胞减少。
由于不同基因型叶片结构存在差异,不同基因型酶解时所需的最佳酶浓度略有差异,分别设纤维素酶浓度为0.3%和0.4%,离析酶浓度0.05%和0.1%,观察不同酶组合对不同基因型分离的效果,结果见表3。由表3可知,在不同的酶组合中不同基因型的分离效果有差异,ED13、HS66和DH405分离时所需的酶浓度较低,在0.3% Cellulase + 0.1% Macerozyme的酶组合中分离的效果较好;CE171和DH401分离所需的酶浓度较高,在0.4% Cellulase + 0.1% Macerozyme的酶组合中分离的效果较好。

表2 不同酶组合对叶肉原生质体分离的影响
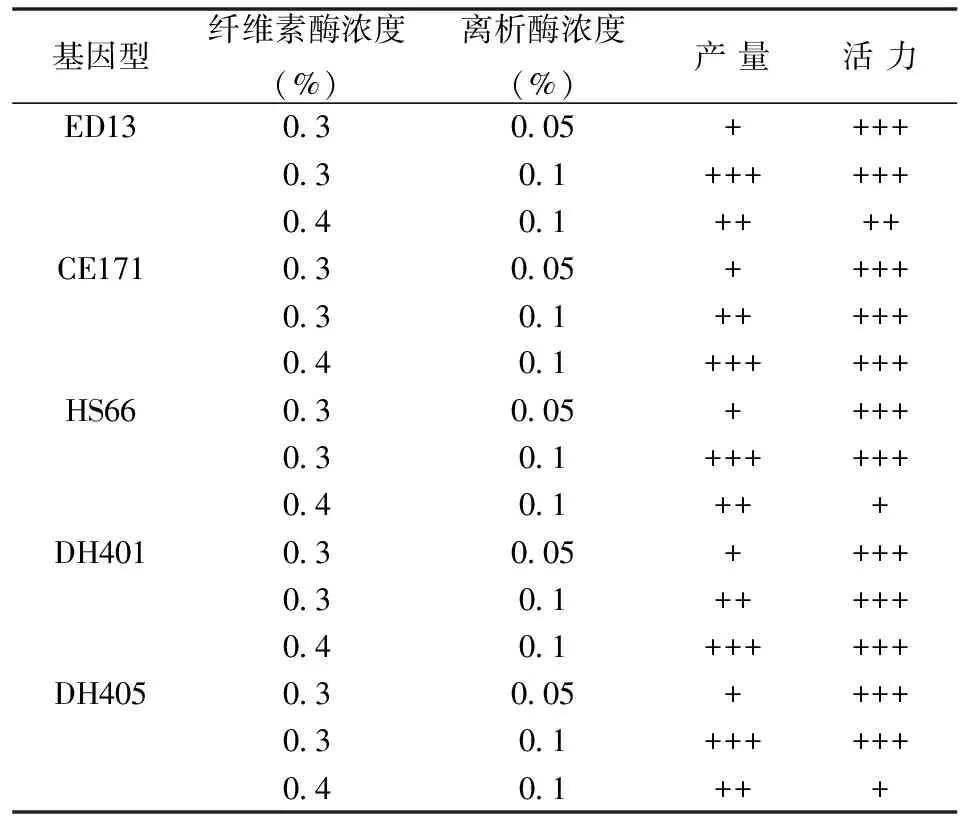
表3 不同基因型分离的效果
注:“+”表示原生质体产量或活力低;“++”表示原生质体产量或活力中等;“+++”表示原生质体产量或活力高。
2.2.4 原生质体培养及植株再生
分离纯化的原生质体调整密度5×105个/mL后,取600 μL加入到有6 mL VKM培养基的培养皿中,25℃黑暗条件下培养,第2 d细胞开始膨大,逐渐变为椭圆形,细胞第1次分裂发生在培养后的3~5 d,第7 d将培养皿置于弱光下,并逐渐增加光强,培养7~10 d左右形成多细胞团,2周后要及时用稀释培养基进行8~10倍的稀释,否则细胞褐化死亡,可能由于细胞生长过快引起营养枯竭或毒副产物积累所致。培养物稀释后继续培养3~4周,原生质体形成大量肉眼可见的愈伤组织。将小愈伤转移到愈伤组织生长培养基上,这些小愈伤在愈伤组织生长培养基上生长很快,约2周长成直径约3~4 mm大小的愈伤组织,再将愈伤组织转移到再生培养基上,诱导芽的生成。由于马铃薯愈伤组织芽诱导所需时间较长,愈伤组织在分化培养基上每隔2周转移1次。第1个芽发生在愈伤组织在分化培养基上诱导2个月左右,当芽长到0.5 cm以上时,可以将其切下,转移到无激素固体MS培养基上生长,无根苗在无激素固体MS培养基上可以自行生根 。
不同基因型在培养中的反应不同,存在着基因型差异(表4)。在VKM 培养基上培养6~8周,ED13和DH401原生质体能够形成3~4 mm愈伤组织,转移到诱导芽的培养基上,8周后分化出具有芽和根的完整植株,但是分化率较低,183块ED13愈伤组织只有39块分化出芽,分化率只有21.3%,157块DH401 愈伤组织只有27块分化出芽,分化率只有17.2%;HS66和CE171原生质体培养6~8周也能形成3~4 mm愈伤组织,但没有分化出芽;DH405的原生质体不分裂。
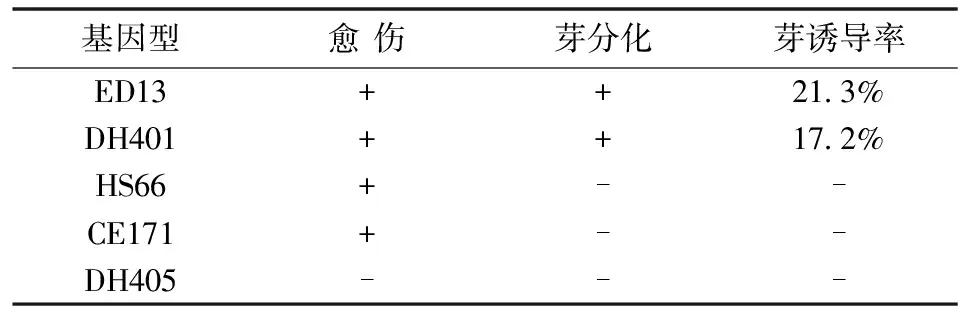
表4 不同基因型对原生质体培养的影响
注:“+”表示有;“-”表示无。

A—叶片漂浮预处理;B—界面法纯化原生质体;C—纯化的原生质体;D—FDA检测原生质体活力。
3 讨论
原生质体培养及再生体系的建立是原生质体技术应用于育种实践的前提。马铃薯原生质培养中首先要保证分离的原生质体有持续分裂的能力,其影响因素除培养基组成及培养方法外,供体的基因型、供体的生理状况、原生质体活力等均可影响原生质体培养的成败。
基因型是原生质体培养的关键因子。曾有文献报道油菜的再生能力以AABB 染色体组品种最强,AACC 次之,AA最差[9]。此外在苜蓿、生姜、葡萄、马铃薯原生质体培养时也发现在愈伤组织形成或再生上存在着基因型差异[10-12]。本试验中,马铃薯原生质培养中也是有些基因型获得了再生植株,DH405只分离到了活力强的原生质体,但不能持续分裂,虽然CE171和HS66获得了多细胞团的小愈伤,但失去了再分化的能力。

A—原生质体膨大;B—原生质体第一次分裂;C—形成的多细胞团;D—形成的小愈伤;E—愈伤组织分化出芽;F—原生质体再生出完整植株。
酶解时间和酶解温度对原生质体活力有决定性的影响,研究表明随着酶解时间增加,原生质体破裂,原生质体活力下降[13, 14]。我们的研究表明,总的趋势是酶解时间短,原生质体产量低;酶解时间长原生质体破裂较多,原生质体膜不稳定,膜的渗透性增加,原生质体活力降低甚至死亡,但是不同基因型最适酶浓度不同,需要在实践中反复摸索。推测可能与供体植株生长环境、生理状态以及叶片结构组成差异有关。
酶解液和纯化溶液中的渗透压也影响原生质体的活力。由于原生质体本身稳定性差的特性,很容易导致其破碎。因此原生质体分离和培养过程中,必须加入适当浓度的渗透剂以维持一定的渗透压,渗透压过高或过低都会影响原生质体膜的稳定性,造成原生质体凋亡或破裂。前人在分离马铃薯原生质体时所用的酶液,使用0.4~0.6 mol/L的甘露醇维持渗透压[15, 16]。我们研究结果表明,酶解液中渗透压的过高或过低会造成电导率增加,当酶解液含有0.5 mol/L甘露醇时,电导率最低,表明原生质体膜的渗透性最小,受到的伤害最少。
本研究通过原生质体分离纯化条件的摸索,已获得高产量、高活力原生质体,并培养成试管苗,已建立马铃薯原生质体培养体系,为马铃薯体细胞杂交奠定了基础。
参考文献:
[1]许智宏,卫志明. 植物原生质体培养和遗传操作[M]. 上海:上海科学技术出版社,1997.
[2]朱至清. 植物细胞工程[M]. 北京:化学工业出版社,2003.
[3]Haberlach G T, Cohen B A, Reichert N A, et al. Isolation, culture and regeneration of protoplasts from potato and several relatedSolanumspecies[J]. Plant Science, 1985, 39: 67-74.
[4]Hunt G J, Helgeson J P. A medium and simplified procedure for rowing single cells fromSolanumspecies[J]. Plant Science, 1989, 60: 251-257.
[5]Xu Y S, Pehu E, R.Malone, et al. Plant regeneration from protoplast ofSolanumspecies with potential agricultural value (S.hiertingii,S.polyadenium,S.capsicibaccatum) [J]. Plant Cell Reports, 1991, 9: 520-522.
[6]Szczerbakowa A, Maciejewska U, Pawlowski P, et al. Electrofusion of protoplast fromSolanumtuberosum,S.nigrumandS.bulbocastanum[J]. Acta Physiologiae Plantarum, 2001, 23: 169-179.
[7]Qu D Y. Use of unreduced gametes of potato for TPS production through 4X-2X crosses: (dissertation)[D]. Wageningen: Wageningen Agricultural University, 1996.
[8]周宇波,柳 俊, 谢从华,等. 马铃薯原生质体培养体系改良[J]. 华中农业大学学报,2001,20:469-473.
[9]刘选明,官春云. 油菜原生质体培养与融合技术的研究进展[J]. 湖南农业大学学报,1997,35:832-492.
[10]黄百渠. 植物体细胞遗传学简明教程[M]. 长春:东北师范大学出版社,1991.
[11]Coleman M, Davie P, Vessey J, et al. Intraclonal genetic variation for protoplast regeneration ability withinSolanumtuberosumcv. record[J]. Annals of Botany, 1991, 67: 459-461.
[12]Orczyk W, Przetakie-wicz J, Nadolska-orczyk A, et al. Somatic hybrids ofSolanumtuberosumapplication to genetics and breeding[J]. Plant Cell, Tissue and Organ Culture, 2003, 74: 1-13.
[13]吴旺泽,王 蒂, 王 清,等. 马铃薯原生质体游离与培养体系的研究[J]. 甘肃农业大学学报,2004,39:146-149.
[14]赵维峰, 孙光明. 毛叶枣与冬枣原生质体分离体系的建立[J]. 热带作物学报,2006,27:51-55.
[15]Orczyk W, Przetakiewicz J, Nadolska-Orczyk A, et al. Somatic hybrids ofSolanumtuberosum- application to genetics and breeding [J]. Plant Cell, Tissue and Organ Culture, 2003, 74: 1-13.
[16]Oberwalder B, Schilde-Rentschler L, Loffelhardt-Ruo B, et al. Differences between hybrids ofSolanumtuberosumandSolanumcircaeifoliumBitt. Obtained from symmetric and asymmetric fusion experiments[J]. Potato Research, 2000, 43: 71-82.
