土壤外源金霉素对小白菜幼苗的毒性效应与其赋存形态的相关性
2014-03-25肖明月纪占华魏树和台培东
安 婧,肖明月,2,纪占华,3,魏树和,台培东
(1.中国科学院沈阳应用生态研究所 污染生态与环境工程重点实验室,辽宁 沈阳 110016;2.辽宁石油化工大学,辽宁 抚顺 113001;3.中国科学院大学,北京 100049)
抗生素因具有促进生长和防止动物疾病的双重功效而被广泛应用于农牧业生产.据统计,目前世界上有50%以上的抗生素用于饲料加工和动物生产[1].在众多抗生素中,金霉素是国内外畜禽养殖场使用最为广泛的一种四环素类抗生素.2004年金霉素的世界总产量高达5×104t,其中绝大部分为饲料级[2].作为饲料添加剂的金霉素等抗生素被动物食用后,并不能被动物完全吸收利用,其中70%以上的药物会以母体形式通过粪便排出[3].这些含有抗生素的畜禽粪便常常作为有机肥料施入农田,导致抗生素在土壤中残留,进而引发一系列的土壤环境污染问题,给人类健康和生态系统带来潜在的风险.
目前对土壤外源抗生素的植物毒性效应主要是以其对植物生长发育的抑制作用来评价.以金霉素为例,Liu等研究表明金霉素对燕麦、水稻和黄瓜种子根伸长的半抑制质量浓度分别为16、39、48 mg/L[4];研究发现1~30 mg/L金霉素胁迫下,油菜的株高和根长均受到不同程度的抑制[5].此外,生物有效性也可以表征污染物的潜在毒性[6].有机污染物生物有效性研究的关键在于污染物赋存形态的分析.有机污染物常以不同的形态存在于土壤环境中,如水溶态、吸附态和固定态.污染物赋存形态不同,生物对它们的利用程度也不同,故其产生的毒性效应也不同[7].可见,污染物在土壤中的赋存形态,生物有效性与生态毒性效应之间是密切相关的.
生物有效性的评价方法较多,其中化学评价法因其简单、快速、费用低等特点得到了广泛应用.化学法是根据不同形态污染物生物有效性的差异,用不同的化学试剂或者试剂组合将污染物分离测试.可见,浸提剂的选择是化学法的技术关键.研究表明,乙醇、乙醇-水混合物及有机酸等温和性浸提剂和选择性浸提剂能够更为完整、真实地模拟土壤环境中有机物的生物有效性[8].值得注意的是,化学法提取的特定形态并不等同于其生物有效性,它和生物有效性的相关性要通过统计分析来衡量.由于不同浸提剂的提取机制不同,对于不同的土壤环境提取效率也有一定的差异.因此,还要分析污染物的化学提取量与其对生物毒性效应之间的相关程度,以综合评价该污染物的潜在生态风险.
基于此,本文首先研究了土壤外源金霉素对小白菜幼苗叶绿素、可溶性蛋白、丙二醛(MDA)及抗氧化酶等生理指标的毒性效应;同时,选用CaCl2水溶液、Na2EDTA-Mcllvaine(以下简称Na2EDTA-M)缓冲溶液、甲醇等浸提剂对土壤中金霉素的各种可提取态进行了测定和分析,并通过统计学分析方法,研究了金霉素对小白菜幼苗的毒性效应与其赋存形态的相关性.
1 材料与方法
1.1 实验材料
实验用盐酸金霉素为分析纯(纯度≥99%),购于南京奥多福尼生物科技有限公司,使用前不经过任何纯化,相关理化性质如表1所示.实验土壤为草甸棕壤,采自中国科学院沈阳生态实验站.经分析,其pH值6.76,有机质2.22 g/kg,全N 1.05 g/kg,全P 0.62 g/kg,全K 23.25 g/kg.实验所用小白菜品种为四季小白菜(BrassicarapaL.hinensis Group.),种子购于沈阳东亚种子公司.本实验所用其他化学药剂均为分析纯级.

表1 金霉素的主要理化性质Fig.1 Some physical and chemical properties of chlortetracycline
1.2 小白菜幼苗培养
称取1.0 kg土壤于花盆中,加入不同质量比的金霉素溶液,不断搅拌使金霉素在土壤中分布均匀.然后将花盆置于通风橱中避光平衡24 h.小白菜种子用体积分数为3.0% 的H2O2消毒后置于(25±1)℃的培养箱中发芽72 h,然后将幼苗移栽至加有金霉素的土壤中,培养条件为:每日光照12 h(光照度50 000 lx),恒温(25±1)℃,定期浇水,使土壤中水的质量分数经常保持在田间持水量的60%左右.培养7 d后取土壤进行提取分析,并对小白菜幼苗进行生理生化指标分析.
1.3 小白菜幼苗生理生化指标的测定[10-11]
可溶性蛋白质量分数采用考马斯亮蓝G-250染色法测定,超氧化歧化酶(SOD)活性采用氮蓝四唑光化学还原法测定,过氧化物酶(POD)活性采用愈创木酚比色法测定,过氧化氢酶(CAT)活性采用紫外分光光度法测定.
1.4 土壤中金霉素的提取与分析
将小白菜幼苗挑出后,把土壤混匀,四分法取样.称取一定质量土壤(换算成干土质量为2.0 g)于10 mL离心瓶中.先加入10 mL 0.01 mol/L CaCl2水溶液(pH 5.5)),漩涡仪匀质30 s后,超声和振荡提取各15 min,提取结束后,离心(4 000 r/min)10 min,收集上清液,残渣按上述方法反复提取2次,合并上清液,上清液通过用6 mL甲醇和6 mL Na2EDTA-M缓冲液(配制方法:称取柠檬酸12.9 g,磷酸氢二钠27.5 g,乙二胺四乙酸二钠37.2 g,溶于水中并定容到1 L[12])活化的HLB小柱,6 mL超纯水淋洗后干抽20 min,3 mL甲醇洗脱小柱,洗脱液用氮气吹至近干,用甲醇/水(体积比为3∶2)溶液定容至1 mL,溶液过0.22 μm滤膜后收集于样品瓶中冷藏待测.将Na2EDTA-M缓冲溶液(pH 4.0)与已经被CaCl2水溶液浸提过的土壤样品混合,重复上述处理过程.最后,用甲醇/Na2EDTA-M缓冲液混合液(pH 4.0)与两次浸提后的土壤样品混合,重复上述处理过程.
超高效液相色谱测定条件:采用waters2695-2696测定,利用UV检测器.色谱条件为色谱柱:XTerraRP 185 μm,4.6.erraR;流动相:0.01 mol/L的草酸和乙腈混合溶液(体积比为75∶25);流速:1.0 mL/min;进样量:20 μL;柱温:25 ℃;紫外检测波长为268 nm.
1.5 数据处理
采用Microsoft Excel 2007软件对数据进行处理和绘图,采用SPSS 11.5统计分析软件对数据进行显著性及差异显著性检验,毒性数据与金霉素提取量之间的关系采用单元线性回归法建立回归关系;在数据满足正态性、齐次性和独立性的基础上,采用LSD方法进行多重比较.用英文小写字母表示各处理组间的相关性及差异显著性(p<0.05).
2 结果与分析
2.1 小白菜幼苗对金霉素污染胁迫的响应
不同质量比金霉素暴露下,小白菜幼苗体内主要生理生化指标的变化如图1所示.1~5 mg/kg金霉素对小白菜幼苗鲜重无显著影响,金霉素质量比的增加可以显著诱导小白菜鲜重上升,50 mg/kg金霉素处理下,小白菜鲜重增加了12.25%.但是当金霉素质量比达到100 mg/kg时,小白菜鲜重降低了7.85%.1~100 mg/kg金霉素显著抑制了小白菜幼苗中叶绿素质量分数,抑制率范围为17.12%~38.59%.1 mg/kg金霉素胁迫下,小白菜体内可溶性蛋白与对照相比显著增加,但是随金霉素质量比的增加,小白菜体内的可溶性蛋白质量分数则显著降低,处理组间差异显著.此外,金霉素胁迫使小白菜体内MDA和主要的抗氧化酶也发生了不同程度的变化.小白菜体内的MDA被金霉素显著诱导,而SOD、POD和CAT活性均呈下降趋势,且处理组间差异显著.
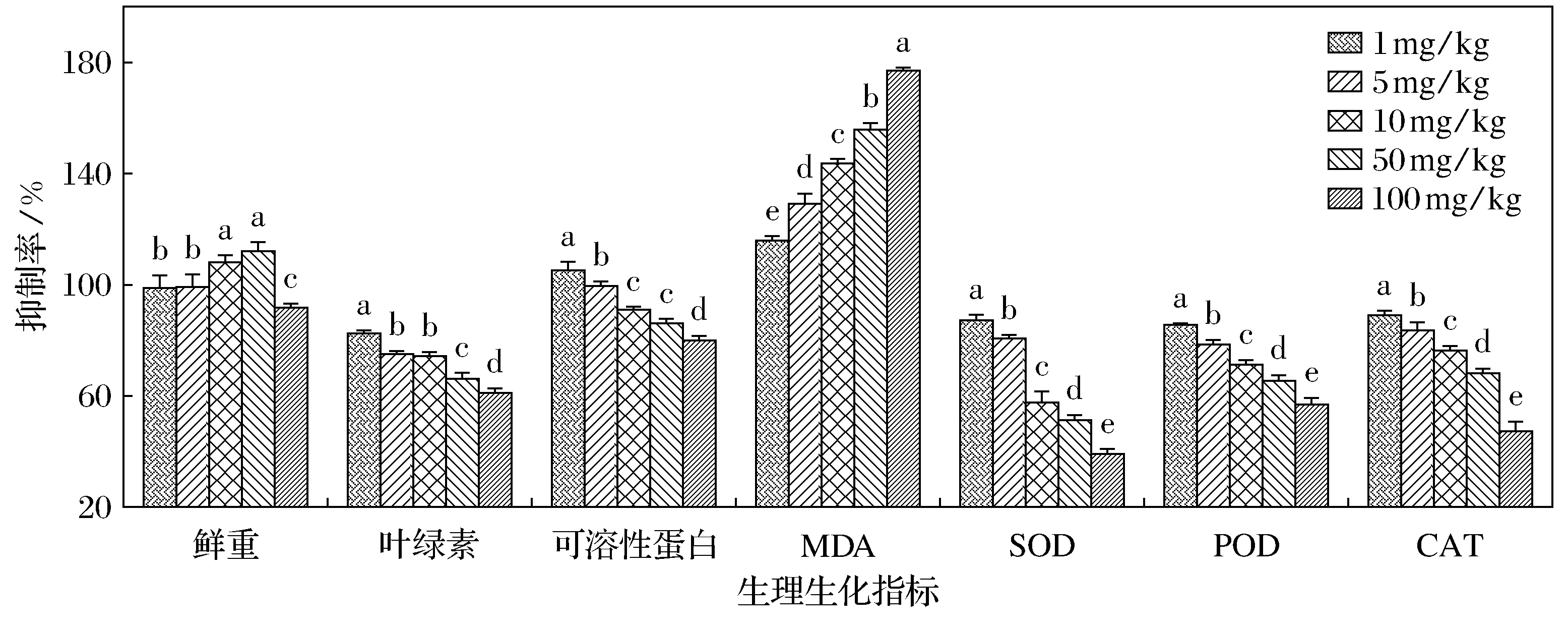
图1 金霉素对小白菜幼苗生理生化指标的影响Fig.1 Effects of chlortetracycline on the physiological indices of Chinese cabbage seedling注: 图中小写字母表示差异显著(p<0.05)
有机污染物胁迫下植物的生长发育,例如植物的根茎、鲜重、叶绿素、可溶性蛋白等生理指标对污染物的响应,是直观、快捷的检测污染物对植物毒性的重要指标.实验表明金霉素低质量比时对小白菜鲜重具有促进作用,高质量比时则呈现出抑制作用.Migliore等[13]研究也发现恩诺沙星对黄瓜、生菜、菜豆、萝卜的生长有毒性效应,在低质量比时促进植物生长,而在高质量比时抑制植物生长.叶绿素是光合作用的主要色素,影响着光合速率的强弱,是衡量叶片衰老的重要标志,其质量分数的多少对植物的光合作用有重要影响.在受到外界环境胁迫时,植物体内光合色素的合成会受到抑制[14].有研究表明,在污染物胁迫下,由于捕光化合物LHC蛋白合成的转录过程会受到抑制,而且初期形成的叶绿素单体也被光氧化分解,导致光截获LHC的形成受到影响,从而影响叶绿素的合成[15].本研究的实验结果也发现,金霉素胁迫下,小白菜幼苗叶片中叶绿素质量分数显著降低.与叶绿素相似,植物体内可溶性蛋白质量分数的变化也是外界胁迫下植物生长发育受到影响的直接指标[16].当植物适应其生长环境进而进入旺盛生长期时,其体内各种代谢活动旺盛,可溶性蛋白的合成能力也有所增强.但是当植物受到有机污染物、重金属或寒旱天气等胁迫下,其体内合成的蛋白量会下降[17].本研究也得到了相似的结果,当金霉素质量比大于10 mg/kg时,小白菜幼苗体内的可溶性蛋白质量分数显著降低.MDA是氧化损伤最终形成的脂质过氧化产物,其质量分数可间接提示植物机体自由基水平[18].本实验结果表明,小白菜幼苗体内MDA质量分数随金霉素暴露质量比的增加而上升,说明金霉素胁迫使小白菜体内产生了过量的具有强氧化性的自由基,从而导致小白菜幼苗体内受到氧化损伤.植物体内具有多种自我保护机制,这些机制可以去除或降低自由基对植物的损伤.植物体内的抗氧化系统是众多保护机制中对污染物胁迫最为敏感的系统,其中SOD、POD和CAT是生物体抗氧化防御系统中典型的抗氧化酶.SOD是生物体内重要的氧自由基消除剂,它能把O2-转化成O2和H2O2,抑制高活性的OH等自由基形成,终止自由基连锁反应,保护生物体免受氧化损伤,而POD和CAT是清除H2O2的重要酶类,它们可以协同作用将SOD歧化自由基的产物H2O2转化为H2O和O2[19].本研究结果发现,金霉素胁迫下小白菜体内的抗氧化酶活性随着金霉素质量比的增大显著下降,说明植物体内产生了过量自由基,从而使SOD、POD和CAT酶之间的平衡机制被破坏.
2.2 土壤中金霉素的形态及分布特征
有机污染物常以不同的形态存在于土壤环境中,如水溶态、吸附态和固定态等.污染物赋存形态不同,生物对它们的利用程度也不同,通常水溶态的生物有效性最高,其次是吸附态,最低的是固定态.不同化学浸提剂对金霉素的提取率如表2所示.CaCl2水溶液对各处理质量比金霉素的提取率为0.26%~0.45%之间,Na2EDTA-M缓冲液对1~100 mg/kg金霉素的提取率为51.07%~65.47%,且随着金霉素质量比的增加,Na2EDTA-M缓冲液对金霉素的浸提率也有所上升.甲醇的加入可将金霉素的浸提率增加22.00%~25.20%.
不同化学浸提剂对金霉素提取率与其化学性质有一定的关系.通常认为CaCl2水溶液是一种较为温和的提取剂,用以代表土壤中污染物的不稳定部分[20],例如容易被水解和可交换利用的部分.由于金霉素在水溶液中的溶解度极低,因此,能够被CaCl2水溶液浸提出来的金霉素质量分数也相对较少,也就是说以水溶态存在于土壤中的金霉素质量分数较低.EDTA-2Na是一种良好的配合剂,具有广泛的配位性能,因此Na2EDTA-M缓冲液作为一种温和的提取剂常用于提取土壤中的各种污染物[21-22].有学者提出Na2EDTA-M缓冲溶液可将与土壤有机质结合的那部分污染物提取出来[23].此外,金霉素等四环素类抗生素能与金属离子,尤其是2价和3价阳离子形成螯合物[24],由于Na2EDTA-M缓冲液是一种竞争性螯合剂,它能够有效地降低抗生素与阳离子的螯合,使更多以吸附态(吸附或螯合)存在于土壤中的金霉素被提取出来.甲醇的加入有助于提高金霉素的提取率,依据“相似相溶”原则,含有相同官能团的物质互溶.金霉素在甲醇中的溶解度为17.4 g/L,大于其在水溶液中的溶解度,使更多与土壤有机质结合的金霉素被释放.本研究表明甲醇将Na2EDTA-M缓冲液对金霉素的提取率提高22.00%~25.20%.
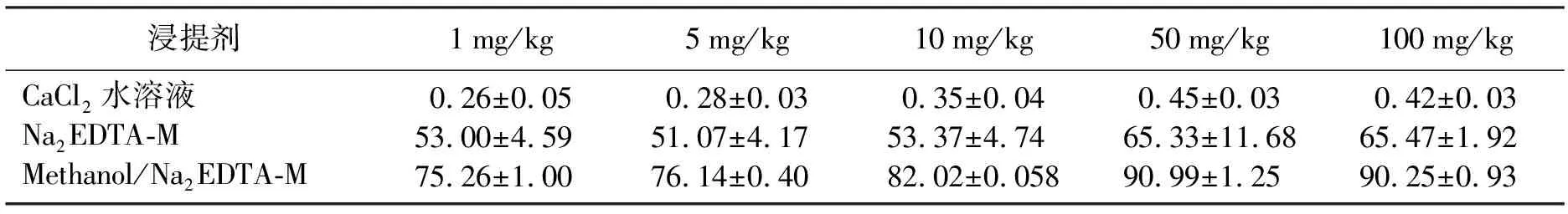
表2 不同化学浸提剂质量比对金霉素的提取率Table 2 Extraction ratio of CTC extracted by some extractants %
2.3 金霉素的毒性效应与其赋存形态的相关性
表3列出了不同提取剂对土壤中金霉素的提取量与小白菜幼苗主要毒理学指标之间的关系.结果表明,金霉素对小白菜幼苗鲜重和CAT酶活性产生的毒性效应与本实验选取的提取剂对其提取率之间没有显著相关性.CaCl2水溶液提取率(水溶态)和Na2EDTA-M缓冲液提取率(吸附态)、甲醇/Na2EDTA-M缓冲液提取率与小白菜幼苗中叶绿素、可溶性蛋白、MDA、SOD和POD等指标具有显著的相关性.但是甲醇加入Na2EDTA-M缓冲液后增加的那部分提取率则与这些生理指标无显著相关性(数据未列出).基于最大的相关系数,金霉素对小白菜的毒理学指标与可被甲醇/Na2EDTA-M缓冲液浸提的金霉素的相关性最好,尤其是可溶性蛋白质量分数、SOD和POD酶活性与不同提取剂对土壤中金霉素的提取量之间具有较大的相关性,这表明该化学法可以较好的表征金霉素的毒性效应.尽管毒性指标并不能确定土壤中外源金霉素在植物体内的积累量,但通过将污染物的毒性指标与化学法测定的其生物有效性建立某种特定的联系,以更好的预测污染物的生物有效性是一个较为有用的方法.目前,已经有学者利用该方法评估和预测重金属的生物有效性.Smith等通过测定后代出生率和不同化学提取剂的提取量,发现CaCl2提取法和蚯蚓内脏模拟实验都能较好的预测重金属对蚯蚓的有效性,且两者之间具有一定的内在联系[25];Frassinetti等采用硅藻内的植物螯合素作为生物标记物来揭示重金属的生物有效性,发现硅藻细胞内植物螯合素的质量比与洗脱液中镉的总溶解质量比之间存在显著的正相关性[26].

表3 小白菜幼苗毒理学指标与不同浸提剂对金霉素提取量之间的相关性Table 3 Correlation between the physiological indexes of Chinese cabbage seedling and the extraction capacity of CTC by some extractants
注: 表格里的数值是相关系数R2值,p<0.05.
3 结 论
(1) 实验质量比金霉素对小白菜幼苗鲜重、叶绿素、可溶性蛋白、MDA和抗氧化酶活性等指标具有一定的毒性效应.
(2) 不同化学提取剂对土壤中金霉素的提取效率不同,50%以上的金霉素可以被Na2EDTA-Mcllvaine缓冲液浸提,甲醇可以将Na2EDTA-Mcllvaine缓冲液对金霉素的浸提效率提高22.00%~25.20%.
(3) 小白菜体内可溶性蛋白、SOD、POD、MDA等生理指标与可提取态的金霉素的相关系数最高,可作为有效评估金霉素生物有效性的生物指示物.
参考文献:
[1] Sarmah A K,Meyer M T,Boxall A B.A Global Perspective on the Use,Sales,Exposure Pathways,Occurrence,Fate and Effects of Veterinary Antibiotics in the Environment[J].Chemosphere,2006,65(5):725-759.
[2] Simon N S.Loosely Bound Oxytetracy Cline in Riverine Sediments from Two Tributaries of the Chesapeake Bay[J].Environmental Science &Technology,2005,39(9):3480-3487.
[4] Liu F,Ying G G,Tao R,et al.Effects of Six Selected Antibiotics on Plant Growth and Soil Microbial and Enzymatic Activities[J].Environmental Pollution,2009,157:1636-1642.
[5] 魏瑞成,邵明诚,陈明,等.金霉素和4-差向金霉素对油菜生长的影响及其在幼苗体内的积累[J].农业环境科学学报,2012,31(7):1289-1295.
(Wei Ruicheng,Shao Mingcheng,Chen Ming,et al.Effects of Chlortetracycline and 4-epi-chlortetracycline on the Growth of Rape and its Accumulation in Seedling[J].Journal of Agro-Environment Science,2012,31(7):1289-1295.)
[6] Scientific Principles of Soil Hazard Assessment of Substances,Technical Report No.84[R].European Centre for Ecotoxicology and Toxicology of Chemicals (ECETOC),Brussels,Belgium,2002:24-26.
[7] 单孝全,王子健,张淑贞,等.形态分析、生物可给性与生态毒理研究[J].中国科学院院刊,2002,1: 37-40.
(Shan Xiaoquan,Wang Zijiang,Zhang Shuzhen,et al.Study on Speciation Analysis,Bioavailability and Ecotoxicology[J].Bulletin of Chinese Academy of Sciences,2002,1:37-40.)
[8] Kelsey J W,Kottler B D,Alexander M.Selective Chemical Extract to Predict Bioavailability of Soil-Aged Organicals[J].Environmental Science &Technology,1997,31:214-217.
[9] 国家药典委员会.中华人民共和国药典[M].2版.北京:化学工业出版社,2005:539.
(Chinese Pharmacopoeia Commission.Pharmacopoeia of China[M].2nd Edtion.Beijing: Chemical Industry Press,2005:539.)
[10] 徐镜波,袁晓凡,郎佩珍.过氧化氢酶活性及活性抑制的紫外分光光度测定[J].环境化学,1997,16(1):73-76.
(Xu Jingbo,Yuan Xiaofan,Lang Peizhen.The Determination of Enzymic Activity and its Inhibition on Catalase by Ultraviolet Spectrophotometry[J].Environmental Chemistry,1997,16(1):73-76.)
[11] 郝建军,刘延吉.植物生理学实验技术[M].沈阳:辽宁科学技术出版社,2001.
(Hao Jianjun,Liu Yanji.Experimental Technology of Plant Physiology[M].Shenyang: Liaoning Science and Technology Press,2001.)
[12] 邰义萍,莫测辉,李彦文,等.固相萃取-高效液相色谱-荧光检测土壤中喹诺酮类抗生素[J].分析化学,2009,12:1733-1737.
(Tai Yiping,Mo Cehui,Li Yanwen,et al.Determination of Quinolones in Soils Using Solid Phase Extraction and High Performance Liquid Chromatography-Fluorimetric Detection[J].Chinese Journal of Analytical Chemistry,2009,12:1733-1737.)
[13] Migliore L,Cozzolino S,Fiori M.Phytotoxicity to and Uptake of Enrofloxacin in Crop Plants[J].Chemosphere,2003,52(7):1233-1244.
[14] 朱毅,范希峰,侯新村,等.柳枝稷苗期对钾营养胁迫耐受性的综合评价[J].农业资源与环境学报,2014,31(2):140-145.
(Zhu Yi,Fan Xifeng,Hou Xincun,et al.Comprehensive Evaluation of Potassium-Deficiency Stress of Switchgrass at Seedling Stage[J].Journal of Agricultural Resources and Environment,2014,31(2):140-145.)
[15] Horvàth G,Droppa M,Oravecz.Formation of the Photosynthetic Apparatus during Greening of Cadmium Poisoned Barley Leaves[J].Planta,1996,199(2):238-243
[16] 周启星,罗义,王美娥.抗生素的环境残留、生态毒性及抗性基因污染[J].生态毒理学报,2007,2(3):243-251.
(Zhou Qixing,Luo Yi,Wang Mei’e.Environmental Residues and Ecotoxicity of Antibiotics and their Resistance Gene Pollution: A Review[J].Asian Journal of Ecotoxicology,2007,2(3):243-251.)
[17] Wu X Y,von Tiedemann A.Impact of Fungicides on Active Oxygen Species and Antioxidant Enzymes in Spring Barley (Hordeum vulgare L.) Exposed to Ozone[J].Environmental Pollution,2002,116:37-47.
[18] Porter N A.Chemistry of Lipid Peroxidation[J].Methods in Enzymology,1984,105:273-282.
[19] An J,Zhou Q X,Sun Y B,et al.Ecotoxicological Effects of Typical Personal Care Products on Seed Germination and Seedling Development of Wheat (Triticumaestivum L.)[J].Chemosphere,2009,76(10):1428-1434.
[20] Smith B A,Greenberg B,Stephenson G L.Comparison of Biological and Chemical Measures of Metal Bioavailability in Field Soils: Test of a Novel Simulated Earthworm Gut Extraction[J].Chemosphere,2010,81(6):755-66.
[21] 余强,鲍艳宇,李艳梅,等.三种土壤中土霉素浸提方法的比较研究[J].中国环境科学,2011,31(6):951-957.
(Yu Qiang,Bao Yanyu,Li Yanmei,et al.Compare of Different Oxytetracycline Extraction Methods in the Three Soils[J].China Environmental Science,2011,31(6):951-957.)
[22] Hu X,Zhou Q,Luo Y.Occurrence and Source Analysis of Typical Veterinary Antibiotics in Manure,Soil,Vegetables and Groundwater from Organic Vegetable Bases,Northern China[J].Environmental Pollution,2010,158:2992-2998.
[23] Bossi R,Seiden P,Andersen SM,et al.Analysis of Metsulfuron-Methyl in Soil by Liquid Chromatography/Tandem Mass Spectrometry.Application to a Field Dissipation Study[J].Journal of Agricultural and Food Chemistry,1999,47(10):4462-4468.
[24] 单英杰,章明奎.不同来源畜禽的养分和污染物组成[J].中国生态农业学报,2012,20(1):80-86.
(Shan Yingjie,Zhang Mingkui.Contents of Nutrient Elements and Pollutants in Different Sources of Animal Manures[J].Chinese Journal of Eco-Agriculture,2012,20(1):80-86.)
[25] Smith B A,Greenberg B,Stephenson G L.Bioavailability of Copper and Zinc in Mining Soils[J].Archives of Environmental Contamination and Toxicology,2012,62(1):1-12.
[26] Frassinetti S,Pitzalis E,Mascherpa M C,et al.A Multidisciplinary Approach for Assessing the Toxicity of Marine Sediments: Analysis of Metal Content and Elutriate Bioassays Using Metal Bioavailability and Genotoxicity Biomarkers[J].Archives of Environmental Contamination and Toxicology,2012,62(1):13-21.
