洗毛用头状丝孢酵母产脂肪酶发酵条件研究
2014-03-25高大伟宋晓蕾苑变变郑来久王丽丽
高大伟,宋晓蕾,邹 鑫,苑变变,郑来久,王丽丽
(1.盐城工学院 纺织服装学院,江苏 盐城 224051; 2.大连工业大学 材料与纺织工程学院,辽宁 大连 116034)
洗毛的目的是去除羊毛上的尘土、羊汗、污垢和油脂等,获得没有缠结或毡化现象的洗净毛[1-4]。洗净毛是各种毛纺产品的基础,洗毛质量的好坏对后道加工工序影响显著[5-8]。洗毛的关键是去除羊毛脂,因为羊汗可溶于水,当羊毛脂去除时,粘附在其上的砂土污垢也会从羊毛上脱离。目前,洗毛领域的大多数研究都围绕着优化水介质洗毛方法,以提高洗净毛的质量而展开[9-11],很少涉及生物酶的应用。随着环境问题日益严重,探索环境友好型的清洁洗毛方法已成为当今研究趋势[12-14],生物酶法洗毛已成为研究方向[15-16]。本文对头状丝孢酵母产脂肪酶的发酵条件进行研究,采用逐因子试验筛选出菌株Trichosporon capitatum的最佳碳源和氮源,确定了产酶发酵的最佳条件。
1 材料与方法
1.1 菌种
本研究所用头状丝孢酵母(Trichosporon capitatum)为实验室保藏菌株。
1.2 培养基
斜面培养基(g/L):将发酵啤酒的原料(未加酒花),稀释至10波林,加琼脂20 g,过滤后分装试管,每管4 mL,8磅20 min灭菌。
种子培养基(g/L):葡萄糖10 g、蛋白胨2 g、酵母膏3 g、K2HPO42 g、MgSO4·7H2O 0.5 g、pH 7.0。
发酵培养基(g/L):葡萄糖10 g、黄豆粉40 g、 (NH4)2SO41 g、K2HPO42 g、MgSO4·7H2O
0.1 g、吐温-80 1 g/L、橄榄油2.5 g、pH 7.0。
1.3 接种和发酵
将活化后的菌种由培养斜面接种到种子培养基中,于30 ℃、180 r/min条件下培养24 h,制成液体种子培养物。然后按1%的接种量接入到产酶培养基中,在30 ℃、180 r/min下进行产酶试验,发酵液离心,取上清液测定脂肪酶的活力。本文根据实验需要改变培养基相应成分和浓度,对发酵条件进行优化。
1.4 酶活力的测定
按照QB/T1803-1993 酸碱滴定法测定脂肪酶酶活。本文为了更清晰地呈现出不同条件对酶活影响的差异,采用了相对酶活,即将酸碱滴定法测得最大酶活定义为100%,其它实际酶活除以最大酶活即得该酶活的百分数。
2 结果与讨论
2.1 最适碳源的选择
在发酵培养基的基础上,加入几种常见的碳源,接种发酵48 h后测定酶活,比较不同碳源对产酶的影响,实验结果如图1所示。
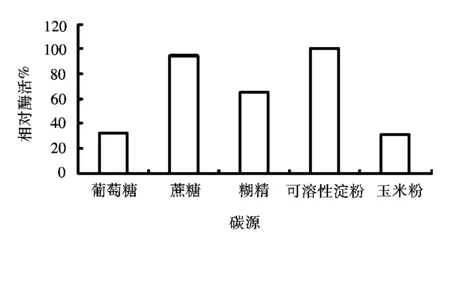
图1 不同碳源对产酶的影响Fig.1 Effect of various carbon sources on lipase production
从图1可以看出,在不同种类的碳源培养基中,产酶能力有很大的差异,碳源的种类对菌体发酵产酶活性影响较大。具体地说,以可溶性淀粉为碳源的产酶效果最好,而以葡萄糖为碳源时,只能产生较低的酶活力,因此选用可溶性淀粉作为发酵产酶的最佳碳源。
2.2 最适氮源的选择
在碳源优化的基础上,初始培养基中加入不同有机氮源和无机氮源,接种发酵48 h后测定酶活,比较不同氮源对产酶的影响,实验结果如图2所示。

图2 不同氮源对产酶的影响Fig.2 Effect of various nitrogen sources on lipase production
从图2可以看出,复合氮源明显优于单一氮源,以黄豆粉和(NH4)2SO4作为复合氮源时产酶效果最好;仅以黄豆粉为氮源时,次之;以NH4Cl为唯一氮源时,酶活力最低。而且有机氮源比无机氮源更利于产酶。因此选用黄豆粉和(NH4)2SO4作为发酵的最佳氮源。
2.3 初始pH值对产酶的影响
用1 mol/L的HCl和1 mol/L的NaOH调节发酵培养基的初始pH值,分别为5.0、6.0、7.0、8.0、9.0和10.0。30 ℃下发酵培养48 h,测定酶活,考察初始pH值对酶活的影响,实验结果如图3所示。

图3 初始pH值对产酶的影响Fig.3 Effect of initial pH on lipase production
从图3可以看出,发酵培养基的初始pH值对菌体发酵产酶影响比较大,原因可能是初始pH值过低不利于菌体产脂肪酶,而过高则对脂肪酶的产生有抑制作用。当培养基初始pH值在6.5时产酶最高。pH值过高或过低,菌体生长微弱,产酶下降,培养基pH值在6.5~7的范围内,有利于产酶。
2.4 接种量对产酶的影响
将培养24 h种子,分别按0.5%、1.0%、1.5%、2.0%、 3.0%、5.0% (V/V)的接种量接入装有30 mL产酶培养基的250 mL三角瓶中,30 ℃发酵48 h,测定脂肪酶活力,结果如图4所示。
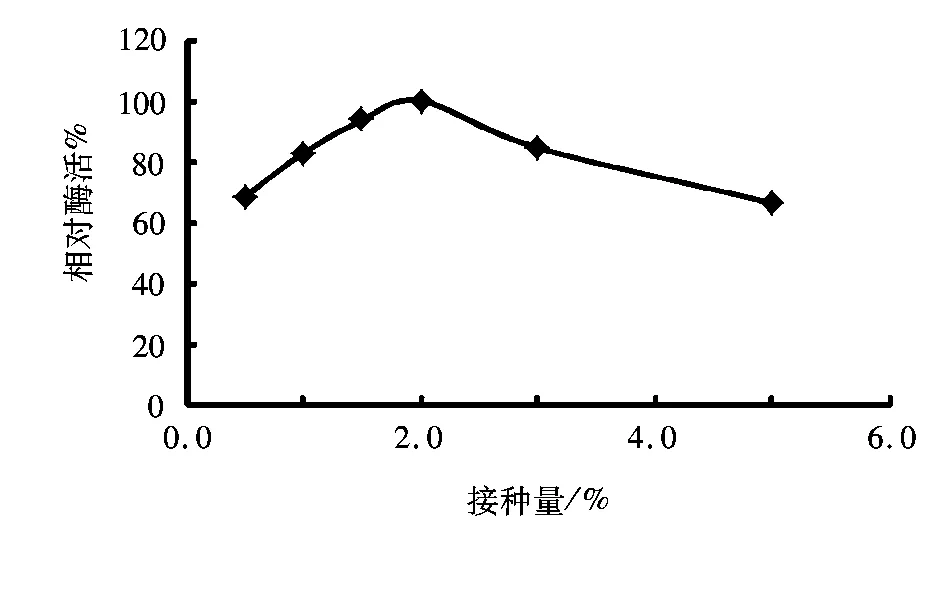
图4 接种量对产酶的影响Fig.4 Effect of inoculation amount on lipase production
由图4可以看出,接种量对脂肪酶有较大的影响。接种量过低,菌生长缓慢,影响产酶;而接种量过大,菌生长迅速,消耗大量基质,反而不利于产酶。当接种量为2%时脂肪酶活力最高,因此确定最佳接种量为2%。
2.5 装液量对产酶的影响
250 mL三角瓶中分别装入10、20、30、40、50、60 mL优化的发酵培养基,按2%的接种量接入种子,30 ℃发酵培养48 h后,测定不同装液量对酶活的影响,实验结果如图5所示。
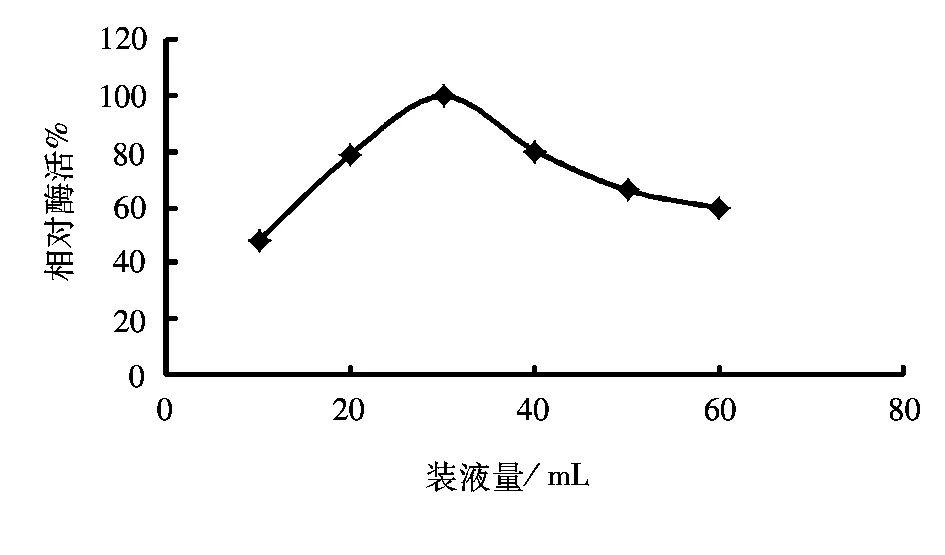
图5 装液量对产酶的影响Fig.5 Effect of Liquid volume on lipase production
由图5可以看出,装液量对产酶有一定影响,说明通气量(通气量与装液量正相关)是菌发酵产酶的重要影响因素。250 mL的三角瓶中装液量在30 mL时产酶最高;而增大装液量,氧溶量降低,菌体生长受阻,产酶也会随之降低,因此确定250 mL三角瓶中最佳装液量为30 mL。
2.6 最佳发酵温度的确定
以优化的发酵培养基,在不同温度下(24、26、28、30、32、34、36 ℃)摇瓶发酵培养,进行发酵产酶试验,48 h后测定酶活,寻找最佳的产酶温度,实验结果如图6所示。

图6 不同温度对产酶的影响Fig.6 Effect of various temperature on lipase production
由图6可以看出,在28 ℃下发酵时的酶活最高,30 ℃以上酶活明显下降。所以本实验选用28 ℃作为最佳发酵温度。
2.7 转速对产酶的影响
在上述优化后的发酵条件基础上,将转速替换为100、120、140、160、180、200、220 r/min进行发酵,48 h后测定酶活,实验结果如图7所示。

图7 不同转速对产酶的影响Fig.7 Effect of various rotate speed on lipase production
由图7可以看出,随着摇床转速的增大,菌体发酵产酶的活性逐渐增高,这进一步验证了通气量对发酵产酶的影响。当摇床转速太低时,产酶能力不足;随着摇床转速的提高,增加了氧溶量,脂肪酶产量增加;当转速达到160 r/min以后,产酶不再随转速的提升而升高。因此我们选定160 r/min为发酵产酶最佳转速。
2.8 诱导剂橄榄油对产酶的影响
在发酵培养基中添加不同含量的橄榄油,考察橄榄油对菌株产脂肪酶能力的影响。
由于脂肪酶分为结构型脂肪酶和诱导型脂肪酶,是否添加脂类底物作碳源或诱导物对不同的产酶微生物影响是不同的。本实验考察了橄榄油对该菌产酶能力的影响。实验表明,在培养基中添加一定范围的脂类能诱导脂肪酶产量的增加,证明该菌所产的脂肪酶属诱导型脂肪酶。由图8可以看出,在培养基中添加5 g/L的橄榄油能提高酶活,而过高的浓度却抑制产酶。其原因为添加过多的脂类会影响氧的传入,反而使产酶降低。同时油脂浓度过大,油脂水解过程中释放过多的脂肪酸引起阻遏作用导致酶产量减少。

图8 橄榄油对产酶的影响Fig.8 Effect of olive oil on lipase production
2.9 表面活性剂吐温-80对产酶的影响
在上述优化好的发酵培养基中,分别添加不同浓度的吐温-80,28 ℃发酵培养测定其产酶活力,实验结果如图9所示。
由于表面活性剂能改变细胞膜的通透性并改善氧在气液界面的传递速度, 因此在培养基中添加某些表面活性剂能提高酶的产量。吐温-80作为脂肪酶的诱导剂,它可以提高细胞膜的通透性,有利于胞外脂肪酶的分泌;同时还可改善氧在气液界面的传递速率,使酶活提高。由图9可以看出,当吐温-80浓度为1.5 g/L时,酶活力最高。因此本实验吐温-80的最适浓度为1.5 g/L。

图9 表面活性剂对产酶的影响Fig.9 Effect of surface-active agent on lipase production
3 结论
本文运用逐因子试验确定头状丝孢酵母Trichosporon capitatum产脂肪酶的最佳碳源和氮源分别为可溶性淀粉、黄豆粉和(NH4)2SO4。最优发酵条件为:培养基初始pH6.5、接种量2%、250 mL三角瓶中最佳装液量30 mL、发酵温度28 ℃、发酵产酶转速160 r/min、诱导剂橄榄油 5 g/L、表面活性剂吐温-80 1.5 g/L。
参考文献:
[1] 郭锦,王树根.超声波洗毛研究进展[J].毛纺科技,2013,41(2):54-57.
[2] 汪晓鹏.环境友好型洗毛剂的配方研究[J].皮革与化工,2013,30(3):29-32.
[3] 楚晓,李瑞敏,李小峰.不同洗毛工艺对比分析[J].毛纺科技,2011,39(8):55-58.
[4] 王健红,李美真.羊毛炭洗新工艺研究[J].毛纺科技,2013,41(4):57-60.
[5] Smith C H. A new concept in the control of liquor quality in raw wool scouring[J].Journal of the Textile Institute, 1999,80(1):138-146.
[6] Christoe J R. Development in wool scouring——an Australian view[J].Wool Science Review, 1998,26(64):25-43.
[7] Christoe J R. Objectives of the scouring process in symposium of the wool scouring and worsted carding: new approaches[Z].Australia:CSIRO Textile Division, 1996.
[8] 吴红玲,蒋少军,崔萍,等.洗毛生态技术的再讨论[J].毛纺科技,2004,3(5):47-49.
[9] 王清波,韦炬明.洗毛理论及实践[M].北京:纺织工业出版社,1992:18-35.
[10] 陶建勤,李南,许同洪.原毛去污防缩一步法工艺研究[J].毛纺科技,2002,27(6):27-30.
[11] R.G.斯特瓦尔特.洗毛新工艺[M].北京:纺织工业出版社,1987:32-91.
[12] 崔运花.超声波在洗毛中的应用[J].中国纺织大学学报,1999,25(2):50-54.
[13] 郭嫣,张茂林.超声波洗毛工艺[J].纺织学报,2006,27(10):96-98.
[14] Chris Hurren,张茂林,刘欣,等.澳大利亚含脂羊毛的超声波洗毛法研究[J].西安工程科技学院学报,2007,21(6):748-751,766.
[15] 王丽丽,高忠涛,杜冰,等.基于响应面法优化生物酶洗毛工艺[J].毛纺科技,2010,38(7):9-14.
[16] 郑来久,徐春圆,杜冰.生物酶洗毛鞘氨醇杆菌Sphingobacteium sp.的筛选与表征[J].科技导报,2011,29(33):26-29.
