布鲁氏杆菌LPS抗原制备及其免疫原性测定
2014-03-24夏小成刘晓颖
夏小成,刘晓颖
(1.江苏科技大学,江苏镇江212018;2.中国农业科学院特产研究所,长春130112)
布鲁氏杆菌(BrucellaBlues)属于革兰氏阴性不运动胞内寄生菌,可引发人、畜共患布鲁氏杆菌病[1],致使人与动物不孕、妊娠母体流产,是牛、鹿、羊等动物养殖中危害最大的3种疾病之一[2]。细菌内毒素(Intracellular toxin,LPS)有光滑型和粗造型2种形式。光滑型LPS和宿主细胞MHC-II类分子形成复合物被转运到细胞表面,干扰巨噬细胞在MHC-II存在的条件下提呈抗原,导致感染的宿主细胞呈递布鲁氏菌抗原特异性CD4+T的能力降低,从而调节宿主细胞的免疫活性,在感染机制中起着重要作用[3]。感染布鲁氏杆菌后产生的血清学反应直接作用于表面的LPS,人类及动物的布鲁氏杆菌病的临床诊断主要检测抗LPS抗体[4]。本研究对布鲁氏杆菌的LPS进行了提取、纯化和鉴定,并对其免疫原性进行了测定,为制备布鲁氏菌LPS单克隆抗体和布鲁氏菌杆菌病的快速诊断方法的建立奠定了研究基础。
1 材料和方法
1.1 材料
菌株M5布鲁氏菌杆菌菌株(中国军事兽医研究所疫病室赠送);BALB/c小鼠(30只,6~8周龄,25.4g左右,吉林大学实验动物中心);DNA酶、蛋白酶K(Thermo公司);蒽酮(Sigma公司);银染试剂盒(伯乐生物有限公司);RNA酶DAB显色试剂盒(天根生化科技有限公司);其他试剂均为国产分析纯。
1.2 方法
1.2.1菌体制备M5菌株经布鲁氏杆菌活菌苗固体培养基培养复壮,挑取单菌落,接种Brucella Broth液体培养基,37℃摇床培养48h。菌液革兰氏染色鉴定。继续传代培养,离心后,获得湿菌。生理盐水洗涤2次,蒸馏水洗涤1次,按1∶3用PBS悬浮菌体(1g湿菌悬浮于3mL PBS)。
1.2.2LPS抗原粗品制备反复冻融菌体悬液3次后,68℃水浴40min,与等量68℃ 90%苯酚混合,68℃水浴中剧烈搅拌30min。冷却至10℃左右,6 000r/min离心15min,收集上层水相。下层酚相加入等体积68℃超纯水,重复提取2次。收集水相,透析袋流水透析48h,超纯水透析48h(换液数次,直至水相用FeCl3检测无紫色出现为止),PEG 6 000浓缩4倍,即得LPS粗品。
1.2.3LPS纯化粗品LPS中加入10μg/mL RNA酶、10μg/mL DNA酶,37℃孵育40min,加入15μg/mL蛋白酶K,37℃孵育1h,冰浴冷却,1 500r/min离心20min,收集上清,加入2倍体积无水乙醇,沉淀后,即得纯化LPS冻干保存。
1.2.4LPS多糖含量测定蒽酮-硫酸法测定,以葡萄糖为标品制作浓度标准曲线[5]。
1.2.5LPSSDS-PAGE电泳银染采用5%浓缩胶和12%分离胶垂直板电泳检测,浓缩胶电压50V,分离胶电压80V;银染试剂盒对凝胶染色并观察。
1.2.6小鼠免疫及血清抗体效价测定试验共分3组,每组10只。首次免疫第0天第1组腹腔注射纯化LPS(由浓度108个/mL菌液纯化所得)乳化液0.5mL/只;第2组腹腔注射全菌乳化液0.5mL/只(菌液浓度108个/mL);第3组空白对照,腹腔注射蒸馏水。一共5次免疫,2次~5次免疫分别于第7天、第14天、第28天、第42天、第56天进行,方式同首次免疫,但注射液不乳化。5次免疫3d后,摘眼球采血,3 000r/min 10min,取血清备用。
效价测定采用血凝试验和斑点ELISA检测血清抗体效价。(包被全菌和纯化LPS,封闭液为2%的BSA,10倍梯度稀释血清,羊抗鼠IgG-HRP为二抗,DAB试剂盒显色)。
2 结果与分析
2.1 菌体制备及纯化
培养M5菌株的菌液浑浊,革兰氏染色。普通光学显微镜下(100×)观察呈红色短杆状或球状,确定为布鲁氏杆菌(图1)。

图1 布鲁氏杆菌的革兰氏染色(100×)
2.2 LPS得率
以葡萄糖含量为横坐标,OD486nm吸光度为纵坐标,制得标准曲线,回归方程为:y=0.002 4x-0.002 5(R2=0.998 2)。采用蒽酮-硫酸法测得样品OD平均值为0.119,LPS的浓度约为67.5μg/mL,得率为0.202%(w/w)(图2)。

图2 葡萄糖标准曲线
2.3 SDS-PAGE银染鉴定
将3个批次的纯化液、蛋白酶K、粗提液经12% SDS-PAGE电泳检测。在纯化液中得到了30ku左右的条带,没有蛋白酶K条带及其他杂带;粗提液中除了30ku左右的条带外,还含有其它杂带。说明经DNA酶、RNA酶、蛋白酶K消化处理之后,去除了粗提液中的杂蛋白,获得了较纯的LPS,与预期结果相同,结果见图3。

M.蛋白质分子量标准;1.第1批纯化LPS;2.第2批纯化LPS;3.LPS粗提液;4.第3批纯化LPS;5.蛋白酶K
M.Protein Molecular Weight Marker;1.The first batch of purified LPS;2.The second batch of purified LPS;3.Preliminary extraction of LPS;4.The third batch of purified;5.Proteinase K
图3SDS-PAGE银染鉴定LPS
Fig.3IdentificationofLPSbySDS-PAGEandSilver-staining
将纯化液浓缩,再次进行SDS-PAGE电泳检测,在28ku~36ku之间出现了清晰的条带,结果与图3完全一致,见图4。

M.蛋白质预染Maker(Fermentas);1、3.阴性对照;2、4.纯化LPS浓缩液
M.Plus prestained protein ladder;1,3.Negtive control;2,4.Concentrate Purified LPS
图4提纯的LPS银染鉴定
Fig.4IdentificationofLPSbySDS-PAGEandSilver-staining
2.4 免疫小鼠血清效价测定
2.4.1血凝试验检测血清效价
第2组全菌组凝集价为1∶640,第1组LPS组凝集价略低于1∶640,结果见表1。
表1血凝试验抗体效价
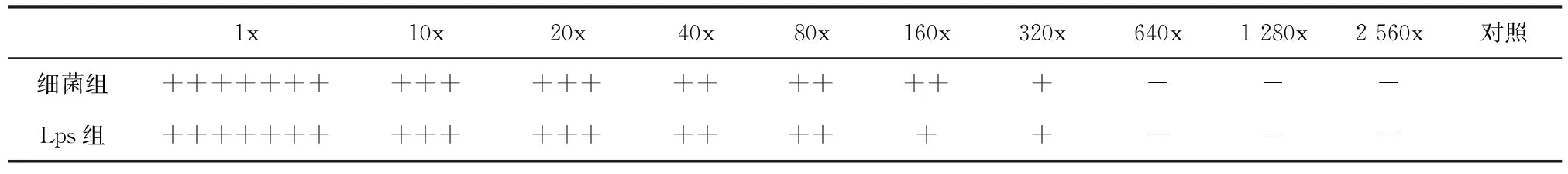
Table 1 Determination of antibody titer by Hemagglutination Test
注:+.阳性;-.阴性Note:+.indicates positive;-.indicates negative
2.4.2DOT-Elisa检测抗体血清效价血清被稀至1 000万倍时,DOT-Elisa检测仍能显色,但较为不明显;稀释100万倍时,显色较为清晰。2组免疫后抗体效价均约为1∶1 000 000,LPS和全菌液免疫原性接近,结果见图5。

图5 DOT-ELISA检测免疫小鼠血清效价
3 小结
在提取菌体脂多糖的过程中,疏水色谱和凝胶过滤虽有优越性,但热酚法因更简便、快速而被大多数实验室采用。本实验应用热酚法提取并经酶解纯化的M5菌株LPS抗原产率可达到0.2%。同时,采用酶解法去除杂蛋白和核酸,因而纯度较高(电泳条带呈1条带),去除了杂蛋白和核酸对LPS免疫原性的干扰[6]。经免疫后的小鼠,血清效价可达1∶1 000 000,表明纯化后的LPS仍有较高的免疫原性。目前,对布鲁氏杆菌的研究大多数都致力于Bp36、Omp31等的克隆表达,而忽略了LPS在布氏杆菌病快速诊断中的作用。应用高纯度的LPS制备抗LPS的单克隆抗体,采用ELISA、胶体金等免疫学方法,可建立布鲁氏杆菌病快速诊断体系,以实现对布鲁氏杆菌病高度特异、灵敏的检测。
[1]梅建军,王兴龙,万忠海,等.牛布鲁菌O链A抗原的提纯鉴定及种特异性单克隆抗体的研制[J].中国兽医学报,2008,28(12):1415-1417.
[2]王加兰,胡森,郑孝辉,等.光滑型布鲁氏菌单克隆抗体的制备及鉴定[J].中国预防兽医学报,2009,31(8):642-650.
[3]宋宏新,刘晓阳,李宏,等.改良热酚水法制备大肠杆菌O157:H7脂多糖抗原的研究[J].食品科学,2006,27(10):273-275.
[4]Weynants V,Gilson D.Characterization of a monoclonal antibody specific for Brucella smooth lipopolysaccharide and development of a competitive enzyme-linked immunosorbent assay to improve the serological diagnosis of brucellosis[J].Clin Diag Lab Immunol,1996,3(3):309-314.
[5]郑小坚,陆小平.桑树组织总糖含量蒽酮比色法测定技巧[J].广西蚕业,2002,39(1):53-54.
[6]Muck A,Ramm M,Hamburger M.Efficient method for preparation of highly purified lipopolysaccharicles by hydrophobic interation chromatography[J].Journal of Chromatography B,1999,732:39-46.
