在线离子交换-ICP-OES测定水中微量六价铬
2014-03-24韩双来
陈 斌,韩双来
1.中国环境监测总站国家环境保护环境监测质量控制重点实验室,北京 100012
2.聚光科技(杭州)股份有限公司,浙江 杭州 310052
制革废水中的主要污染物包括COD、有机物、硫化物、氨氮和铬离子[1-4],其中,铬离子存在形式为大量的三价铬[Cr(Ⅲ)]和少量的六价铬[Cr(Ⅵ)]。Cr(Ⅵ)是一种致癌物质,其毒性约为Cr(Ⅲ)的100倍,对生存环境和人体健康有明显的危害,因此一直是环境监测重要项目之一[5-8]。国家对污水中铬的排放标准(GB 8978—1996)具有严格的规定:总铬和Cr(Ⅵ)的最高允许排放量分别为1.5、0.5 mg/L[9]。
Cr(Ⅵ)常用分析方法主要有分光光度法[10]、原子吸收光谱法[11-12]、电感耦合等离子体质谱法(ICP-MS)[13]等。光度法具有操作过程繁琐、受外界干扰大等缺点;原子吸收光谱法具有灵敏度高、选择性强等优点,但其检测线性范围窄,给实际分析带来不便;ICP-MS具有检测灵敏度高,线性范围宽等优点,但其运行成本高,不易大规模推广使用[14]。 因此,有必要建立对制革废水中的Cr(Ⅵ)特异性检测的高灵敏分析方法。电感耦合等离子体原子发射光谱法(ICP-OES)对多种重金属元素具有良好的检出限(1~10 μg/L)、线性范围宽(5~6个数量级)、自动化程度高、高通量等,可以在短时间内同时测定多种元素,因而常被应用于环境水样中重金属的同时检测[15]。流动注射分析(FIA)是一种全自动化的流体分析技术,具有高效、操作简便、准确度和精密度高等特点。离子交换技术(IE)可将不同电荷的离子进行分离富集,具有检测灵敏度高等特点。针对制革废水中组成成分复杂、Cr(Ⅵ)浓度低等特点,将流动注射离子交换预富集与电感耦合等离子体原子发射光谱法相结合(FIA-IE-ICP-OES),应用于制革废水中微量Cr(Ⅵ)的分析检测,获得了较好的结果。
1 实验部分
1.1主要仪器与试剂
ICP-5000电感耦合等离子体原子发射光谱仪;UV 6100S型紫外可见分光光度计;Seveneasy型pH计;BSA124S型分析天平;WX-8000微波消解仪。
AG 1-X8树脂(AR级,美国);Cr(Ⅵ)标准储备液:称取110 ℃烘干的基准K2Cr2O70.282 9 g(精确至0.000 1 g)配成 1 000 mL溶液,此溶液中含Cr(Ⅵ)0.10 g/L,用时稀释成工作液。
0.1 mol/L K2HPO4缓冲溶液:称取2.28 g K2HPO4·3H2O溶解于1 000 mL水中,用磷酸调节pH至7.9~8.1,再用氩气(99.99%)脱气。
试剂均为优级纯,所用水为二次去离子水(电阻≥18 MΩ/cm)。
1.2方法原理
ICP-OES法是利用高频电磁场产生的等离子体激发被测元素,被测元素从基态跃迁到激发态再返回到基态并释放一定波长的光信号。根据波长位置和光信号强度对被测元素进行定性和定量分析。
FIA-IE法是在流动注射系统基础上,通过阀体流路设计,将样品溶液在流路中的离子交换柱上进行分离富集,再通过洗脱剂洗脱,具体装置如图1所示。
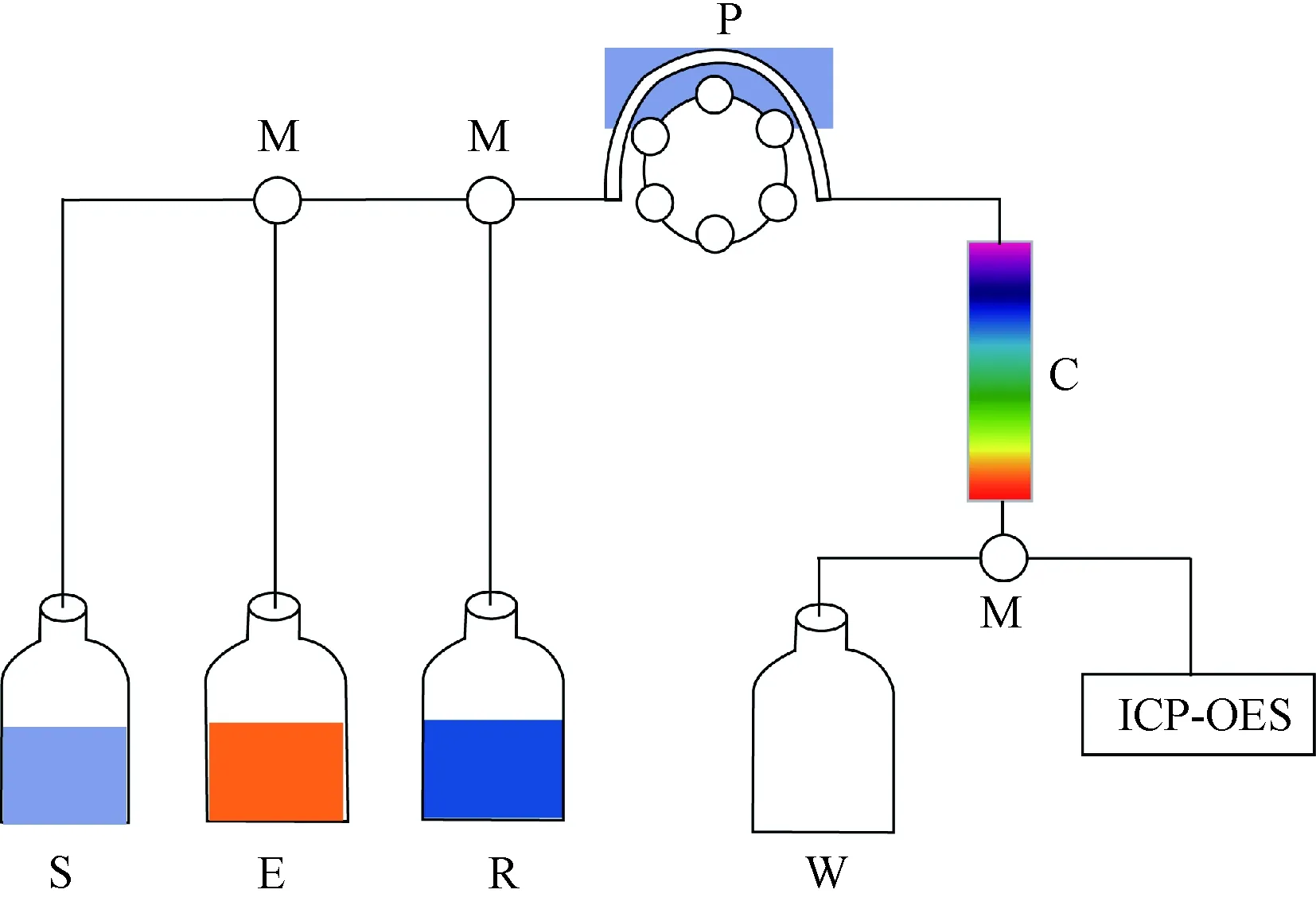
S:样品;E:洗脱剂;R:再生液;M:多通阀;P:蠕动泵;C:离子交换柱;W:废液
紫外可见分光光度法是在pH为1.9~2.1的酸性溶液中,Cr(Ⅵ)与二苯碳酰二肼反应生成紫红色化合物,在波长540 nm处进行测定。
1.3实验步骤
1.3.1标准曲线绘制
分别移取0、0.1、0.2、0.5、1.0 mL的Cr(Ⅵ)储备溶液到100 mL容量瓶中,在波长为540 nm条件下,用紫外分光光度计测试吸光度,并绘制标准曲线。
分别移取0、0.1、0.5、1.0、10 mL的Cr(Ⅵ)储备液到100 mL容量瓶中,用ICP-OES法测试不同浓度下的发射强度,并绘制标准曲线,条件如表1所示。
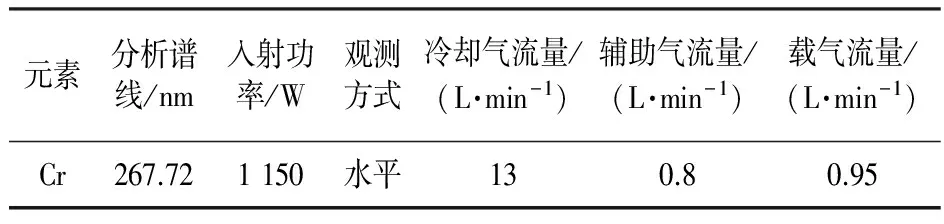
表1 ICP-OES仪器测量条件
1.3.2样品的采集与预处理
聚乙烯瓶先用硝酸浸泡24 h,再依次用一次、二次去离子水冲洗干净。采样时首先用制革废水润洗2~3次。
湿法消解法的分析步骤:在3个250 mL烧杯中分别加入100 mL的制革废水,再分别加入10 mL浓硝酸、浓硝酸-过氧化氢(体积比为5∶1)、浓硝酸-高氯酸(体积比为5∶1)进行消解,温度为200 ℃,时间为3 h。
微波消解法的分析步骤:在10 mL的制革废水中加入1 mL浓硝酸,密闭罐盖,在微波工作站中的消解程度为100 ℃消解10 min,180 ℃消解10 min,220 ℃消解20 min。消解完成后,罐内温度冷却至室温,压力降至0.1 MPa以下,将消解液转移到100 mL容量瓶中,用超纯水少量多次清洗内罐,清洗液合并至容量瓶中,定容至刻度。同时进行空白实验。
磷酸盐萃取法的分析步骤:在100 mL的制革废水中加入10 mL 0.10 mol/L的K2HPO4缓冲溶液,室温下振荡2 h。然后在萃取液中加入5.0 g活性炭,振荡10 min,使之完全接触,然后过滤。
1.3.3样品的测定
取500 mL通过磷酸盐萃取后的制革废水样品,以10 mL/min的速度通过填充AG 1-X8树脂的离子交换柱,采用5 mL(0.96 mol/L盐酸-90 g/L抗坏血酸)洗脱柱(富集效果为100倍),ICP-OES在线检测。
2 结果与讨论
2.1预处理方法的影响
为考察样品预处理方法对Cr(Ⅵ)分析检测的影响,选择不同组成的消解液对Cr(Ⅵ)的标准溶液进行预处理,按照“1.3.2节”的方法,所得样品采用ICP-OES法进行检测,结果如表2所示。
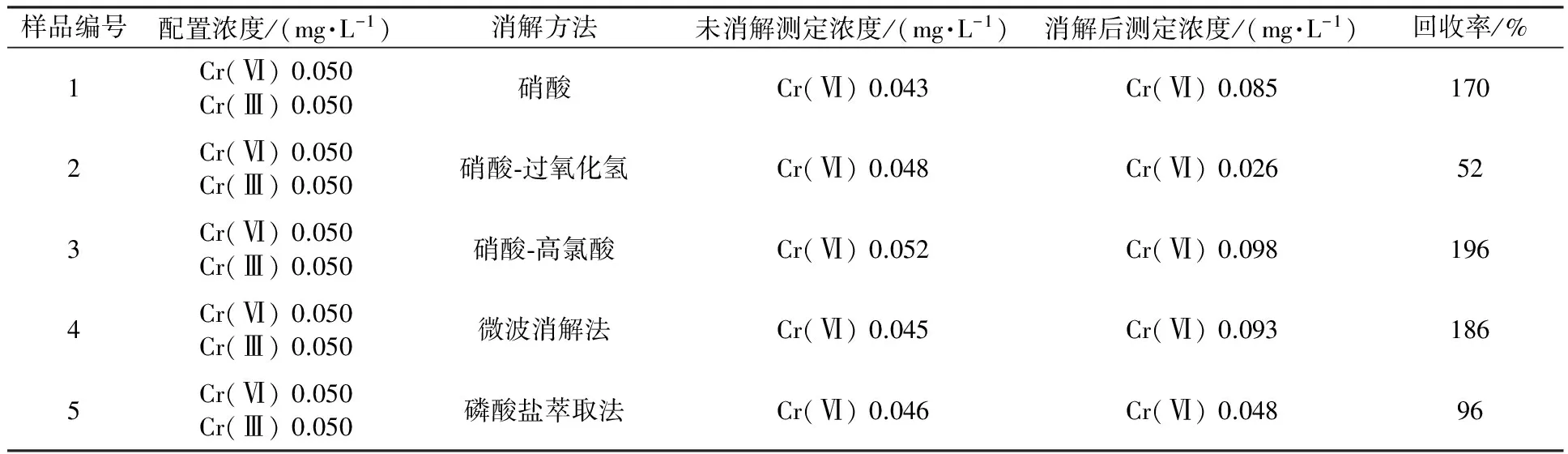
表2 不同消解方法对Cr(Ⅵ)检测的影响
从表2可见,若采用硝酸-过氧化氢或硝酸-高氯酸进行消解,均会导致铬发生价态的转变。在强酸性条件下,Cr(Ⅵ)与过氧化氢可以发生反应,如式(1)所示[16],高氯酸由于具有强氧化性可诱导Cr(Ⅲ)转变为Cr(Ⅵ),采用硝酸或微波消解时,环境中大量的氧气会诱导Cr(Ⅲ)发生氧化反应。
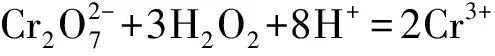
+3O2↑+7H2O
(1)
当采用磷酸盐缓冲液萃取Cr(Ⅵ)时不会诱导Cr(Ⅲ)和Cr(Ⅵ)发生价态转换,因此,可用于制革废水的样品预处理。
需要指出的是制革废水的颜色和浊度对于分析检测具有较大的影响,因此,采用磷酸盐缓冲液提取后的溶液需要通过活性炭脱色处理。
2.2洗脱剂的浓度和体积选择
比较盐酸、盐酸-抗坏血酸、抗坏血酸作为洗脱剂对于Cr(Ⅵ)分析检测的影响。测定结果显示,当盐酸的浓度为8%,抗坏血酸的浓度为9%时,Cr(Ⅵ)的回收率较好,由于高浓度酸对Cr(Ⅵ)的存在形式有影响,所以实验选择8%盐酸-9%抗坏血酸作为洗脱剂。
2.3进样速度和洗脱速度
以8%盐酸-9%抗坏血酸作为洗脱剂,考察了不同进样速度对于水样中Cr(Ⅵ)的吸附效果的影响,结果显示,当进样速度为10 mL/min,洗脱速度为10 mL/min时效果最佳。
2.4检出限、方法精密度与准确度
在选定的最佳实验条件下,Cr(Ⅵ)含量为0~100 μg/L内呈良好的线性关系,相关系数为0.999 8。采用空白溶液连续进样10次计算标准偏差,检出限为0.003 mg/L。为了验证方法的检测效果,采用0.020 、0.050、0.100 mg/L的标准样品进行准确度和精密度实验,并与二苯碳酰二肼分光光度法(GB 7467—1987)进行比较[17],结果如表3所示。
结果表明,国标方法难以实现微量Cr(Ⅵ)的分析检测,而FIA-IE-ICP-OES具有较好的测量精度和准确度,值得推广。
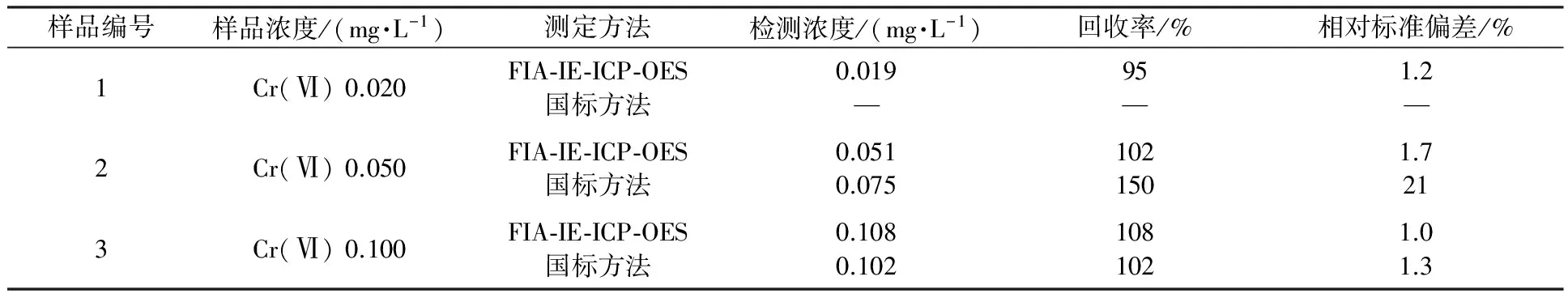
表3 方法精密度、准确度及与国标方法比较实验结果(n=12)
2.5实际制革废水的分析
准确量取制革废水500 mL,按照“1.3节”中实验步骤进行分离、富集和洗脱至5 mL,测定制革废水中Cr(Ⅵ)的含量,并与二苯碳酰二肼分光光度法进行对照[17]。2种分析方法的测定结果见表4。
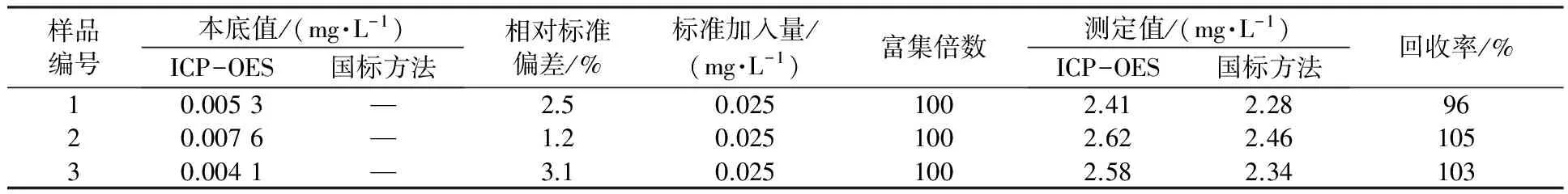
表4 制革废水中Cr(Ⅵ)的测定结果(n=6)
从表4可见,采用FIA-IE和ICP-OES相结合可实现制革废水中Cr(Ⅵ)的分析检测,回收率较好。该方法具有操作简便、测定快速、结果准确度高、绿色环保等特点,有望进一步推广应用。
3 结论
利用FIA-IE-ICP-OES法测定制革废水中的Cr(Ⅵ),流动注射离子交换技术能够消除基体组分的干扰,同时富集Cr(Ⅵ)的分析浓度。FIA-IE-ICP-OES具有操作简便、准确度高、精密度好等特点,能够满足水和废水监测技术的要求,可考虑进一步推广使用。
参考文献:
[1]Chen S J, Zhang X S, Yu L Y, et al. Simultaneous determination of Cr(Ⅲ) and Cr(Ⅵ) in tannery wastewater using low pressure ion chromatography combined with flow injection spectrophotometry[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy,2012,88:49-55.
[2]Meric S, Nicola E D, Iaccarino M, et al. Toxicity of leather tanning wastewater effluents in sea urchin early development and in marine microalgae[J]. Chemosphere,2005,61(2):208-217.
[3]Ouejhani A, Hellal F, Dachraoui M, et al. Application of Doehlert matrix to the study of electrochemical oxidation of Cr(Ⅲ) to Cr(Ⅵ) in order to recover chromium from wastewater tanning baths[J]. Journal of Hazardous Materials, 2008, 157(2/3):423-431.
[4]Tahir S S, Naseem R. Removal of Cr(Ⅲ) from tannery wastewater by adsorption onto bentonite clay[J]. Separation and Purification Technology, 2007, 53(3):312-321.
[5]El-Shahawi M S, Hassan S S M, Othman A M, et al. Retention profile and subsequent chemical speciation of chromium (Ⅲ) and (Ⅵ) in industrial wastewater samples employing some onium cations loaded polyurethane foams[J]. Microchemical Journal, 2008,89(1):13-19.
[6]Bag H, Turker A R, Lale M, et al. Separation and speciation of Cr(Ⅲ) and Cr(Ⅵ) with Saccharomyces cereisiae immobilized on sepiolite and determination of both species in water by FAAS[J]. Talanta,2000,51(5):895-902.
[7]Kot A, Namiesnik J. The role of speciation in analytical chemistry[J].Trends in analytical chemistry,2000,19(2-3):69-79.
[8]Vieira M G A, Oisiovici R M, Gimenes M L, et al. Biosorption of chromium (Ⅵ) using a Sargassum sp. packed-bed column[J]. Bioresource Technology, 2008,99(8):3 094-3 099.
[9]GB/T 8978—1996污水综合排放标准[S].
[10]Kim J S, Choi Y R, Kim Y S, et al. Determination of hexavalent chromium (Cr(Ⅵ) in plastics using organic-assisted alkaline extraction[J]. Analytica Chimica Acta,2011,690(2):182-189.
[11]Lee C F, Chen B H, Huang Y L. Determining Cr(Ⅲ) and Cr(Ⅵ) in urine using a flow injection on-line sorption separation system coupled with electrothermal atomic absorption spectrometry and a UV/nano-Au/TiO2photocatalysis reduction device[J]. Talanta, 2008,77(2):546-550.
[12]国家环境保护局. 水和废水监测分析方法[M]. 3版. 北京:中国环境科学出版社,1989:157-159.
[13]朱敏,林少美,姚琪,等. 离子色谱—电感耦合等离子体质谱联用检测尿样中的三价铬和六价铬[J]. 浙江大学学报(理学版),2007,34(3):326-329.
[14]李金英, 郭冬发, 姚继军,等. 电感耦合等离子体质谱(ICP-MS)新进展[J]. 质谱学报,2002, 23(3): 164-179.
[15]阮桂色. 电感耦合等离子体原子发射光谱(ICP-AES)技术的应用进展[J]. 中国无机分析化学,2011,1(4):15-18.
[16]Gili P, Mederos A, Lorenzo-Luis P A, et al. On the interaction of compounds of chromium (VI) with hydrogen peroxide. A study of chromium (Ⅵ) and (Ⅴ) peroxides in the acid-basic pH range[J]. Inorganica Chimica Acta,2002,331(1):16-24.
[17]GB/T 7476—1987水质六价铬的测定 二苯碳酰二肼分光光度法[S].
[18]陈秀琴,张红菊. 工业废水中测定六价铬的预处理技术[J]. 环境监测管理与技术,2001,13(2):33-34.
